外源Spd对低温胁迫下甜瓜幼苗光合与抗氧化特性及其相关基因表达的影响
张永平,张红梅,顾海峰,张文献,范红伟,刁倩楠,张 辉*
(1 上海市农业科学院园艺研究所,上海市设施园艺技术重点实验室, 上海201403;2 上海市嘉定区农业技术推广服务中心,上海201800; 3 上海市农业技术推广服务中心,上海201103)
甜瓜(CucumismeloL.)为喜温耐热植物,具有植株生长速度快、供应时期长、产量高、效益好等优点,已成为中国设施栽培的主要水果型蔬菜作物之一[1]。在早春设施甜瓜栽培中经常遇到低温弱光,低温影响植物生长和发育,降低了植物的光合效率,导致类囊体膜蛋白变性,叶绿体遭到破坏,使光系统Ⅱ活性降低,从而出现光抑制现象[2-4]。此外,植物在一定低温范围内通过提高抗氧化酶活性来维持体内自由基产生与清除间的动态平衡,保护植物避免逆境条件下氧化损伤[5-6]。
1 材料和方法
1.1 材料培养与处理
供试的甜瓜品种为‘世纪蜜’(耐低温品种)和‘GL-1’(低温敏感品种),种子由上海市农业科学院园艺研究所提供,试验在上海市农业科学院园艺研究所进行。将饱满、整齐一致的种子浸种催芽,出芽后播于装有西甜瓜专用育苗基质的塑料营养钵中,放置于昼(28±1) ℃/夜(22±1) ℃培养室中进行幼苗培养,光照12 h,光照强度为400 μmol·m-2·s-1左右。
依据作者前期研究结果[16]和前期温度筛选试验结果,当幼苗长至三叶一心时,选择长势一致、生长健壮的植株进行4种试验处理。(1)常温下喷施蒸馏水作对照(CK);(2)常温下喷施1 mmol·L-1的Spd(Spd);(3)低温下喷施蒸馏水(LT);(4)低温下喷施1 mmol·L-1的Spd (Spd+LT)。每种处理20株,幼苗叶片喷施Spd溶液,至叶面滴水,每天喷1次。常温为昼(28±1)℃/夜(22±1)℃,低温胁迫为昼(12±1)℃/夜(6±1)℃。低温处理与对照培养箱除温度不同外,光照和湿度状况均一致。低温培养7 d后温度调为常温,进行7 d恢复处理。处理7 d和恢复7 d分别测定生长指标,然后取幼苗生长点下第2片完全展开叶片测定叶绿素含量、光合作用和叶绿素荧光参数及抗氧化酶活性和基因表达等指标,每处理25株,3次重复。
1.2 测定项目与方法
1.2.1生长指标幼苗株高用刻度直尺测量(子叶节至生长点);茎粗利用游标卡尺测量,即子叶展开方向的子叶节的直径;叶片面积用Li-3100型叶面积测试仪(美国Li-COR公司)测量;鲜重在地上部分取样后用自来水冲洗干净用吸水纸吸干后称量。
1.2.2光合作用参数叶绿素含量参照李合生[17]的方法进行测定;净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)利用LI-6400光合仪(美国LI-COR公司生产)于上午9:00~11:00测定,测定时光照强度约800 μmol·m-2·s-1,温度为(30±1)℃, 大气CO2浓度约为(400±10)μmol·mol-1;然后根据测定结果计算气孔限制值(Ls)和水分利用效率(WUE)。Ls=1-Ci/Co(Co为叶外空气CO2浓度),WUE=Pn/Tr[18]。
1.2.3叶绿素荧光参数利用PAM-2100型便携式荧光仪(德国Walz公司)测定叶绿素荧光参数。测定时先将所测试材料充分暗适应30 min以上,在室温下测定每株叶片暗适应下的初始荧光(Fo)和最大光化学效率(Fv/Fm);在600 μmo1·m-2·s-1光量子通量下测定光系统Ⅱ光能捕获效率(Fv′/Fm′)和表观光合电子传递速率(ETR);光系统Ⅰ和光系统Ⅱ之间的激发能分配系数(α和β)按Braun和Malkin的公式计算,光系统Ⅰ激发能分配系数(α)=f/(1+f),光系统Ⅱ激发能分配系数(β)=1/(1+f),f= (Fm′-Fs) /(Fm′-Fo′)[19]。
1.2.4抗氧化酶活性甜瓜叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性测定参照张永平等[16]的方法。
1.2.5RNA提取及荧光定量PCR分析甜瓜叶片总RNA采用TaKaRa公司的Total RNA提取试剂说明书提取,之后反转录成cDNA备用;引物具体见表1[1];依据试剂盒(SuperReal PreMix SYBR Green)说明书要求确定实时荧光定量反应体系为25 μL:cDNA模版 2 μL;正、反向引物(10 μmol·L-1)各0.75 μL;2×Super-Real PreMix 12.5 μL; 9 μL RNase-free,最后用ddH2O补充至25 μL。根据引物的扩增条件设计qPCR 反应条件: 95 ℃预变性15 min;95 ℃ 变性15 s;X ℃(各对引物具体退火温度如表1所示)退火20 s;72 ℃延伸30 s;40 个循环。分析各样品溶解曲线,确定引物的特异性扩增,重复3 次,以Actin 为内参基因。利用Microsoft Excel 2003软件进行数据处理并将结果(2-ΔΔCt)转化成线性关系,进行统计学分析。
1.3 数据分析
每个指标测定重复3次,取平均值。数据采用Origin软件绘图,用SPSS统计软件对平均数用Duncan’s 新复极差法进行多重比较。
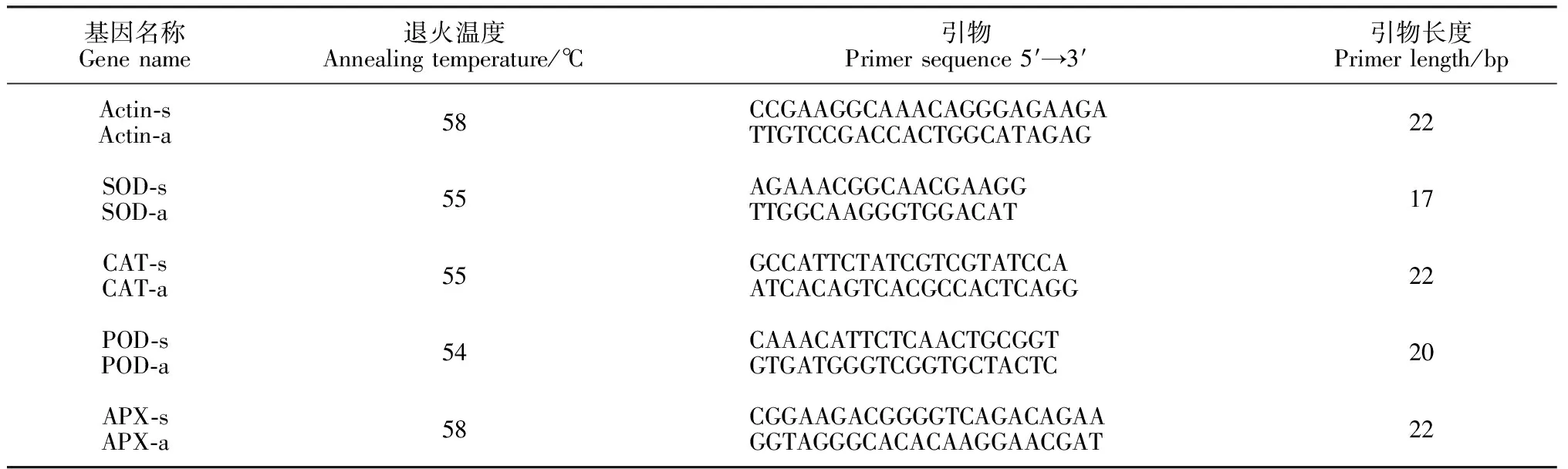
表1 引物设计
2 结果与分析
2.1 外源Spd对低温胁迫下甜瓜幼苗生长的影响
由图1可以看出,低温胁迫7 d时(LT),‘世纪蜜’幼苗的株高、叶面积和地上鲜重分别比对照(CK)显著下降了22.92%、35.76%和25.67%,‘GL-1’则分别显著下降了31.00%、40.33%和30.20%,而2个甜瓜品种幼苗茎粗则与CK差异不显著,即低温胁迫对‘GL-1’生长的抑制程度明显大于‘世纪蜜’;Spd单独处理时(Spd),2个品种的生长指标均不同程度地高于CK,但除‘世纪蜜’株高外均未达到显著水平;与LT处理相比,Spd+LT处理使2个甜瓜品种的株高、叶面积和地上鲜重显著增加(‘世纪蜜’地上鲜重除外),‘世纪蜜’分别增加了24.86%、38.69%和13.53%,‘GL-1’分别增加了24.68%、45.36%和21.76%,‘GL-1’的叶面积和地上鲜重增加幅度大于‘世纪蜜’,它们稍低于同期CK。同时,常温恢复7 d后,2个甜瓜品种生长量变化规律与低温胁迫7 d相似。由此可见,低温胁迫显著抑制了甜瓜幼苗生长,外源Spd能有效缓解低温胁迫对甜瓜幼苗生长的抑制作用,且对低温胁迫敏感品种‘GL-1’效果好于耐低温品种‘世纪蜜’。
2.2 外源Spd对低温胁迫下甜瓜幼苗叶绿素含量的影响
图2显示,在LT处理7 d时,2个甜瓜品种幼苗叶片叶绿素含量显著低于CK,此时‘世纪蜜’叶绿素a、叶绿素b、叶绿素a+b和叶绿素a/b分别比CK显著下降了46.72%、32.78%、42.34%和20.80%,‘GL-1’则分别显著降低了51.00%、45.37%、49.16%和10.11%;与LT相比,Spd+LT处理显著提高甜瓜幼苗的叶绿素a、叶绿素b、叶绿素a+b和叶绿素a/b含量,‘世纪蜜’分别增加了65.30%、32.07%、53.12%和25.10%,‘GL-1’分别增加了84.52%、21.22%、62.37%和52.42%。同时,在常温恢复7 d后,2个甜瓜品种幼苗叶片叶绿素a、叶绿素a+b含量和叶绿素a/b在各处理下的变化趋势与低温胁迫7 d时相似,但其叶绿素b含量在Spd+LT处理与LT处理间差异不显著。可见,外源Spd可能通过提高幼苗叶片内叶绿素含量来促进其光合作用的进行,从而增强其对低温胁迫的抗性。
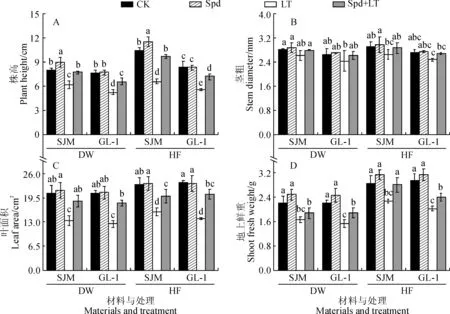
CK.常温喷施蒸馏水;Spd.常温下喷施1 mmol·L-1 Spd;LT. 低温下喷施蒸馏水;Spd+LT.低温下喷施1 mmol·L-1 Spd;SJM和GL-1分别为品种‘世纪密’和‘GL-1’;DW.低温胁迫7 d; HF. 低温胁迫结束后常温回复7 d;同一处理时间内不同小写字母表示同期处理间在0.05水平存在显著性差异(P<0.05)。下同图1 外源Spd对低温胁迫下甜瓜幼苗生长的影响CK. Control, normal temperature and distilled water; Spd. Normal temperature and 1 mmol·L-1 Spd;LT. Low temperature and distilled water; Spd+LT. Low temperature and 1 mmol·L-1 Spd;SJM and GL-1 stand for variety Shijimi and GL-1, respectively; DW. Chilling stress for 7 days; HF. Recovering for 7 days after chilling stress; Means followed by different normal letters within same treatment indicate significant difference among treatments at 0.05 level. The same as followingFig.1 Effects of exogenous spermidine on the growth of melon seedlings under low temperature stress
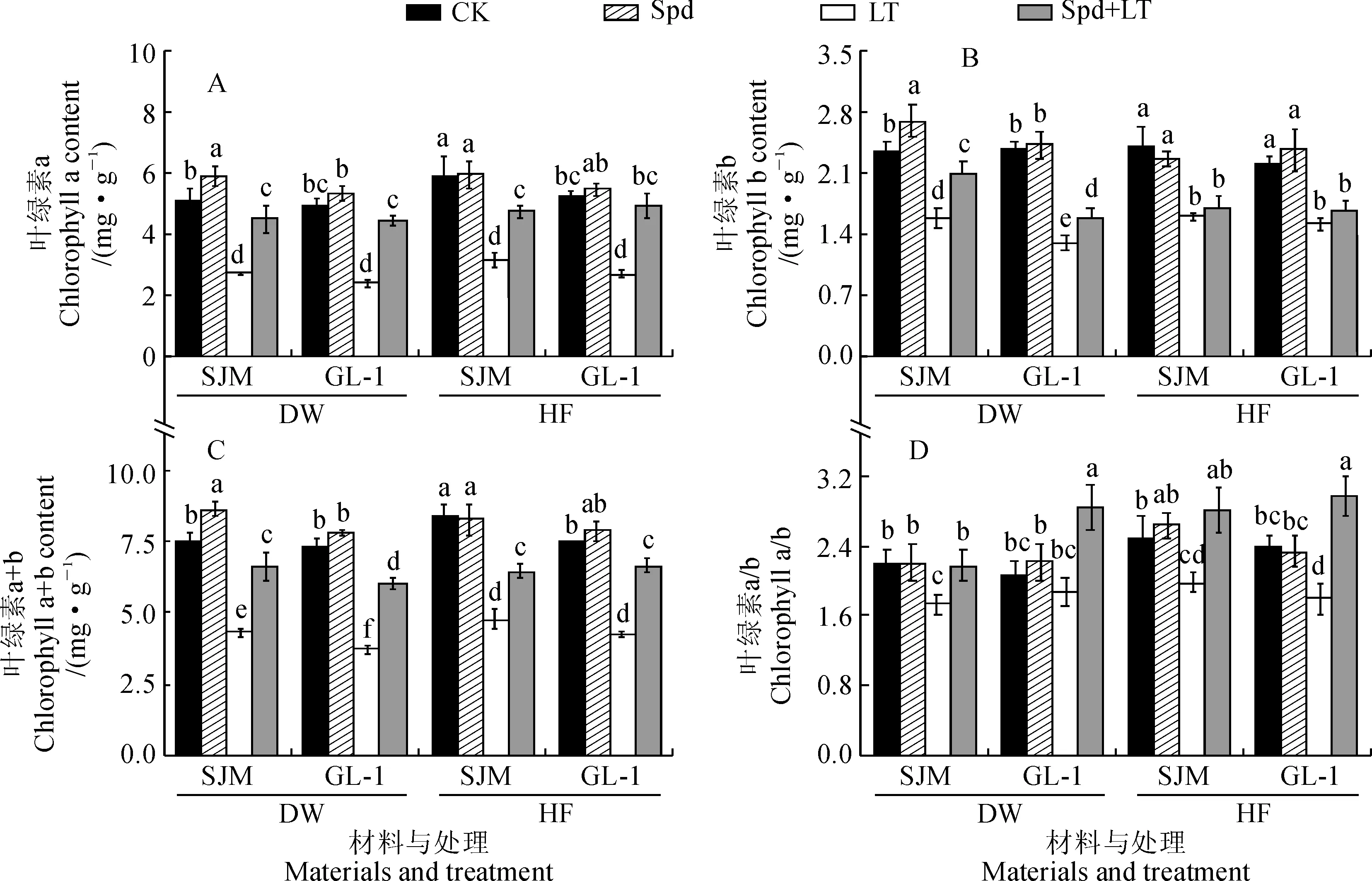
图2 外源Spd对低温胁迫下甜瓜幼苗叶绿素含量的影响Fig.2 Effects of exogenous spermidine on chlorophyll contents of melon seedlings under low temperature
2.3 外源Spd对低温胁迫下甜瓜幼苗光合作用的影响
图3,A显示,低温胁迫7 d和常温恢复7 d时,LT处理‘世纪蜜’甜瓜幼苗叶片净光合速率(Pn)分别比CK显著降低了66.79%和52.25%,‘GL-1’则分别显著降低了70.30%和61.30%,‘GL-1’降幅大于‘世纪蜜’; Spd+LT处理‘世纪蜜’Pn分别比LT处理显著提高了139.87%和92.65%,‘GL-1’则分别显著提高了144.23%和125.86%,‘GL-1’增加幅度大于‘世纪蜜’; Spd单独处理时,2个甜瓜品种幼苗的Pn也比CK显著增加,但增加幅度明显小于Spd+LT处理。
与此同时,2个甜瓜品种幼苗叶片气孔导度(Gs)、蒸腾速率(Tr)和气孔限制值(Ls)与Pn的变化趋势基本一致; Spd+LT处理‘世纪蜜’Gs、Tr和Ls在低温胁迫7 d时分别比相应LT处理显著增加了186.64%、147.93%和66.50%,而‘GL-1’则分别显著增加了389.54%、206.62%和108.79%, ‘GL-1’增加幅度明显大于‘世纪蜜’(图3,B、D、E)。
另外,2个甜瓜品种叶片的胞间CO2浓度(Ci)在LT处理下比CK显著增加, ‘世纪蜜’在低温胁迫7 d和常温恢复7 d时增幅分别为92.78%和42.57%, ‘GL-1’增幅分别为108.73%和72.08%;而2品种的Ci在Spd+LT处理下比LT处理显著降低(图3,C)。
此外,2个甜瓜品种水分利用效率(WUE)在低温胁迫7 d时比CK显著增加,‘世纪蜜’和‘GL-1’增幅分别为78.88%和77.78%,而在常温恢复7 d时 ‘世纪蜜’的WUE比CK降低,‘GL-1’ 比CK增加幅度变小;与LT处理相比, Spd+LT处理 ‘世纪蜜’WUE在低温胁迫7 d时稍有降低,而此时‘GL-1’显著降低,在常温恢复7 d时,Spd+LT处理‘世纪蜜’WUE显著增加,‘GL-1’变化不显著(图3,F)。由此可见,低温胁迫显著抑制了甜瓜幼苗光合作用, Spd处理能不同程度提高甜瓜幼苗Pn、Gs、Tr和Ls, 并降低了Ci,且对低温敏感品种‘GL-1’作用效果明显大于耐低温品种‘世纪蜜’。
2.4 外源Spd对低温胁迫下甜瓜幼苗叶绿素荧光参数的影响
首先,在低温胁迫7 d和常温恢复7 d时,LT处理 ‘世纪蜜’甜瓜幼苗的初始荧光(Fo)比CK 分别显著升高了79.95%和45.23%,‘GL-1’ 分别显著升高了107.48%和31.38%;同时, Spd+LT处理‘世纪蜜’甜瓜幼苗的Fo比LT处理分别显著降低了31.48%和33.50%,‘GL-1’ 则分别显著降低了30.44%和14.57%(图4,A)。
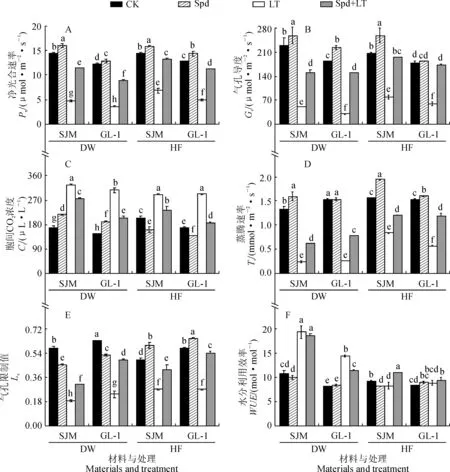
图3 外源Spd对低温胁迫下甜瓜幼苗光合作用的影响Fig.3 Effects of exogenous spermidine on photosynthesis of melon seedlings under low temperature stress
其次,2品种甜瓜幼苗叶片最大光化学效率(Fv/Fm)、光系统Ⅱ光能捕获效率(Fv′/Fm′)和表观光合电子传递速率(ETR)在低温胁迫下变化趋势基本一致(图4,B、C和D)。其中,LT处理‘世纪蜜’甜瓜幼苗的Fv/Fm、Fv′/Fm′和ETR在低温胁迫7 d时 分别比CK显著降低了38.84%、52.68%和62.53%,‘GL-1’则分别显著降低了47.67%、56.31%和59.40%,耐低温品种‘世纪蜜’的Fv/Fm和Fv′/Fm′下降幅度小于低温敏感品种‘GL-1’;同时,Spd+LT处理均显著提高低温胁迫下2个甜瓜品种的Fv/Fm,Fv′/Fm′和ETR,而Spd单独处理对2个甜瓜品种的Fv/Fm、Fv′/Fm′和ETR影响不显著。
另外,低温胁迫7 d和常温恢复7 d时,耐低温品种‘世纪蜜’光系统Ⅰ激发能分配系数(α)在LT处理下分别比CK显著降低了72.47%和30.90%,其Spd+LT处理的α分别比LT处理显著增加了249.67%和225.02%;同期‘GL-1’品种各处理间α值差异不显著(图4,E)。2甜瓜品种光系统Ⅱ激发能分配系数(β)的变化趋势正好与α相反(图4,F),在低温胁迫7 d和常温恢复7 d时,耐低温品种‘世纪蜜’的β在LT处理下均显著高于CK,其在Spd+LT处理下均比LT处理显著降低;同期‘GL-1’ 品种的β在各处理间也差异不显著。
以上结果说明,低温胁迫使甜瓜幼苗明显受到光抑制,外源Spd不同程度地提高了甜瓜幼苗Fv/Fm、Fv′/Fm′和ETR,并降低了Fo,使光抑制程度得到显著缓解。
2.5 外源Spd对低温胁迫下甜瓜幼苗抗氧化酶活性的影响
低温胁迫7 d时,2个甜瓜品种幼苗4种抗氧化酶活性变化趋势相接近(图5)。其中,LT处理‘世纪蜜’幼苗的SOD、POD、CAT和APX活性分别比CK升高了44.24%、129.14%、 169.44%和58.53%,同期‘GL-1’分别比CK升高了38.83%、158.43%、72.57%和46.61%, ‘GL-1’升高幅度低于‘世纪蜜’(POD活性除外);与LT处理相比, Spd+LT处理‘世纪蜜’甜瓜幼苗的SOD、POD、CAT和APX活性分别升高了62.38%、43.37%、25.41%和91.63%, ‘GL-1’甜瓜则分别升高了33.94%、44.57%、59.65%和47.25%;与CK相比,Spd单独处理2甜瓜品种幼苗抗氧化酶活性变化不显著(SOD活性除外)。常温恢复7 d时,与CK相比,LT处理2个甜瓜品种POD活性变化不显著,而其SOD和CAT活性显著增加,‘世纪蜜’增幅分别为50.75%和53.24%,‘GL-1’增幅分别为11.29%和102.13%;与LT处理相比,Spd+LT处理均提高了2个甜瓜品种幼苗的各抗氧化酶活性, 且‘GL-1’升高幅度大于‘世纪蜜’。可见, Spd对低温胁迫下甜瓜幼苗抗氧化酶活性的提高有显著促进作用,从而增强植株的抗低温能力。
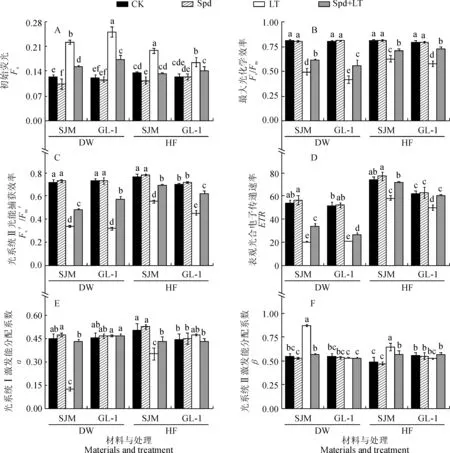
图4 外源Spd对低温胁迫下甜瓜幼苗叶绿素荧光参数的影响Fig.4 Effects of exogenous spermidine on chlorophyll fluorescent parameters of melon seedlings under low temperature stress
2.6 外源Spd对低温胁迫下甜瓜幼苗抗氧化酶基因相对表达量的影响
由图6可知,在低温胁迫7 d时, LT处理‘世纪蜜’幼苗的CmSOD、CmPOD、CmCAT和CmAPX基因相对表达量分别比CK显著升高了27.99%、100.51%、 257.93%和146.63%(图6),‘GL-1’则分别显著升高了95.13%、105.06%、313.42%和167.10%, ‘GL-1’升高幅度大于‘世纪蜜’;与LT处理相比,Spd+LT处理 ‘世纪蜜’幼苗的CmSOD、CmPOD、CmCAT和CmAPX相对表达量分别升高了36.91%、58.63%、82.86%和88.64%,‘GL-1’幼苗分别升高了43.19%、22.64%、25.40%和14.00%;与CK相比,Spd处理‘世纪蜜’CmCAT和CmAPX基因相对表达量显著增加,其余基因相对表达量差异均不显著。在常温恢复7 d时,与CK相比,LT处理两个甜瓜品种CmAPX基因相对表达量,以及‘世纪蜜’CmSOD和‘GL-1’CmCAT基因相对表达量变化均不明显,其余基因表达量均显著增加;与LT处理相比,Spd+LT处理均提高了2个甜瓜品种幼苗的各抗氧化酶基因相对表达量, 且‘GL-1’品种升高幅度大于‘世纪蜜’品种。可见,低温胁迫下,外源Spd可以在转录水平上调控甜瓜抗氧化酶基因表达,CmSOD、CmPOD、CmCAT和CmAPX基因相对表达量显著高于低温胁迫处理,有效减缓低温胁迫对甜瓜幼苗的伤害。
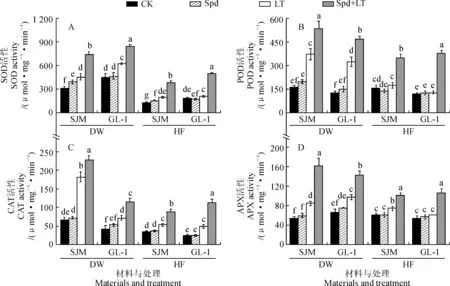
图5 外源Spd对低温胁迫下甜瓜幼苗抗氧化酶活性的影响Fig.5 Effects of exogenous spermidine on antioxidant enzyme activities of melon seedlings under low temperature stress
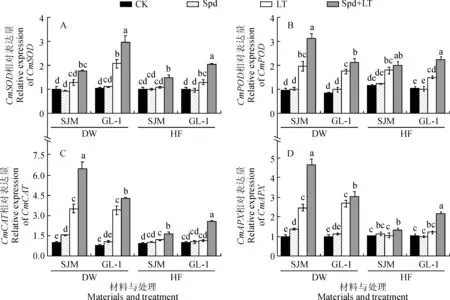
图6 外源Spd对低温胁迫下甜瓜幼苗抗氧化酶基因相对表达量的影响Fig.6 Effects of exogenous spermidine on relative expression of CmSOD, CmPOD, CmCAT and CmAPX of melon seedlings under low temperature stress
3 讨 论
生长受到抑制、生物量降低是植物对低温胁迫的最敏感生理响应[20]。本研究表明,低温胁迫(LT)7 d显著抑制了甜瓜幼苗的生长,幼苗株高、叶面积和地上鲜重均显著低于对照,并且低温敏感品种‘GL-1’下降幅度大于耐低温品种‘世纪蜜’,这与胡俊杰等[21]在大豆上的研究结果一致;同时,喷施Spd可以明显提高甜瓜幼苗在低温胁迫下的生长,且LT+Spd处理对‘GL-1’植株生长的影响大于‘世纪蜜’,不同品种存在差异的原因可能与自身抗低温能力的不同以及Spd多重复杂的生理功能有关。但当室温恢复7 d时,2品种甜瓜植株生长量依然较低,说明其还未从低温胁迫中完全恢复。
叶绿素(主要包括叶绿素a和叶绿素b)是植物进行光合作用的物质基础,发挥着捕获和传递光能的作用;叶绿素a/b可以反映类囊体在叶绿体中的垛叠程度,该比值降低则表明光能向生物化学能的转化效率下降[22]。本试验结果显示,与CK相比,低温胁迫下2个甜瓜品种幼苗叶片叶绿素a、叶绿素b、叶绿素a+b含量和叶绿素a/b均显著降低,叶绿素a/b比值降低表明低温胁迫干扰了叶片叶绿素构成,即叶绿素a的合成对低温胁迫更为敏感,这与郑春芳等[23]对低温胁迫下秋茄的研究结果相似。同时,本试验通过叶面喷施Spd显著提高了低温胁迫下2种耐低温性不同的甜瓜幼苗光合色素含量,又说明外源Spd可缓解低温胁迫下甜瓜幼苗叶片叶绿素含量的下降,这与姜秀梅等[24]在辣椒幼苗上的研究结论一致。另外,本试验中外源Spd对耐低温性弱的甜瓜品种‘GL-1’叶绿素含量下降的缓解效果大于耐低温性强的‘世纪蜜’(叶绿素b含量除外),这可能是因为耐低温性弱的‘GL-1’对周围环境的变化更敏感,外源Spd可能降低了低温胁迫下植物体中叶绿素酶的活性,抑制了因低温胁迫引起的叶绿素的降解,从而提高了低温胁迫下幼苗叶片叶绿素含量。说明低温胁迫下光合色素的变化可能还与作物基因型有关,而不同基因型的幼苗对外源Spd处理的响应可能也存在差异。
植物光合作用效率降低主要包括气孔部分关闭导致的气孔限制和叶肉细胞光合活性下降导致的非气孔限制2个方面的原因[25]。如果Ci和Gs同时下降,说明气孔因素是引起光合速率下降的主要原因;如果Gs下降,而Ci维持不变甚至上升,则说明叶肉细胞同化能力降低等非气孔因素是引起光合速率下降的主要原因[26]。早期研究发现[27],低温胁迫下甜瓜幼苗叶片Pn的降低主要是因为非气孔限制所致,并认为这与叶绿素含量下降和活性氧代谢失调等有关。本研究中低温胁迫7 d显著降低了2个甜瓜幼苗叶片Gs和Ls,反而提高了Ci,所以认为本研究中甜瓜幼苗Pn的下降也与非气孔限制因素有关;同时,常温恢复7 d后,甜瓜叶片Pn、Gs和Ls仍显著低于CK,而Ci显著高于CK,表明低温胁迫对甜瓜幼苗光合作用造成的伤害仍存在;此外,与CK相比,低温胁迫7 d时2个甜瓜品种幼苗叶片水分利用率显著提高,但‘世纪蜜’升高幅度大于‘GL-1’,这可能与二者的净光合速率和蒸腾速率的降幅不同有关。本研究还发现,外源Spd处理可显著提高低温胁迫下甜瓜幼苗叶片Pn、Gs和Ls,抑制Ls增加,并加速植株光合能力的恢复。可见,Spd处理可以维持植株叶片类囊体膜结构的完整性,增强光合机构对低温胁迫的适应能力,减少非气孔限制因素对光合作用的影响[28]。
叶绿素荧光参数可表征植物PSⅡ的运行状态,Fv/Fm可反映植物PSⅡ受光抑制的状况[3]。本研究中,低温胁迫7 d时,2个甜瓜品种叶片Fv/Fm明显降低,且‘GL-1’ 降低幅度大于‘世纪蜜’,受光抑制程度更严重,同时Fo上升、Fv′/Fm′和ETR降低是低温胁迫导致PSⅡ反应中心失活所致,又表明非化学能量耗散加强,叶片光能利用率降低;在常温恢复7 d时,叶片Fv/Fm降低幅度有所缓解,说明光抑制导致的伤害是可逆的。另外,Spd处理显著提高了低温胁迫下甜瓜叶片Fv/Fm、Fv′/Fm′和ETR值,明显降低了Fo,有效缓解了低温胁迫对甜瓜幼苗PSⅡ反应中心活性的伤害,提高了细胞内CO2的同化效率,从而促进甜瓜幼苗植株的生长,最终表现为植株生物量增加。
综上所述,在低温胁迫条件下,两个甜瓜幼苗生长均受到抑制,低温敏感品种 ‘GL-1’ 受到抑制程度大于耐低温品种‘世纪蜜’;同时,2个甜瓜品种幼苗光合色素含量和光合作用效率下降,并由于植株自身对低温的应激能力,它们抗氧化酶活性和相关基因表达水平显著增加。外源Spd能够促进甜瓜诱导抗氧化酶相关基因的表达,提高抗氧化酶活性,延缓叶绿素降解,提高光合作用效率,从而有效缓解低温胁迫对甜瓜幼苗生长的抑制作用,最终提高幼苗对低温的适应性,且对低温敏感品种‘GL-1’促进效果优于耐低温品种‘世纪蜜’。
参考文献:
[1] 李敬蕊, 杨丽文, 王春燕, 等. γ-氨基丁酸对低氧胁迫下甜瓜幼苗抗氧化酶活性及表达的影响[J]. 东北农业大学学报, 2014,45(11): 28-36.
LI J R, YANG L W, WANG C Y,etal. Effect of γ-aminobutyric acid on activities and expression of antioxdative enzyme in melon seedlings under hypoxia stress[J].JournalofNortheastAgriculturalUniversity, 2014,45(11): 28-36.
[2] HIKOSAKA K, ISHIKAWA K,etal. Temperature acclimation of photosynthesis: mechanism involved in the changes in temperature dependence of photosynthetic rate[J].JournalofExperimentalBotany, 2006,57(2): 291-302.
[3] 何 勇, 符庆功, 朱祝军. 低温弱光对辣椒叶片光合作用、叶绿素荧光猝灭及光能分配的影响[J]. 核农学报, 2013,27(4): 479-486.
HE Y, FU Q G, ZHU Z J. Effects of chilling under low irradiance on photosynthesis, chlorophyll fluorescence quenching and light allocation in pepper leaves[J].JournalofNuclearAgriculturalSciences, 2013,27(4): 479-486.
[4] 任丽丽, 高辉远. 低温弱光胁迫对野生大豆和大豆栽培种光系统功能的影响[J]. 植物生理与分子生物学学报, 2007,33(4): 333-340.
REN L L, GAO H Y. Effects of chilling stress under weak light on function of photosystems in leaves of wild soybean and cultivator soybean[J].JournalofPlantPhysiologyandMolecularBiology, 2007,33(4): 333-340.
[5] THEOCHARIS A, CLÉMENT C, BARKA E A. Physiological and molecular changes in plants grown at low temperatures[J].Planta, 2012,235(6): 1 091-1 105.
[6] 秦文斌, 山 溪, 张振超, 等. 低温胁迫对甘蓝幼苗抗逆生理指标的影响[J]. 核农学报, 2018,32(3): 576-581.
QIN W B, SHAN X, ZHANG Z Cetal. Effects of low temperature stress on anti-stress physiological indexes of cabbage seedlings[J].JournalofNuclearAgriculturalSciences, 2018,32(3): 576-581.
[7] BOUCHEREAU A, AZIZ A, LARHER F, MARTIN-TANGUY J. Polyamines and environmental challenges: recent development[J].PlantScience, 1999,140(2): 103-125.
[8] 朱自学, 古红梅, 杜红阳, 等. 渗透胁迫下大豆幼苗叶片亚精胺与活性氧清除系统的变化[J]. 安徽农业科学, 2007,35(26): 8 111-8 113.
ZHU Z X, GU H M, DU H Y,etal. Changing between spermidine and antioxidases in leaves of soybean seedlings under osmotic stress[J].JournalofAnhuiAgriculturalSciences, 2007,35(26): 8 111-8 113.
[9] BARNAWAL D, BHARTI N, MAJI D,etal. 1-Aminocyclopropane-1-carboxylic acid(ACC) deaminase-containing rhizobacteria protectOcimumsanctumplants during waterlogging stress via reduced ethylene generation[J].PlantPhysiologyandBiochemistry, 2012,58(9): 227-235.
[10] 李 秀, 巩 彪, 徐 坤. 外源亚精胺对高温胁迫下生姜叶片内源激素及叶绿体超微结构的影响[J]. 中国农业科学, 2015,48(1): 120-129.
LI X, GONG B, XU k. Effect of exogenous spermidine on leaves of endogenous hormones and chloroplast ultrastructure of ginger leaves under heat stress[J].ScientiaAgriculturaSinica, 2015,48(1): 120-129.
[11] 尤东玲, 张 星, 于康珂, 等. 亚精胺对淹水胁迫下玉米幼苗生长和生理特性的影响[J]. 玉米科学, 2016,24(1): 74-80, 87.
YOU D L, ZHANG X, YU K K,etal. Effect of exogenous spermidine on growth and physiological properties of maize seedling under waterlogging stress[J].JournalofMaizeSciences, 2016,24(1): 74-80, 87.
[12] 李 斌, 郭世荣, 孙 锦, 等. 外源Spd对盐胁迫下黄瓜幼苗生长和活性氧代谢的影响[J]. 江苏农业学报,2012,28(1): 152-157.
LI B, GUO S R, SUN J,etal. Effect of exogenous spermidine on cucumber seedling growth and reactive oxygen metabolism under salt stress[J].JiangsuJournalofAgriculturalSciences, 2012,28(1): 152-157.
[13] 尹璐璐, 杨秀华, 李 坤, 等. 亚精胺预处理对黄瓜幼苗抗冷性的影响[J]. 园艺学报, 2007,34(5): 1 309-1 312.
YIN L L, YANG X H, LI K,etal. Effect of spermidine on chilling-tolerance in cucumber seedlings[J].ActaHorticulturaeSinica, 2007,34(5): 1 309-1 312.
[14] 程明明, 杜红阳, 刘怀攀. 外源亚精胺对涝胁迫下玉米幼苗根的氧化伤害缓解效应[J]. 南方农业学报, 2015,46(1): 36-41.
CHENG M M, DU H Y, LIU H P. Mitigating effects of exogenous spermidine on oxidative injury induced by waterlogging stress in the roots of maize seedlings[J].JournalofSouthernAgriculture, 2015,46(1): 36-41.
[15] 苏晓琼, 王美月, 束 胜, 等. 外源亚精胺对高温胁迫下番茄幼苗快速叶绿素荧光诱导动力学特性的影响[J]. 园艺学报, 2013,40(12): 2 409-2 418.
SU X Q, WANG M Y, SHU S,etal. Effects of exogenous Spd on the fast chlorophyll fluorescence induction dynamics in tomato seedlings under high temperature stress[J].ActaHorticulturaeSinica, 2013,40(12): 2 409-2 418.
[16] 张永平, 许 爽, 杨少军, 等. 外源亚精胺对低温胁迫下甜瓜幼苗生长和抗氧化系统的影响[J]. 植物生理学报,2017,533(6): 1 087-1 096.
ZHANG Y P, XU S, YANG S J,etal. Effect of exogenous spermidine on the growth and antioxidant system of melon seedlings under low temperature stress[J].PlantPhysiologyJournal, 2017,533(6): 1 087-1 096.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000: 167-169.
[18] 李 伟, 黄金丽, 眭晓蕾, 等. 黄瓜幼苗光合及荧光特性对弱光的响应[J]. 园艺学报, 2008,35(1): 119-122.
LI W, HUANG J L, SUI X L,etal. Effects of low light on photosynthetic and fluorescent characteristics of seedlings ofCucumissativus[J].ActaHorticulturaeSinica, 2008,35(1): 119-122.
[19] BRAUN G, MALKIN S. Regulation of the imbalance in light excitation between photosystem Ⅱ and photosystem Ⅰ by cations and by the energized state of the thylakoid membrance[J].BiochimicaetBiophysicaActa, 1990, 1 017: 79-90.
[20] PIERRET A, DOUSSAN C, CAPOWIEZ Y,etal. Root functional architecture: A framework for modeling the inter-play between roots and soil[J].VadoseZoneJournal, 2007,6(2): 269-281.
[21] 胡俊杰, 张古文, 胡齐赞, 等. 低温胁迫对菜用大豆生长、叶片活性氧及多胺代谢的影响[J]. 浙江农业学报, 2011,23(6): 1 113-1 118.
HU J J, ZHANG G W, HU Q Z,etal. Effects of chilling stress on growth, metabolism of reactive oxygen species and polyamines in vegetable soybean seedlings[J].ActaAgriculturaeZhejiangensis, 2011,23(6): 1 113-1 118.
[22] 项锡娜, 陈泰豪, 吴月燕, 等. 盐胁迫对红叶石楠‘鲁班’生理生化特性及叶片显微结构的影响[J]. 植物生理学报, 2014,50(7): 917-924.
XIANG X N, CHEN T H, WU Y Y,etal. Effect of salt stress on physio-biochemical characteristics and leaf micro-structure inPhotiniaglabra‘Rubens’ seedlings[J].PlantPhysiologyJournal, 2014,50(7): 917-924.
[23] 郑春芳, 陈继浓, 仇建标, 等.烯效唑对低温胁迫下秋茄幼苗光合作用与抗氧化系统的影响[J]. 植物生理学报, 2016,52(1): 109-116.
ZHENG C F, CHEN J N, QIU J B,etal. Effect of uniconazole on photosynthesis and antioxidant system inKandeliaobovateseedlings under low temperature stress[J].PlantPhysiologyJournal, 2016,52(1): 109-116.
[24] 姜秀梅, 秦 勇, 努斯热提·库吐丁, 等. 外源物质处理下辣椒幼苗对低温胁迫的生理响应[J]. 新疆农业科学, 2014,51(10): 1 821-1 829.
JIANG X M, QIN Y, NUSIRETI K T D,etal. Physiological response of pepper seedlings to low temperature stress under exogenous substance treatment[J].XinjiangAgriculturalSciences, 2014,51(10): 1 821-1 829.
[25] CHAVES M M, FLEXAS J, PINHEIRO C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell[J].AnnBot, 2009, 103: 551-560.
[26] FARQUHAR G D, SHARKEYT D. Stomatal conductance and photosynthesis[J].AnnualReviewofPlantPhysiology, 1982,23(1): 317-345.
[27] ZHANG Y P, YANG S J, CHEN Y Y. Effects of melatonin on photosynthetic performance and antioxidants in melon during cold and recovery[J].BiologiaPlantarum, 2017,61(3): 571-578.
[28] SHU S, YUAN L Y, GUO S R,etal. Effects of exogenous spermidine on photosynthesis, xanthophyll cycle and endogenous polyamines in cucumber seedlings exposed to salinity[J].AfrJBiotechnol, 2012,11(22): 6 064-6 074.
[29] GILL SS, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].PlantPhysiologyandBiochemistry, 2010,48(12): 909-930.
[30] KASUKABE Y, HE L, NADA K,etal. Overexpression of spermidine synthase enhances tolerance to multiple environmental stress and up-regulates the expression of various stress-regulated genes in transgenicArabidopsisthaliana[J].PlantandCellPhysiology, 2004, 45: 712-722.
[31] 李 州, 李 燕. 亚精胺对水分胁迫下白三叶脯氨酸代谢、抗氧化酶活性及其基因表达的影响[J]. 草业学报, 2015,24(4): 148-156.
LI Z, LI Y. Effects of spermidine on proline metabolism, antioxidant enzyme activity and gene expression in white clover leaves under water stress[J].ActaPratacultureSinica, 2015,24(4): 148-156.

