谷物膳食纤维及其改性产品抑制红肉胆碱代谢研究进展
李 茜 吴 涛 刘 锐 张 民
(天津科技大学新农村发展研究院;天津科技大学食品工程与生物技术学院;天津食品安全低碳 制造协同创新中心; 食品生物技术教育部工程研究中心,天津 300457)
食品品质和营养是食品产业发展的基石,随着人们对膳食营养平衡的关注,以及膳食纤维表现出的催生全民健康的巨大社会价值,膳食纤维及相关食品的开发和应用引起了广泛的关注[1]。膳食纤维主要是指植物中天然存在的、提取的或合成的碳水化合物的聚合物,不能被人类的胃肠道中消化酶所消化的、且不被人体吸收利用的非淀粉多糖[2]。它相对完整地通过人体的胃、小肠、结肠,然后排出体外。
膳食纤维(Dietary fiber,DF)因其特有的结构、化学组成,赋予其独特的理化特性及多重营养特性,是改善或提升食品品质及营养的重要组分之一。根据膳食纤维在水中的溶解度的差异,将其分为水溶性膳食纤维(Soluble Dietary Fiber,SDF)和水不溶性膳食纤维(Insoluble Dietary Fiber,IDF)[3]。SDF更容易在结肠内发酵,并产生具有生理活性的副产物,因其相对较好的加工适应性和更显著的生理功能而被更广泛的应用[4]。
膳食纤维中并不独特的单糖分子结合在一起形成特有的大分子结构,赋予其独特的理化特性及多重营养特性,是改善人体生理代谢的重要营养素[5]。膳食纤维具有吸水膨胀、梯度黏合、阳离子交换、葡萄糖束缚、淀粉酶和胰脂酶活力抑制等能力,而且膳食纤维本身的热量极低。因而,膳食纤维可促进胃肠蠕动,缩短肠道中食物和有毒物质的滞留,降低血液胆固醇和脂质的积累,辅助糖尿病患者控制胰岛素需量,防止餐后血糖的急速上升[6];也可以直接抑制大脑食欲的产生,最终起加速体内脂肪消耗而减肥的作用[7]。麦麸膳食纤维吸水膨胀形成的凝胶还能模拟脂肪的风味和口感,作为低热量的配料部分替代肉制品中的脂肪,可以降低饱和脂肪和胆固醇的膳食摄入[8];此外膳食中直接补充膳食纤维能够降低营养过剩膳食诱导的代谢疾病的风险[9-10]。
膳食纤维主要来源于植物性食物,如大宗粮食的加工副产物麸皮和糠含有丰富的纤维素、半纤维素和木质素等。作为农业大国的中国,小麦麸作为面粉加工的主要副产品,年产量达3 000万t以上,价格低,这一资源的精深加工,将会给农业及食品生产带来极大的经济效益和社会效益,而且还能改善人们的膳食营养。克利夫兰医学中心勒纳研究所的研究者们通过研究食用红肉志愿者体内氧化三甲胺水平发现,肠道内细菌会利用红肉消化后生成的胆碱产生氧化三甲胺,氧化三甲胺的水平高低心血管代谢风险有着密切关系[11-12]。而Zhang等[13]和Barbara等[14]的研究结果表明,麦麸膳食纤维能够改变肠道微生物和蛋白消化,提高饲喂含红肉膳食受试猪大肠微生物健康标记物的水平、肠道内容物和蛋白质的消化量。表明可被肠道菌群发酵的膳食纤维摄入的增加,基于其干预肠道菌群的群落结构和产生有益次级代谢产物等的功效,可能会降低胆碱代谢产生氧化三甲胺的水平。然而目前,由于肠道菌群复杂性及肠道环境的影响,膳食纤维介导肠道菌群和胆碱代谢的机制并未得到明确的结论。
1 膳食纤维抑制膳食红肉胆碱在机体中的代谢
饮食是否科学,食物营养是否合理,是人类社会文明与否的重要标志。随着经济的发展,全世界人民的膳食结构都在发生改变,正在朝着“谷物消费量不足,动物性食物消费量显著增加”的营养过剩型膳食模式转变[15]。流行病学和临床研究及一些动物实验已证实,营养过剩或者膳食不平衡是肥胖病、心脑血管病、II型糖尿病、恶性肿瘤等慢性病的共同危险因素[10,16]。
其中膳食红肉(牛肉、羊肉等)胆碱成分在消化和代谢过程中催生三甲胺及其氧化物对人体健康的危害性已得到越来越多证实[17]。胆碱本身并没有危害,而且还可以加速脂肪代谢,然而当过量胆碱在肠道细菌作用下被分解为三甲胺,进入血液、肝脏等组织,并转化为氧化三甲胺时[12],可致血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)显著增高,引起动脉粥样硬化、心脏病、冠心病等心血管代谢风险的增加[18]。如何通过调整膳食结构来预防这些事件,越来越受到不同领域科学工作者与食品法规、营养教育相关的决策者的高度重视[19]。有学者已经提出了利用谷物水溶性膳食纤维靶向肠道微生物抑制红肉膳食诱导胆碱代谢,减少三甲胺和三甲胺氧化物的产生,达到减少血栓、动脉粥样硬化等发生和发展的目的[14,20-21]。
此外,膳食纤维在结肠部位能选择性被具有特定水解酶的细菌所降解和发酵,为微生物生长提供能量和营养,因而能够维持肠道生态平衡。产生的挥发性短链脂肪酸(short chain fatty acid,SCFA),如乙酸、丙酸和丁酸等,一方面能被宿主肠壁快速吸收利用,形成一系列物质能量代谢通路,促进有益菌增殖;另一方面通过降低肠道 pH 值抑制有害菌的生长、也可以抑制蛋白质和脂类代谢产生有害物质,进而改善肠道生态环境,保护小肠屏障功能,增强机体防御能力[22-23]。膳食纤维组分除了能够改善肠道菌群结构之外,与小肠内物质代谢密切相关的微生物酶类的合成与释放也是决定膳食纤维生理功能的重要因素。例如,肠道内的微生物酯酶可降解与膳食纤维携带的酚类化合物以及产生交联的双阿魏酸,化合物从多糖分子上游离,再经肠黏膜吸收进入血液,最终通过肠道缓慢持续的释放发挥其抗氧化功能[24]。
Wang等[20]的研究发现,通过抑制肠道中微生物三甲胺裂解酶的释放减少受试动物体内胆碱向三甲胺的转化率,从而显著降低血浆中三甲胺及其氧化物的含量;Williams等[14]的研究结果表明,红肉膳食补充麦麸水溶性膳食纤维可促进肠道有益菌群的增殖,抑制有害菌群,降低肠道菌群的复杂性。因此,利用膳食纤维的肠道菌群调节效应干预红肉膳食,靶向减少具有三甲胺裂解酶活性的微生物,或许可为减少膳食诱导的三甲胺产生对人体健康造成的风险研究开辟新途径,为膳食纤维与红肉合理搭配的膳食结构提供新思路。肠道菌群的调节效应与胆碱代谢的相关性也得到了确认[25-26]。综合目前的研究,尚未明确三甲胺代谢与特定的肠型之间一一对应的关系,这可能与宿主复杂的肠道环境有关,因此,“宿主效应”的共同作用研究也是膳食纤维干预胆碱代谢作用机理研究的重要方向之一,比如与宿主能量代谢相关、已成为多种代谢疾病研究整合关键点的AMPK(AMP活化蛋白激酶)途径[27]。
2 膳食纤维干预肠道菌群和宿主效应
目前关于膳食纤维与肠道菌群调节效应的研究主要集中在寻找具体的膳食饮食和对应的肠道菌群群落结构的相关性。但是,由于肠道微生物及环境因子的多样性和复杂性的增加,尚未得到具体的膳食纤维类型补充与准确的肠道菌群的物种组成与群落结构的对应关系[28]。肠道微生物群是与宿主协同进化形成的最终结果,并且通过各种方式导致微生物的构成及两者互作关系及基因发生改变[29],而膳食纤维发酵对肠道的益生功效是通过微生物本身及宿主效应(如能量代谢途径)共同来调节的[30]。
国内外学者对膳食纤维与肠道菌群的相互作用作了大量研究,但有关膳食纤维在肠道复杂环境体系中与机体相互作用的研究还缺乏直接有效的手段,作用机理研究尚未充分。单纯的探究两者间的相互作用,会主观忽略了肠道环境中其他因素的配伍作用;在体外条件下的模拟研究,可能会因为分子的密度环境不同,造成研究作用差异性放大的结论偏差[31]。因此,非侵入型的直接定性定量方法的建立对麦麸膳食纤维与肠道菌群间相互作用模型的构建具有极其重要的意义。随着高通量测序技术[28, 32]、荧光探针技术[33]的发展,以其高灵敏度和高选择性等特点,越来越广泛地应用于实时检测检测肠道微生物和生物大分子之间的结合情况,可由样品中基因差异、荧光强弱、形状分布等的差异得到微生物操作单元、分子大小、形状及旋转自由度等信息。但当前基因多样性、分子荧光探针标记效率和特异性,与其分子量、糖苷键类型、取代度等微观结构的匹配问题,分析指标的选择问题,还制约着这些技术广泛应用及发展。
不能被人体消化酶利用的膳食成分,在肠道内降解和利用都是微生物依赖过程,而不同膳食纤维组分结构及理化差异都会引起肠道微生物及其代谢的差异,因此当用不同的膳食纤维组分替代营养过剩型膳食结构中能量较高的组分(如脂肪、淀粉等)时引起的肠道菌群群落结构变化表征如何,膳食纤维代谢差异是否会干预其他膳食成分代谢以及与宿主代谢通路的相互作用[34],目前尚未得到充分的研究。周边组织细胞(如小肠上皮组织细胞)[35]对于特定膳食纤维组分补充引起的肠道环境的感应信号差异,是否会存在其他的宿主效应,是否会引起机体对于能量、脂肪等利用基因的变化[36-37],进而对代谢相关的疾病产生影响,还缺少系统有效的研究证明。结合膳食纤维自身及宿主来评价膳食结构对肠道微生物及健康的研究,综合运用化学分析、色谱分析、酶技术、免疫标记技术、生物探针技术等,建立生物反应过程中的代谢酶系及代谢产物动态追踪体系,并分析反应过程中膳食纤维的组分结构等的变化;借鉴现代生物学、医学等研究技术与方法,研究确定膳食纤维在调节肠道菌群中所影响的细胞因子和信号通路,可能为膳食结构的调整及肠道相关代谢疾病的预防提供新思路。
3 膳食纤维构效关系解析
麦麸皮膳食纤维的营养及应用价值已被认可,但有关其结构和介观特性的研究还缺乏理想的参考模型,构效关系解析尚缺乏系统性研究。目前研究表明,构成麦麸可利用膳食纤维主要是一类是由主链为β-(1-4)-D-木聚吡喃糖构成的杂多糖,其侧链大多为α-L-呋喃阿拉伯,阿魏酸、半乳糖、β-D-葡萄糖醛酸在C-2或C-3或C-2,C-3同时取代;另一类是由β-(1-3,1-4)-葡聚糖作为主要构成成分的杂多糖[38]。麦麸膳食纤维具有结构和组分相对含量的差异,这些差异主要由植物的来源(基因型和生长环境)决定,并且影响到膳食纤维的发酵特性,进而影响膳食纤维在食品中的在机体肠道内的生理活性。一般情况下,线性、非分支、聚合度较低的水溶性膳食纤维更容易被肠道微生物快速发酵,而分子结构较复杂、取代度较高的膳食纤维属于慢发酵型。Amrei等[39]的研究结果表明取代度相对较低戊聚糖,发酵时间短,生物利用率高。Gomez等[40]发现水溶性果聚糖比不溶性的纤维素,在人体肠道微生物模拟环境中促乳酸菌和双歧杆菌生长效果更显著。
麦麸膳食纤维主要包括阿拉伯糖-(4-O-甲基葡萄糖醛酸)-木聚糖、木聚糖、β-(1-3,1-4)-葡聚糖、葡甘露聚糖、半乳葡甘露聚糖等多种组分[41]。目前研究表明,构成小麦麸SDF的主要是主链为β-(1-4)-D-木聚吡喃糖构成的杂多糖,其侧链大多为α-L-呋喃阿拉伯,在木糖主链的C-2或C-3单取代或C-2,C-3位双取代,同时伴有少量的阿魏酸、半乳糖、β-D-葡萄糖醛酸等侧链成分[42]。与其他的细胞壁成分纤维素、木质素、β-葡聚糖、蛋白等的交联,增加了空间结构的复杂性,取代度、分枝结构、空间构型等也会随来源及制备方式的不同而各不相同,其基本的结构如图1所示,但并没有一种统一的结构模型供其参考。分析手段的匹配性,相对单一组分的分离,进一步增加了结构分析的困难[19]。
麦麸膳食纤维的组成和结构特性,决定了它的一些独特的理化性质[43-44]。因此不同结构特征的小麦麸膳食纤维组分对胆碱代谢产物三甲胺积累的影响效果可能也是不同的。分子链的分子结构和物理状态是其理化特性和微生物发酵的重要决定因素[45-47],分子链的聚合度和相对分子质量、分子结构、分子空间紧密程度均影响其发酵特性[48-49]。但由于麦麸膳食纤维结构和理化性质复杂性、多样性以及对环境因素的敏感性,目前关于麦麸膳食纤维理化特性和肠道微生物发酵作用及其在强化改性过程中变化规律的构效关系还没有系统性和确切性的定论[50],尤其是麦麸膳食纤维空间构象对其营养学特性影响机制的研究还鲜有报道。因此,膳食纤维理化和营养特性构-效关系的建立,以及受强化方式的影响仍是亟待解决的问题,这一关键问题的解决对于膳食纤维及相关产品品质的定向控制具有重要意义。
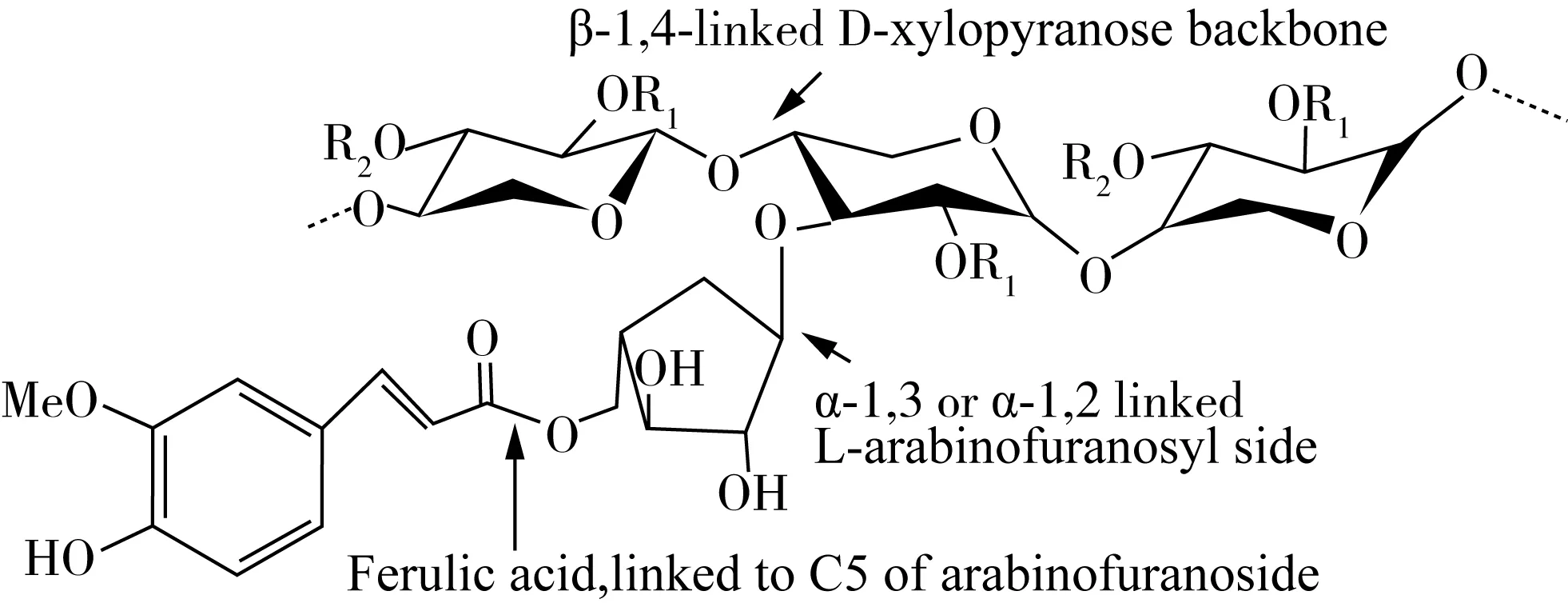
图1 小麦麸膳食纤维基本结构示意图。R1、R2有可能是氢、 乙酰基、阿拉伯呋喃糖或者4-O-甲基-D-葡萄糖醛酸
4 膳食纤维制备技术及理论基础
以大宗粮食加工副产物为原料制备膳食纤维的基础理论研究仍相对薄弱。在我国,小麦麸皮作为小麦加工的主要副产品,膳食纤维含量丰富(质量分数35%~50%),是理想的膳食纤维资源[51]。
麦麸膳食纤维中水溶性膳食纤维与不溶性膳食纤维比例分布不均匀,同时由于原料组分的复杂性、影响因素的多样性,导致产品质量参差不齐。为此,利用物理场、化学修饰、生物发酵等方式处理麦麸,可以提高水溶性膳食纤维的比例,改善其理化性质,从而提高麦麸皮膳食纤维加工适应性和营养可利用性等[52-53]。寻求高品质的膳食纤维高效制备技术,是目前研究的热点也是难点。通过多元强化使膳食纤维中不溶性大分子物质分子键断裂,提高可溶性成分的比例,理化性质、生物活性得到相应的改善,是目前膳食纤维改性手段的基本原理。主要方法有:物理方法(固态汽爆、超微粉碎、挤压蒸煮、瞬时高压处理、冷冻粉碎、纳米技术、膜浓缩法等)、化学方法(酸碱处理)和生物技术方法(酶法、发酵法等)[54-56]。技术上加快创新,以多种加工方式相结合,综合利用物理、化学、生物等多种作用方式为手段的多元强化方式,可以有效地提高膳食纤维的提取效率和产品品质,但目前强有力的理论依据和支撑的缺乏是制约技术广泛应用的主要原因。
植物膳食纤维多糖的改性及其低聚糖的制备,结果发现挤压膨化、超微粉碎、生物发酵、固态汽爆等改性手段能够显著改变膳食纤维的含量、组成及分子结构、聚集状态等,完善分子理化特性。例如,研究结果表明超微粉碎能够显著降低枸杞多糖的分子量及聚集趋势,提高其抗氧化活性[57]。在复杂性、多样性的加工过程中,膳食纤维可能会发生分子链的解聚、转苷、侧链异构化、空间结构等微观结构的变化及理化性质的变化,这些变化势必会影响膳食纤维与肠道菌群的相互作用,从而影响其营养学特性等。由于原料组分和加工过程的复杂性,组分与组分之间、组分与加工条件之间、组分与功能之间的关系,又因过程中存在着动态的化学和生物学变化,很难建立统一的模型,也缺少直接的验证手段,导致发酵膳食纤维组分结构与肠道菌群调节功能调控机制难以阐明,在分子、基因水平上考察强化过程中膳食纤维组分的定向控制,对于改善膳食纤维的营养学品质具有重要影响。
因此, 结合多元强化方式研究膳食纤维对三甲胺抑制作用的结构效应关系是阐明其作用机制的必由之路。在明确膳食纤维对肠道菌群和宿主效应的分子调节机制基础上,深入研究麦麸膳食纤维强化手段与其构效关系,同时引入以膳食纤维为纽带的多元强化理论,建立兼顾加工品质与营养的膳食纤维定向加工控制方法,突破传统膳食纤维产品的藩篱,对于建立优质膳食纤维的新型技术体系具有重要的理论指导意义。利用高通量筛选技术,定向筛选目标产物高产有益酶系,结合反应体系中反应条件与参数的调节,分析发酵过程中的生物酶系与目标产物组分结构、组分结构与调节肠道菌群功效模型;阐述肠道益生作用的生物发酵过程反应途径网络模型,并结合反应动力学原理,解析反应途径网络中关键技术的速率常数、平衡常数、反应自由能和活化能等,建立反应动力学模型,从而预测解除反应抑制物、产物耦合分离对反应过程的影响。同时从动力学角度评价物质转化反应、结构异化反应过程调控的效率水平。
5 结语
近年来,长期摄入红肉膳食诱导的心血管疾病风险增加的问题已经引起了广泛的重视和研究,以膳食纤维干预受试动物三甲胺及氧化物的代谢为研究体系,开展麦麸水溶性膳食纤维在干预红肉膳食机体内胆碱代谢与构效关系和加工适应性的同步研究,系统阐释膳食纤维组分在加工过程中微观结构和介观性质的变化规律,建立膳食纤维干预机体红肉膳食胆碱代谢的结构效应关系,寻求更有效的分析手段进一步研究膳食纤维补充对于肠道菌群的调节效应和相关的宿主效应(以膳食纤维为纽带与机体其他组织或器官间相互作用及神经中枢相关信号变化),构建膳食纤维抑制红肉膳食胆碱代谢的的作用机制,将为靶向膳食纤维产品品质定向调控和红肉膳食结构调整提供重要的理论和技术指导。
[1] BETORET E, BETORET N, VIDAL D, et al. Functional foods development: Trends and technologies[J]. Trends in Food Science & Technology, 2011, 22(9): 498-508
[2] ANDERSON J W, BAIRD P, DAVIS R H, et al. Health benefits of dietary fiber[J]. Nutrition Reviews, 2009, 67(4): 188-205
[3] HOSSEINIAN F, OOMAH B D, CAMPOS-VEGA R. Dietary fiber as food additive: Present and future [M]. John Wiley & Sons, Ltd, 2016
[4]BASSON M. Metabolic diseases: Dietary fiber takes a circuitous route[J]. Nature Medicine, 2014, 20(2): 128
[5] WU D T, MENG L Z, WANG L Y, et al. Chain conformation and immunomodulatory activity of a hyperbranched polysaccharide from cordyceps sinensis[J]. Carbohydrate Polymers, 2014, 110(38): 405-414
[6] HAN S, JIAO J, ZHANG W, et al. Dietary fiber prevents obesity-related liver lipotoxicity by modulating sterol-regulatory element binding protein pathway in c57bl/6j mice fed a high-fat/cholesterol diet[J]. Scientific Reports, 2015, 5(1): 152-156
[7] FROST G, SLEETH M L, SAHURIARISOYLU M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J]. Nature Communications, 2014, 5(5): 3611-3611
[8] HEINRITZ S N, WEISS E, EKLUND M, et al. Intestinal microbiota and microbial metabolites are changed in a pig model fed a high-fat/low-fiber or a low-fat/high-fiber diet[J]. PloS One, 2016, 11(4): e0154329
[9] KEHLET U, PAGTER M, AASLYNG M D, et al. Meatballs with 3% and 6% dietary fibre from rye bran or pea fibre - effects on sensory quality and subjective appetite sensations[J]. Meat Science, 2017, 125(1): 66-75
[10] CHIAVAROLI L, MIRRAHIMI A, SIEVENPIPER J L, et al. Dietary fiber effects in chronic kidney disease: A systematic review and meta-analysis of controlled feeding trials[J]. European Journal Of Clinical Nutrition, 2015, 69(7): 761-768
[11] KOETH R A, WANG Z, LEVISON B S, et al. Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis[J]. Nature Medicine, 2013, 19(5): 576-585
[12] WANG Z, KLIPFELL E, BENNETT B J, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature, 2011, 472(7341): 57-63
[13] ZHANG D, WILLIAMS B A, MIKKELSEN D, et al. Soluble arabinoxylan alters digesta flow and protein digestion of red meat-containing diets in pigs[J]. Nutrition, 2015, 31(9): 1141-1147
[14] WILLIAMS B A, ZHANG D, LISLE A T, et al. Soluble arabinoxylan enhances large intestinal microbial health biomarkers in pigs fed a red meat-containing diet[J]. Nutrition, 2015, 32(4): 491-497
[15] STEHFEST E. Diet: Food choices for health and planet[J]. Nature, 2014, 515(7528): 501-502
[16] AHMED F. Health: Edible advice[J]. Nature, 2010, 468(7327): S10-S12
[17] BERNSTEIN A M, WILLETT W C. Red meat intake and the risk of cardiovascular disease[J]. Current Cardiovascular Risk Reports, 2011, 5(2): 145-148
[18] SATIJA A, HU F B. Cardiovascular benefits of dietary fiber[J]. Current Atherosclerosis Reports, 2012, 14(6):505-514
[19] MERRIGAN K, GRIFFIN T, WILDE P, et al. Food science. Designing a sustainable diet[J]. Science, 2015, 350(6257): 165-166
[20] WANG Z, ROBERTS A B, BUFFA J A, et al. Non-lethal inhibition of gut microbial trimethylamine production for the treatment of atherosclerosis[J]. Cell, 2015, 163(7):1585-1595
[21] BROWN J M, HAZEN S L. The gut microbial endocrine organ: Bacterially derived signals driving cardiometabolic diseases[J]. Annual Review of Medicine, 2015, 66(1): 343-359
[22] REMELY M, AUMUELLER E, MEROLD C, et al. Effects of short chain fatty acid producing bacteria on epigenetic regulation of ffar3 in type 2 diabetes and obesity[J]. Gene, 2014, 537(1): 85-92
[23] COTILLARD A, KENNEDY S P, KONG L C,et al. Dietary intervention impact on gut microbial gene richness[J]. Nature, 2013, 500(7464): 585-588
[24] PAOLA V, AURORA N, VINCENZO F. Cereal dietary fibre: A natural functional ingredient to deliver phenolic compounds into the gut[J]. Trends in Food Science & Technology, 2008, 19(9): 451-463
[25] ZHU W, GREGORY J, ORG E, et al. Gut microbial metabolite tmao enhances platelet hyperreactivity and thrombosis risk[J]. Cell, 2016, 165(1): 111-124
[26] KOETH R A, LEVISON B S, CULLEY M K, et al. Γ-butyrobetaine is a proatherogenic intermediate in gut microbial metabolism of l-carnitine to tmao[J]. Cell Metabolism, 2014, 20(5): 799-812
[27] DAGON Y, HUR E, ZHENG B, et al. P70s6 kinase phosphorylates ampk on serine 491 to mediate leptin′s effect on food intake[J]. Cell Metabolism, 2012, 16(1): 104-112
[28] KOETH R A, WANG Z, LEVISON B S, et al. Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis[J]. Nature Medicine, 2013, 19(5): 576-585
[30] KASUBUCHI M, HASEGAWA S, HIRAMATSU T, et al. Dietary gut microbial metabolites, short-chain fatty acids, andhost metabolic regulation[J]. Nutrients, 2015, 7(4): 2839-2849
[31] BROEKAERT W F, COURTIN C M, VERBEKE K, et al. Prebiotic and other health-related effects of cereal-derived arabinoxylans, arabinoxylan-oligosaccharides, and xylooligosaccharides[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(2): 178-194
[32] BUFFIE C G, BUCCI V, STEIN R R, et al. Precision microbiome reconstitution restores bile acid mediated resistance to clostridium difficile[J]. Nature, 2015, 517(7533): 205-208
[33] JEKLE M, BECKER T. Dough microstructure: Novel analysis by quantification using confocal laser scanning microscopy[J]. Food Research International, 2011, 44(4): 984-991
[34] WONG B W, WANG X, ZECCHIN A, et al. The role of fatty acid β-oxidation in lymphangiogenesis[J]. Nature, 2017, 542(7639): 49-54
[35] BRANISTE V, ALASMAKH M, KOWAL C, et al. The gut microbiota influences blood-brain barrier permeability in mice[J]. Science Translational Medicine, 2014, 6(263): 263ra158
[36] DAVENPORT E R, CUSANOVICH D A, MICHELINI K, et al. Genome-wide association studies of the human gut microbiota[J]. PloS One, 2015, 10(11): e0140301
[37] MCKNITE A M, PEREZMUNOZ M E, LU L, et al. Murine gut microbiota is defined by host genetics and modulates variation of metabolic traits[J]. PloS One, 2012, 7(6): e39191
[38] SHELAT K J, VILAPLANA F, NICHOLSON T M, et al. Diffusion and viscosity in arabinoxylan solutions: Implications for nutrition[J]. Carbohydrate Polymers, 2010, 82(1): 46-53
[39] AMREIN T M, GRNICHER P, ARRIGONI E, et al. In vitro digestibility and colonic fermentability of aleurone isolated from wheat bran[J]. LWT - Food Science and Technology, 2003, 36(4): 451-460
[40] GOMEZ E, TUOHY K M, GIBSON G R, et al. In vitro evaluation of the fermentation properties and potential prebiotic activity of agave fructans[J]. Journal of Applied Microbiology, 2010, 108(6): 2114-2121
[41] ZHANG S, SONG X, YU B, et al. Identification of quantitative trait loci affecting hemicellulose characteristics based on cell wall composition in a wild andcultivated rice species[J]. Molecular Plant, 2012, 5(1): 162-175
[42] DORING C, JEKLE M, BECKER T. Technological and analytical methods for arabinoxylan quantification from cereals[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(6): 999-1011
[43] SAEED F, PASHA I, ANJUM F M, et al. Arabinoxylans and arabinogalactans: A comprehensive treatise[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(5): 467-476
[44] MA M M, MU T H. Effects of extraction methods and particle size distributionon the structural, physicochemical, and functional properties of dietary fiber from deoiled cumin[J]. Food Chemistry, 2016, 194(1): 237-246
[45] ZHANG M, WANG F, LIU R, et al. Effects of superfine grinding on physicochemical and antioxidant properties of lycium barbarum polysaccharides[J]. LWT - Food Science and Technology, 2014, 58(2): 594-601
[46] ZHANG M, BAI X, ZHANG Z. Extrusion process improves the functionality of soluble dietary fiber in oat bran[J]. Journal Of Cereal Science, 2011, 54(1): 98-103
[47] LI Q, LIU R, WU T, et al. Soluble dietary fiber fractions in wheat bran and their interactions with wheat gluten have impacts on dough properties[J]. Journal of Agricultural and Food Chemistry, 2016, 64(46): 8735-8744
[48] COMINO P, COLLINS H, LAHNSTEIN J, et al. Characterisation of soluble and insoluble cell wall fractions from rye, wheat and hull-less barley endosperm flours[J]. Food Hydrocolloids, 2014, 41(1): 219-226
[49] VAN L H, TAMMINGA S, WILLIAMS B A, et al. Fermentation characteristics of polysaccharide fractions extracted from the cell walls of maize endosperm[J]. Journal of the Science of Food and Agriculture, 2002, 82(12):1369-1375
[50] COMINO P, COLLINS H, LAHNSTEIN J, et al. Effects of diverse food processing conditions on the structure and solubility of wheat, barley and rye endosperm dietary fibre[J]. Journal of Food Engineering, 2016, 169(1): 228-237
[51] TUCK C O, PÉREZ E, HORVTH I T, et al. Valorization of biomass: Deriving more value from waste[J]. Science, 2012, 337(6095): 695-699
[52] CHEN Y, YE R, YIN L, et al. Novel blasting extrusion processing improved the physicochemical properties of soluble dietary fiber from soybean residue and in vivo evaluation[J]. Journal of Food Engineering, 2014, 120(1): 1-8
[53] DE VRIES R P, BENEN J A E, DE GRAAFF L H, et al. Plant cell wall degrading enzymes produced by aspergillus [M]//OSIEWACZ H D. Industrial applications. Berlin, Heidelberg; Springer Berlin Heidelberg,2002: 263-279.
[54] MOORE J, CHENG Z, HAO J, et al. Effects of solid-state yeast treatment on the antioxidant properties and protein and fiber compositions of common hard wheat bran[J]. Journal of Agricultural and Food Chemistry, 2007, 55(25):10173-10182
[55] LIU Z, CHEN H. Simultaneous saccharification and co-fermentation for improving the xylose utilization of steam exploded corn stover at high solid loading[J]. Bioresource Technology, 2016, 201(1): 15-26
[56] HELL J, DONALDSON L, MICHLMAYR H, et al. Effect of pretreatment on arabinoxylan distribution in wheat bran[J]. CarbohydratePolymers, 2015, 121(121): 18-26
[57] ZHANG M, WANG F, LIU R,et al. Effects of superfine grinding on physicochemical and antioxidant properties of lycium barbarum polysaccharides[J]. Lebensmittel-Wissenschaft und-Technologie, 2014, 58(2): 594-601.

