微乳体系中脂肪酶催化棕榈酸制备 生物柴油及其工艺优化
朱广琪 李芳浩 刘 妍 王彩娜 谈忠琴 韩晓祥
(浙江工商大学应用化学系,杭州 310018)
生物柴油是一种新型的可再生绿色能源,它具有闪点高、抗爆性好、燃烧性能优良、能有效降低SOx,NOx等有害温室气体排放量等优点。生物柴油是一种高级脂肪酸酯类化合物,可以通过动植物油脂、餐饮废油等为原料与低级醇经过酯交换或酯化反应制备得到。在传统制备工艺中,常采用浓硫酸作为催化剂。浓硫酸催化时虽有较高催化活性,但存在易发生副反应,产品不易提纯,设备腐蚀严重,环境污染严重等缺点,工艺路线不符合当今社会可持续发展的要求。采用固体酸、金属盐类、离子液体等催化剂[1-5],虽然在一定程度上解决了传统催化剂存在的一些缺点,但它们仍存在相对活性低、表面易积碳、酸中心分布不均、再生困难等缺陷,从而限制了它们的应用。
微乳体系是指由油、水、表面活性剂和助剂按照一定比例自发形成的热力学稳定的、外观透明或半透明的高度分散体系,具有超低的界面张力,稳定的热力学特性且价格低廉,广泛用于聚合反应、酶催化反应、分离及纳米材料制备等领域[6-13]。脂肪酶作为一种生物催化剂,在催化反应中常具有很高的立体选择性和区域选择性,微乳体系中进行脂肪酶催化反应已有文献报道,微乳体系为脂肪酶提供了适宜的作用环境,从而使脂肪酶显现出较好的催化性能[14-19]。离子液体,主要由含氮元素的有机阳离子与无机阴离子形成的,在室温下呈液态的离子化合物。离子液体不仅可以作为催化剂,还能作为绿色溶剂广泛的应用于多个领域[20]。近年来,通过离子液体构建离子液体微乳液备受关注,离子液体微乳液作为一种新型体系,同时具备了离子液体和微乳液二者的优点,在纳米材料的制备,蛋白质萃取分离,医药及化工领域已经得到了应用[21-23]。
本试验以棕榈酸为模型反应原料,DBSA+TX-100/环己烷/BmimBF4离子液体微乳体系为反应介质,考察了醇酸摩尔比、脂肪酶用量、反应温度、反应时间等因素对Candidarugosa脂肪酶催化合成棕榈酸乙酯产率的影响,并采用响应面分析法对该合成反应条件进行优化,以期为生物柴油的绿色制备和高酸值餐饮废油脂的清洁利用提供参考。
1 材料与方法
1.1 材料与仪器
十二烷基苯磺酸(DBSA):日本Tokyo Kasei Kogyo有限公司;Candidarugosa脂肪酶:Sigma-Aldrich公司;曲拉通(TX-100):上海如吉生物科技发展有限公司;1-丁基-3-甲基咪唑四氟硼酸盐(BmimBF4):阿拉丁试剂公司;环己烷、棕榈酸、乙醇、氢氧化钠、酚酞及其他试剂:迈瑞化学试剂公司,皆为分析纯。
GC7890B气相色谱仪,安捷伦公司;GL-3250A磁力搅拌器:海门市其林贝尔仪器制造有限公司;DZF-6050真空干燥箱:上海博迅实业有限公司。
1.2 方法
1.2.1 微乳体系的制备
称取一定质量的DBSA+TX-100与环己烷混合于小烧杯中,在磁力搅拌的作用下,搅拌均匀后向体系中滴加BmimBF4,直至溶液由澄清变浑浊或者由浑浊变澄清,变化临界点即为相变点。根据三组分中各质量得到溶液的组成分数,整理数据,采用 Origin 8.5 绘制三元相图。整个实验过程在30 ℃环境下进行。
根据所绘制的三相图,在微乳区中任取几个特殊点,根据各组分的质量分数算出每个组分的质量,配成微乳体系。在相同的反应条件下进行棕榈酸乙酯的合成。酯化反应结束后,用气相色谱法检测棕榈酸的转化率,进而确定微乳区的最大反应点,并将此最大反应点作为研究棕榈酸酯化反应单因素影响的反应点。
1.2.2 微乳体系中棕榈酸乙酯的合成
在圆底烧瓶中分别加入形成微乳体系的3种组分,磁力搅拌30 min,形成均匀澄清透明的微乳体系。向微乳体系中加入棕榈酸、乙醇及脂肪酶,在水浴条件下进行酯化反应。酯化产物在Agilent 7890B气相色谱仪上进行定量分析,FID检测器,HP-5毛细管柱,月桂酸甲酯为内标物。
2 结果与分析
2.1 离子液体微乳中脂肪酶催化酯化反应
离子液体微乳体系的形成对酯化反应有着重要的影响,实验研究了DBSA,TX-100等表面活性剂对BmimBF4/环己烷形成微乳液的影响。研究发现单独DBSA与离子液体不能形成微乳体系,而单独的TX-100可以与离子液体形成微乳体系,当DBSA与TX-100形成复配表面活性剂同样可以与BmimBF4及环己烷形成微乳体系。微乳体系三相图如图1所示,由图1可见,表面活性剂对该离子液体微乳液的形成有重要作用,当表面活性剂的比例较小时,通常不能形成微乳液,随着表面活性剂所用比例的增加,微乳区逐渐扩大,并且也越稳定。
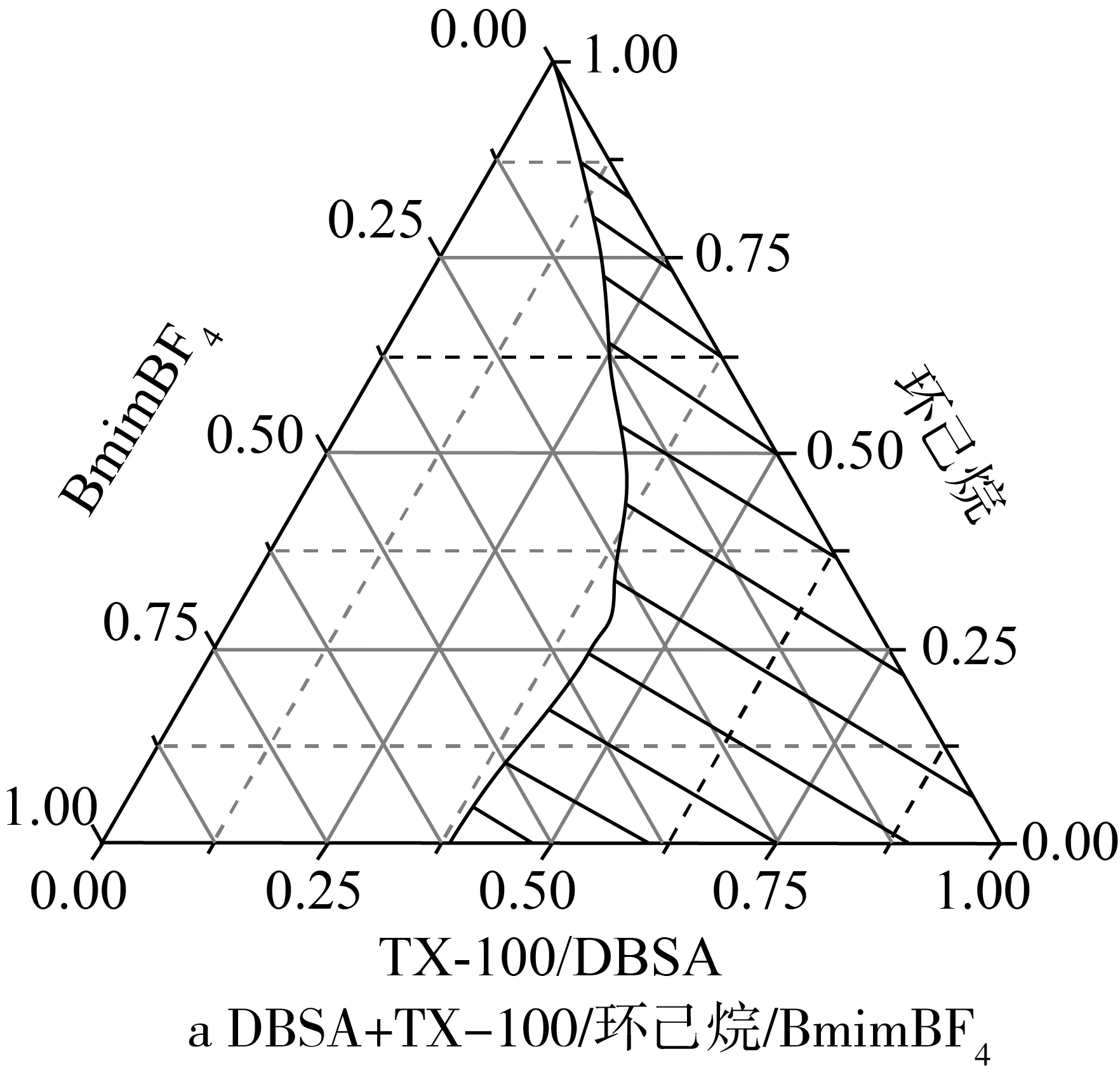
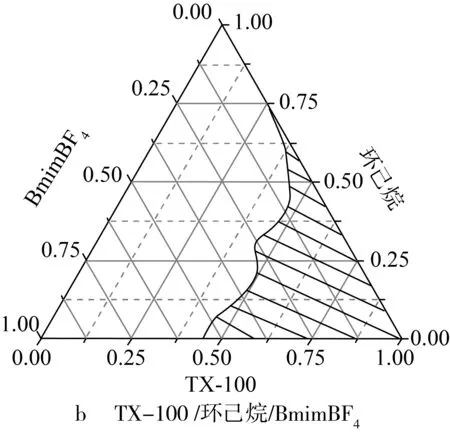
图1 微乳体系三相图
在三相图的微乳区中寻找不同离子液体含量的点,根据不同点三组分的比率,配制离子液体微乳体系,考察离子液体含量对脂肪酶催化合成棕榈酸乙酯的影响。离子液体含量是影响微乳体系中脂肪酶活性的一个重要因素,离子液体用量对微乳体系中脂肪酶催化酯化反应的影响如图2所示。由图2可知,随着微乳体系中离子液体含量的增加,棕榈酸乙酯的产率逐渐增长,当体系中离子液体含量达到30%时,棕榈酸乙酯产率出现了一个峰值。随后,继续增加离子液体用量,棕榈酸乙酯的产率呈现下降的趋势。一般来说,微乳体系中,酯化反应发生在相界面处,相界面处的面积越大,底物分子间的接触越充分,从而反应速度加快,提高反应产率。随着离子液体用量的增加,界面增加,反应过程中生成的水不仅提高酶的活力,也可参与微乳体系的形成,从而进一步促进反应平衡向右移动,棕榈酸乙酯产率增加。离子液体的过多存在可能会影响脂肪酶的活性,从而导致酯化反应活性降低,棕榈酸乙酯产率降低,因此,试验中选择离子液体用量为30%。
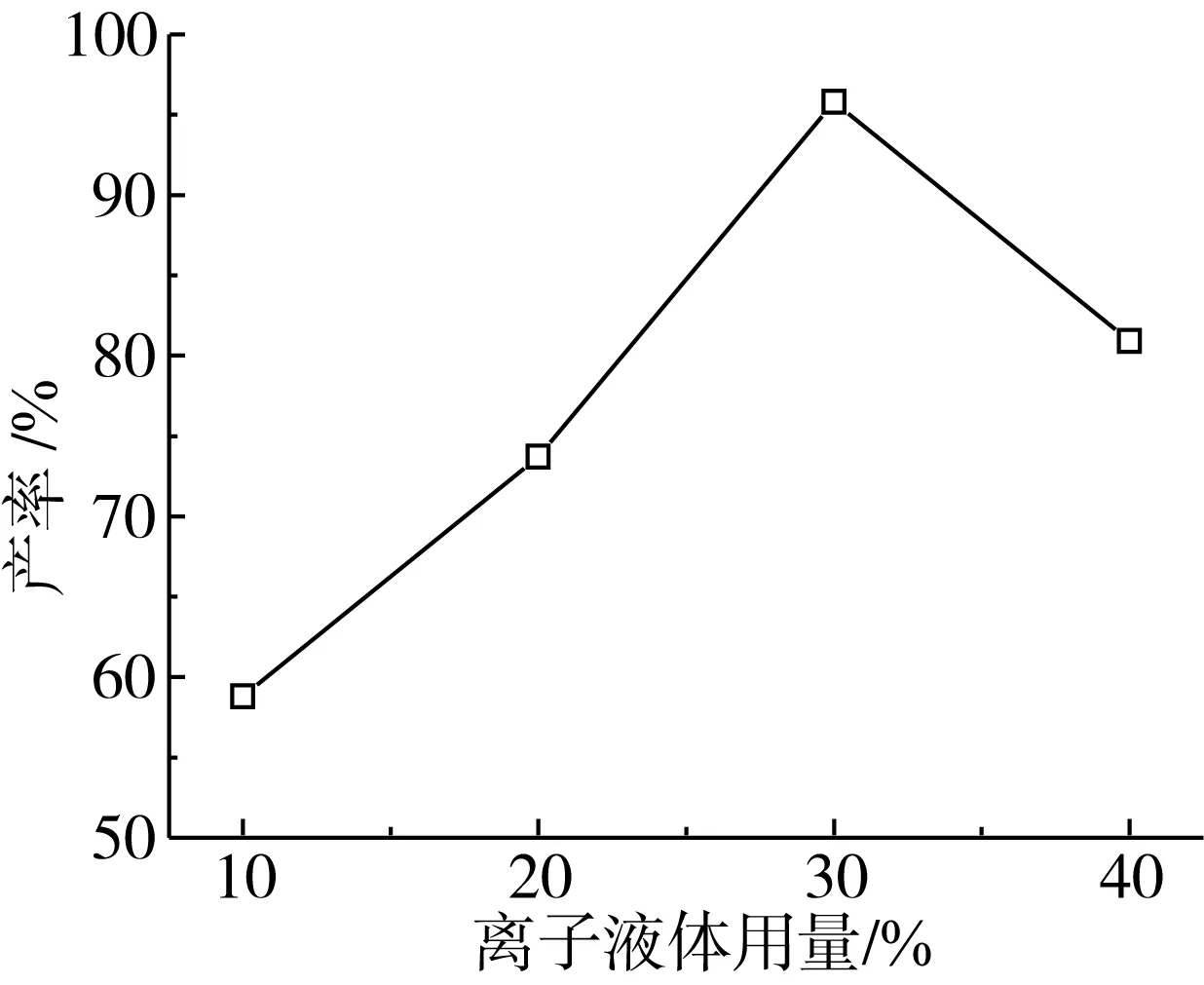
图2 离子液体用量对微乳体系中脂肪酶催化酯化反应的影响
2.2 反应条件对脂肪酶催化合成棕榈酸乙酯的影响
酯化反应是一个可逆反应,常通过增加反应物的量来提高反应转化率,不同反应条件对离子液体微乳体系中脂肪酶催化酯化反应的影响如图3所示。由图3可见,当离子液体用量为30%,脂肪酶浓度为12%,反应时间为3.0 h时,不同醇酸摩尔比对棕榈酸酯化反应的影响较大。在所考察的范围内,随着乙醇用量的增加,棕榈酸乙酯产率逐渐上升,当醇酸摩尔比为6∶1时,棕榈酸乙酯产率最高为95.8%,进一步增加乙醇用量,棕榈酸乙酯产率下降。这是因为增加乙醇的浓度,即增加了反应物的浓度,有利于反应向酯化反应方向进行。但是随着醇酸摩尔比进一步增加,反应体系中过高的乙醇浓度对脂肪酶活性有抑制作用,同时反应体系体积增大,催化剂浓度变稀,反应速度变慢,棕榈酸转化率下降。因此,醇酸摩尔比选为6∶1。
酶浓度的增加有利于反应速率增加,但是过量的酶也会对反应产生不利影响,本试验在研究脂肪酶用量对棕榈酸酯化反应的影响时,获得了脂肪酶用量适宜值,具体结果见图3,由图可见,无脂肪酶存在时,该微乳体系中进行酯化反应具有一定的催化活性,而在TX-100/环己烷/BmimBF4微乳体系中进行催化酯化制备棕榈酸乙酯时,棕榈酸乙酯产率小于5%,由此说明微乳体系中DBSA不仅与TX-100结合作为表面活性剂与环己烷、离子液体形成微乳体系,还可作为Brønsted酸催化酯化反应。有脂肪酶存在时,催化酯化反应活性进一步增加,且棕榈酸转化率随着脂肪酶用量的增加而增加,当脂肪酶用量为12%时,棕榈酸乙酯产率达到最大为95.8%,进一步增加脂肪酶用量,棕榈酸乙酯产率增幅不明显。这可能是因为酶浓度在一定范围内增加时,随着酶用量的增加,使得酶分子中越来越多的活性部位与底物分子接触[24],从而加快反应速度,使棕榈酸转化率快速增加;但当酶的活性部位增加到一定程度时,由于蛋白质的聚集作用而不再与底物接触,反应速率即几乎不再增加,棕榈酸乙酯产率基本保持不变。因此选择加酶量为12%。
温度对酶催化反应的影响主要有两个方面,提高反应温度,一方面可以提高反应速率,另一方面过高的反应温度会使酶失活,不利于酯化反应的进行。由图3可见,随着反应温度的升高,反应速率加快,棕榈酸转化率增加,在35 ℃时棕榈酸乙酯的产率达到最大值,脂肪酶此时表现出最大的催化活力。进一步升高反应温度,虽然有利于DBSA的酸催化作用,但酶的催化活性受到抑制,两者相互作用的结果,使得棕榈酸乙酯的产率呈下降趋势。
通常条件下,延长反应时间有助于反应进行。由图3可见,脂肪酶存在时,随着反应时间的延长,棕榈酸乙酯产率增加,当反应时间为3.0 h时,棕榈酸乙酯产率为95.8%,进一步延长反应时间,棕榈酸乙酯产率基本保持不变。因此反应时间以3.0 h为宜。
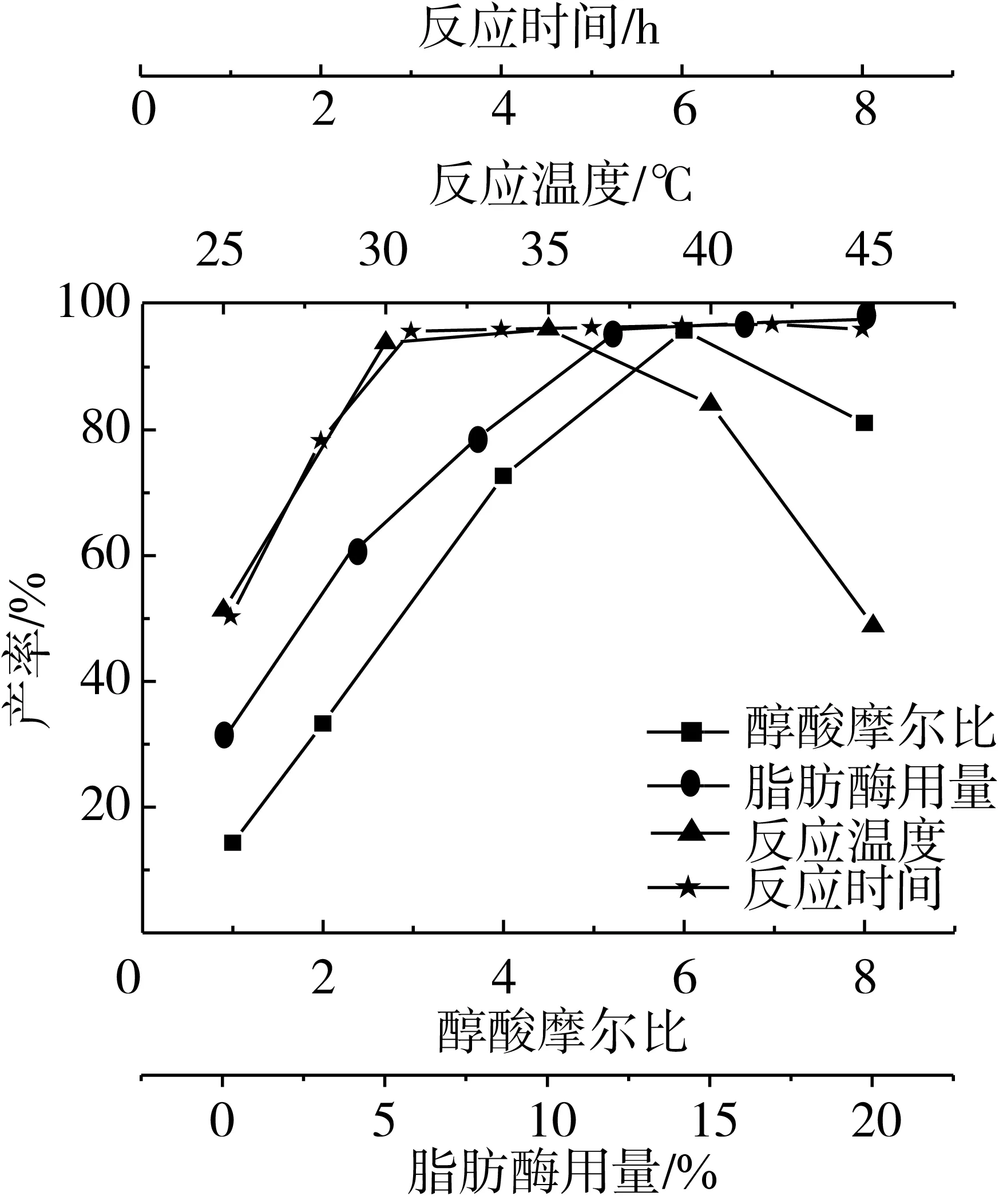
图3 不同反应条件对离子液体微乳体系中脂肪酶催化酯化反应的影响
2.3 响应面法优化生物柴油制备工艺
2.3.1 分析因素的选取及分析方案
根据 Box-Benhnken 的中心组合试验设计原理,综合单因素试验结果,选取醇酸摩尔比、脂肪酶用量、反应温度这三个因素,采用三因素三水平响应面分析方法确定棕榈酸乙酯制备的最佳工艺条件,试验因素水平及编码表见表1,响应面实验设计方案和实验结果见表2。试验1~12是析因试验,13~17是中心试验,中心试验重复5次,用于估计试验误差。
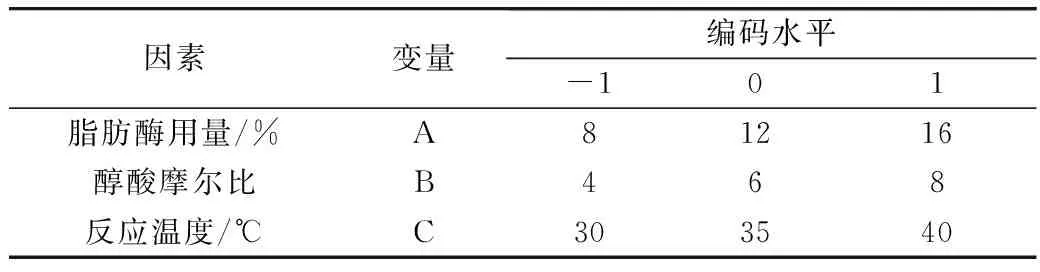
表1 试验因素水平及编码表
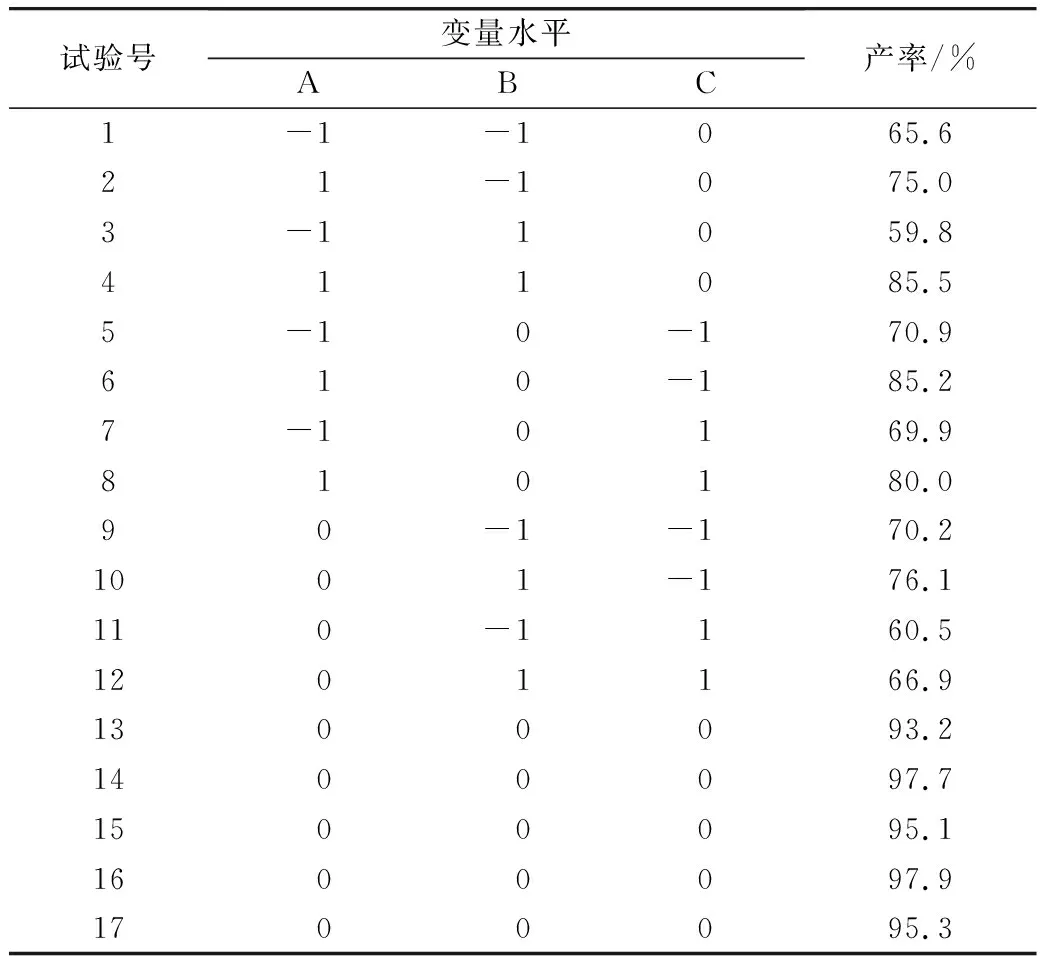
表2 响应面实验设计方案和实验结果
2.3.2 模型的建立与显著性检验
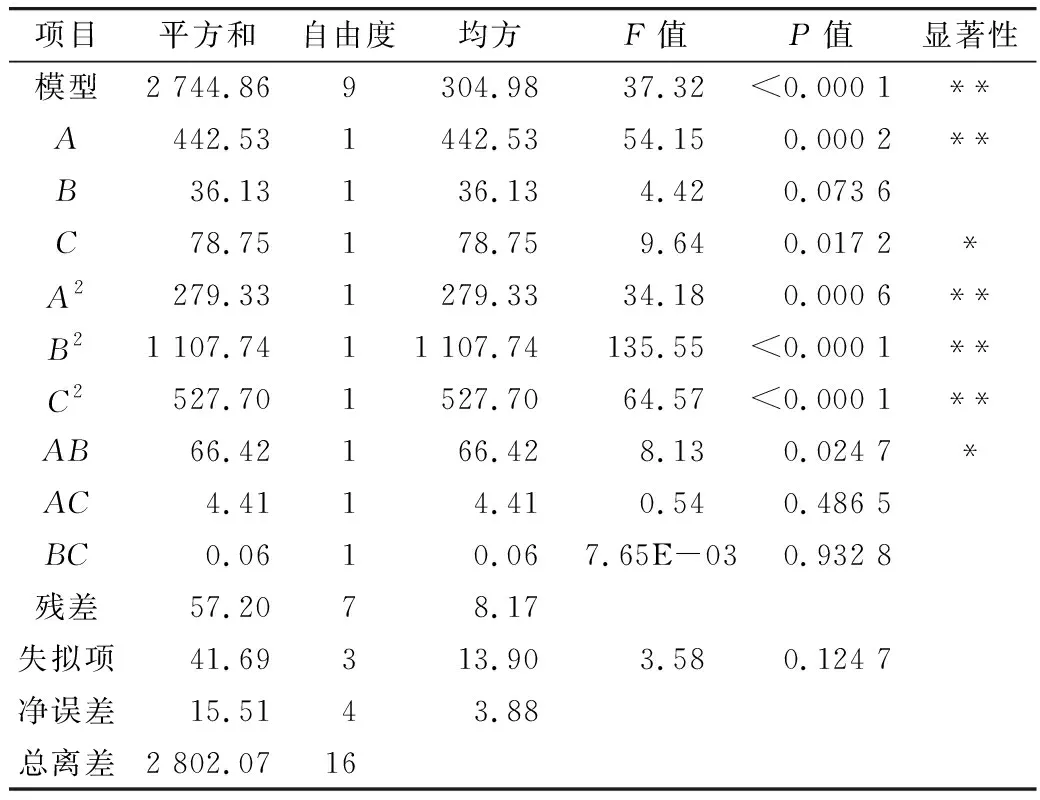
表3 二次多项式预测反应回归模型的系数及方差分析结果
注:“*”表示该项具有显著性效应;“**” 表示该项具有极显著效应。
此外,失拟项的F值为3.58表明失拟项与绝对误差不显著,说明该模型能够适用于本试验的大部分数据,可以预测棕榈酸乙酯生产过程中产率变化及各因素对产率的影响。综上所述,该模型能够用来预测本试验,准确可靠。以棕榈酸乙酯产率为响应值,通过RSM软件对模型进行多元回归分析,回归方程的二次项系数见表3,该二次多项回归方程可拟合为:
Y=+95.84+7.44A+2.13B-3.14C-8.14A2-16.22B2-11.20C2+4.08AB-1.05AC+0.13BC
2.3.3 因素间的交互影响
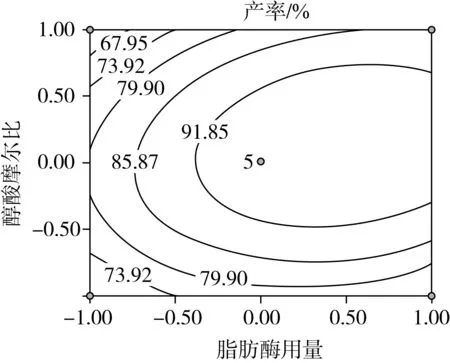
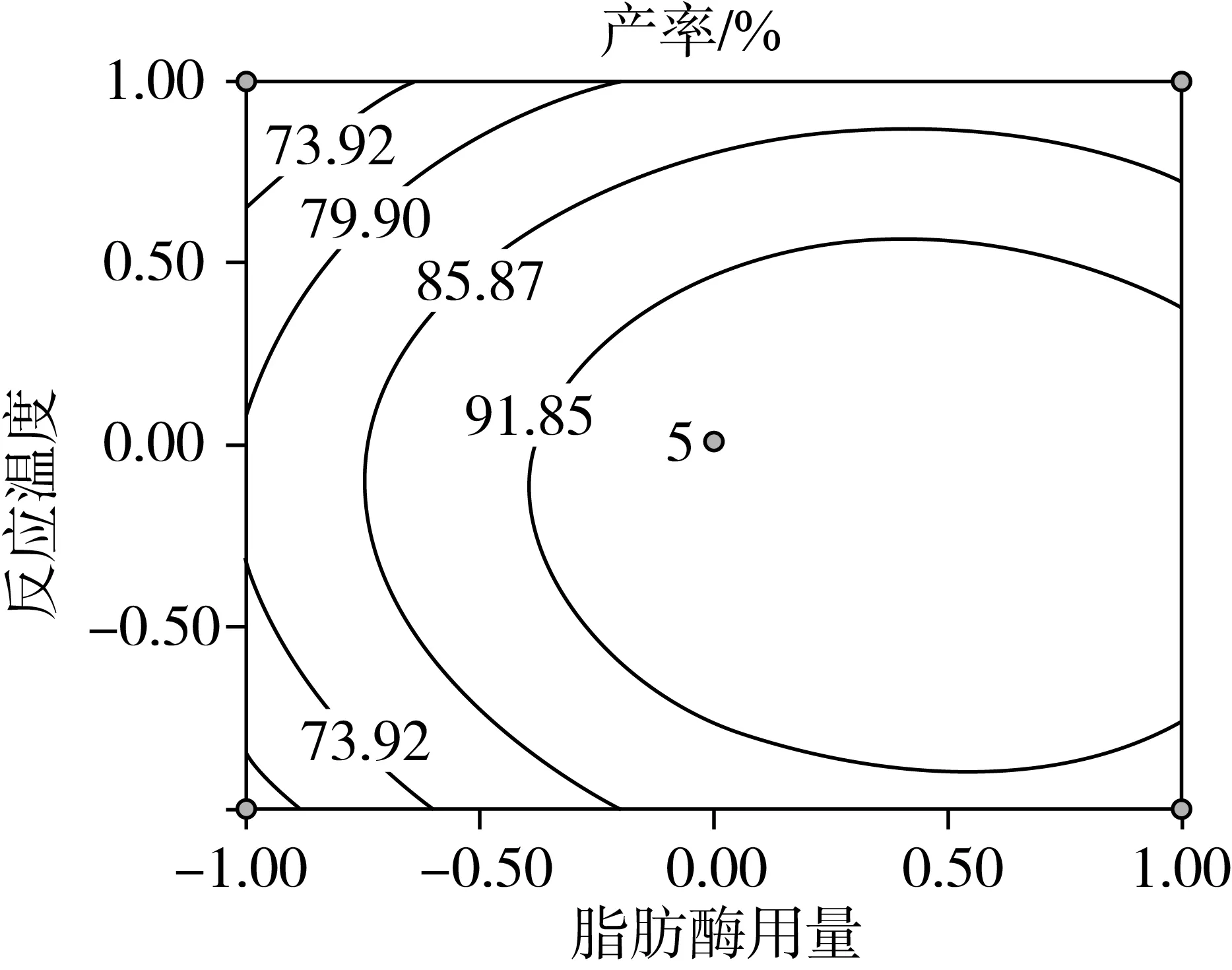
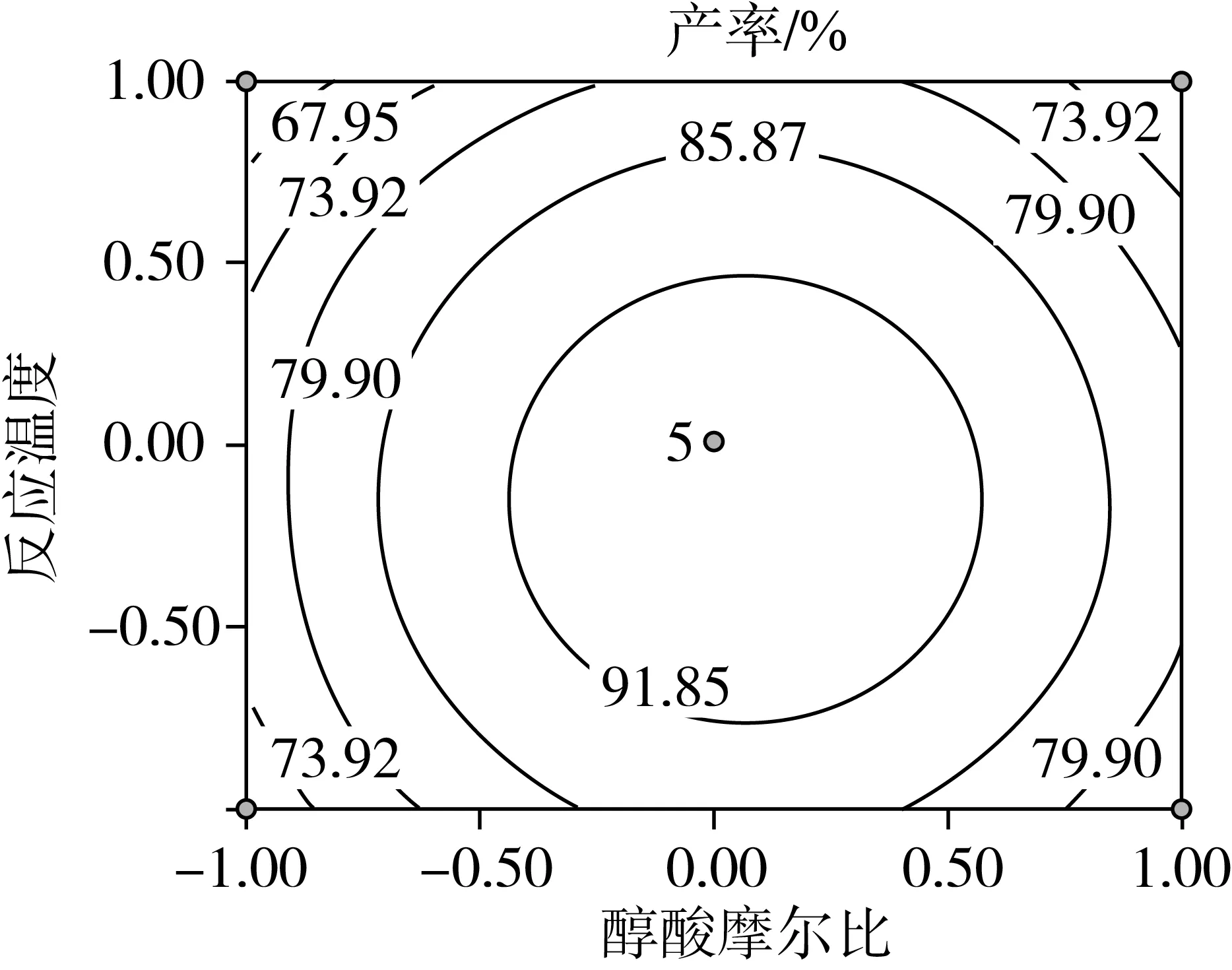
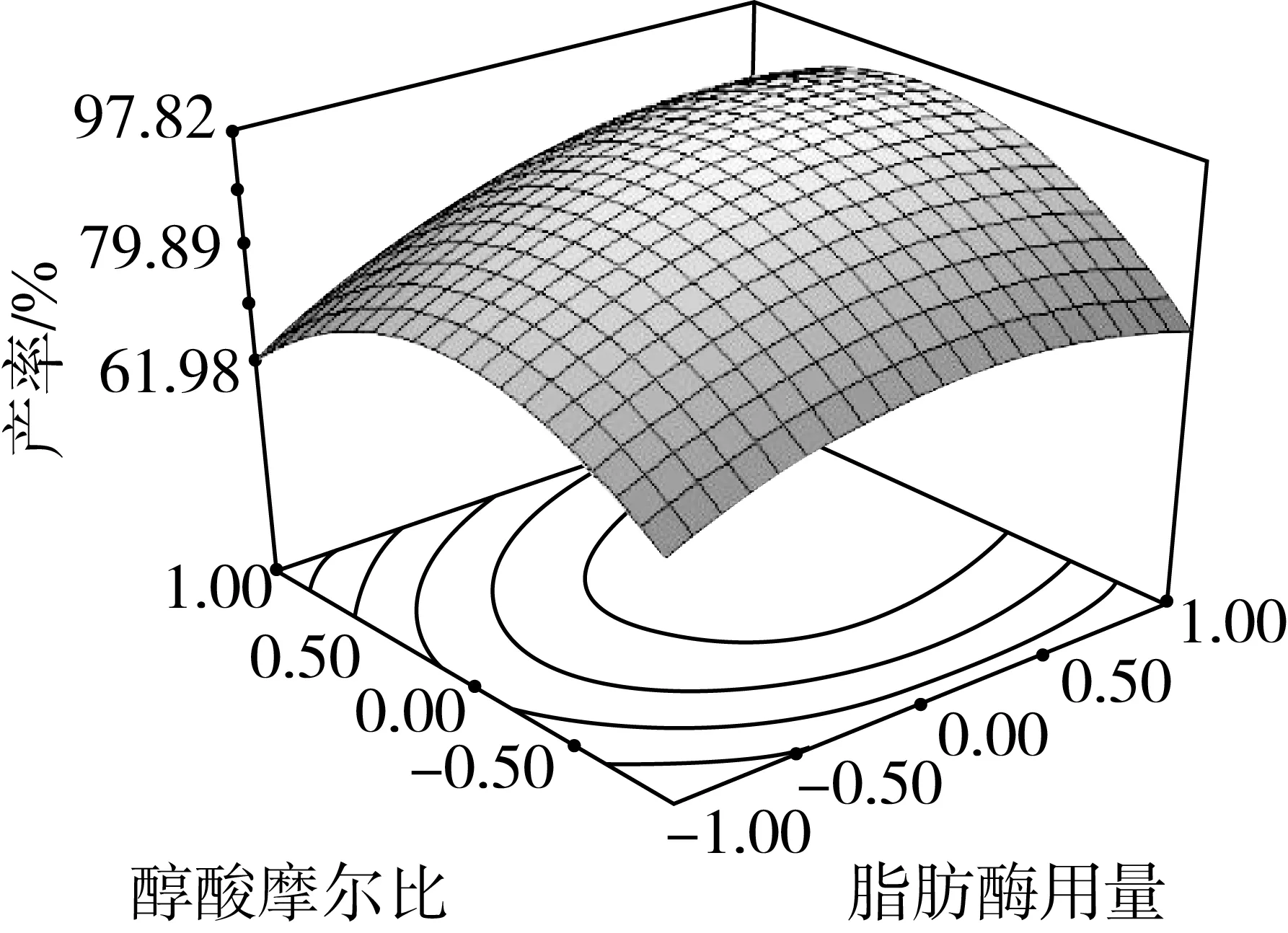
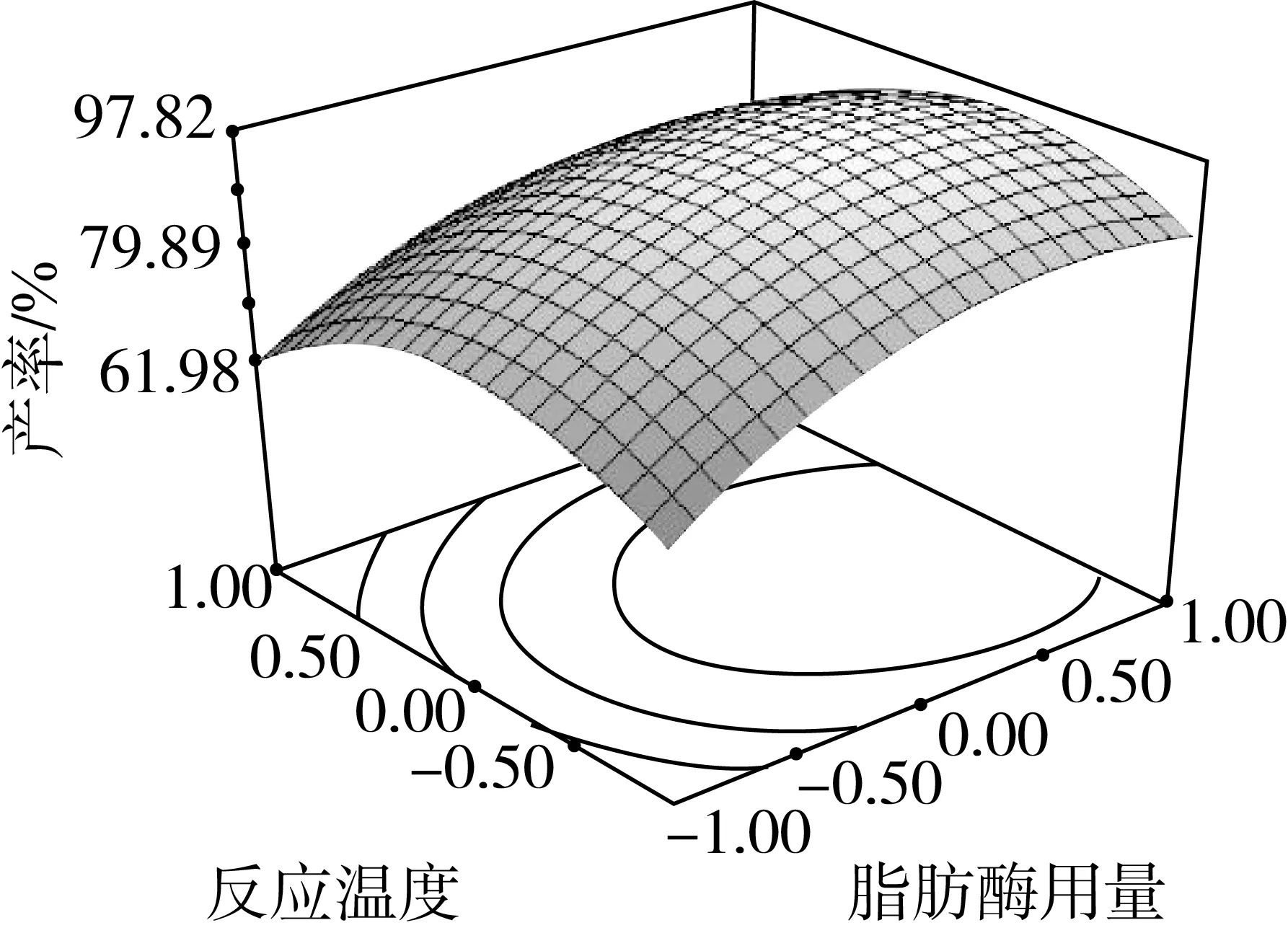
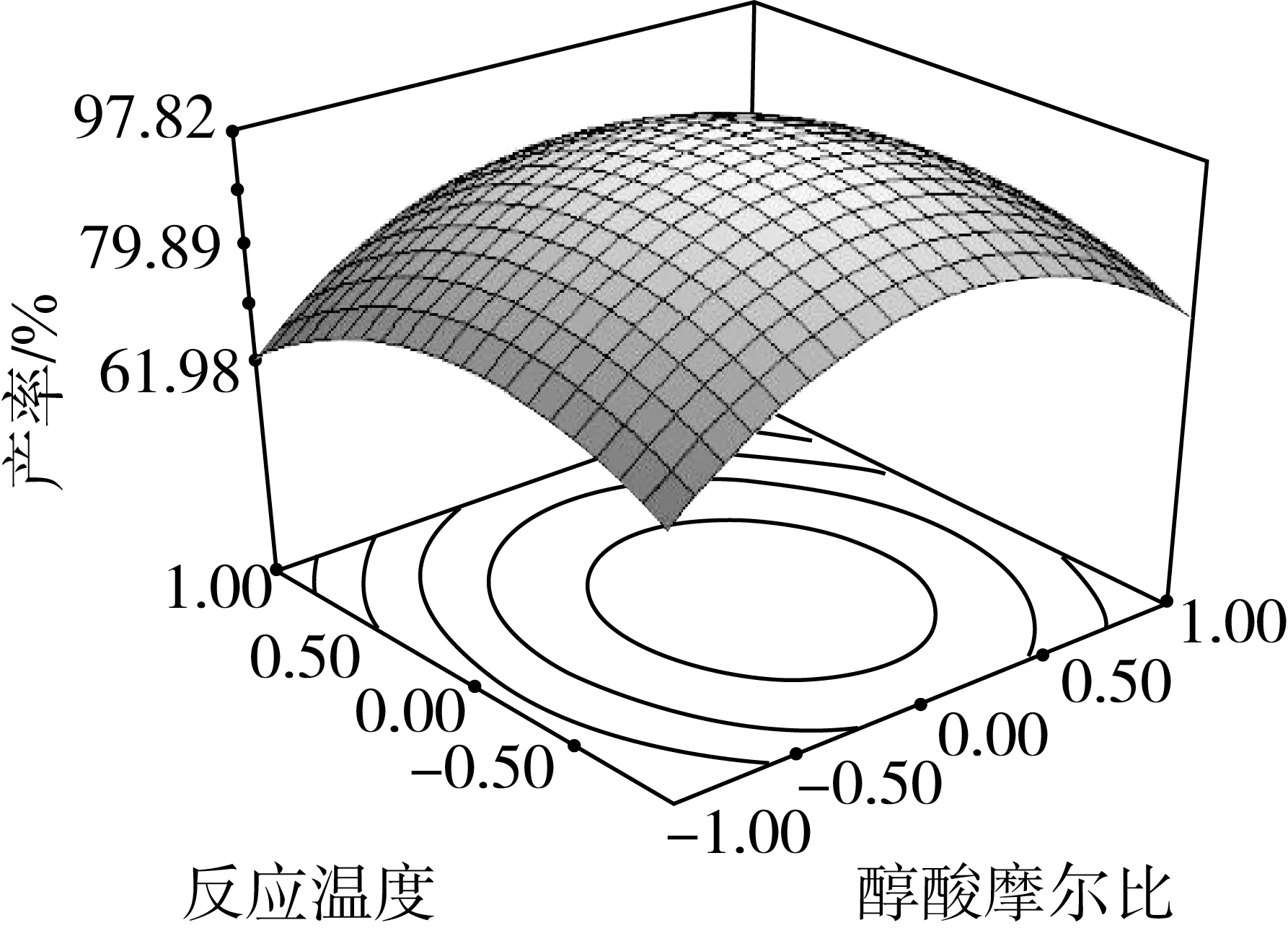
因素交互作用对棕榈酸乙酯产率影响的等高线和响应曲面图如图4所示。可以看出各因素对棕榈酸乙酯产率的影响,以及两独立因素间交互作用的强弱。
由图4可知,当醇酸摩尔比和脂肪酶用量均为最小值时,随着脂肪酶用量和醇酸摩尔比增加,酯化产率也逐渐增加。随后,继续增加醇酸摩尔比,棕榈酸乙酯产率减小,这是因为过量的醇不利于酶活性表达,从而不利于棕榈酸乙酯产率的提高。从图4a和图4d的等高线及响应曲面图可以看出,脂肪酶用量和醇酸摩尔比的相互作用显著,这与表3的分析结果一致。
反应温度一定时,随着脂肪酶用量的增加,棕榈酸乙酯的产率持续增加,当脂肪酶用量达13%左右产率最高,继续增加脂肪酶用量,产率变化不大。当脂肪酶用量保持不变时,随着反应温度的升高棕榈酸乙酯的产率出现先逐步增长后降低的趋势。较高的温度不利于酶促反应的进行,所以当温度升高时反应产率呈下降趋势。
随着醇酸摩尔比以及反应温度的升高,棕榈酸乙酯的产率呈现出逐渐升高的趋势,达到峰值后继续增加任一因素,产率都呈现下降趋势。从图 4c可以看出等高线图呈圆形[25],说明两个因素间的交互作用不明显,这也与表3分析结果一致。
2.3.4 最佳工艺条件的确定
结合回归模型的数学分析可知,经过响应面优化法得到离子液体微乳体系中脂肪酶催化酯化反应的最佳条件是:离子液体用量30%,醇酸摩尔比6.26∶1,脂肪酶用量为棕榈酸质量的13.99%,体系反应温度是34.19 ℃,棕榈酸乙酯的产率为98.09%。考虑到实际操作的方便,将最佳反应条件修正为离子液体用量30%,醇酸摩尔比6.3∶1,脂肪酶用量是14%,体系反应温度是34 ℃。在最佳条件下进行3组平行实验,棕榈酸乙酯平均产率为97.5%,与理论预测值基本相符。因此,该回归模型能够真实地反应各因素对棕榈酸乙酯产率的影响。
a
b
c
d
e
f
3 结 论
脂肪酶存在时,在DBSA+TX-100/环己烷/BmimBF4微乳体系中制备棕榈酸乙酯具有较好的催化活性。微乳体系中DBSA一方面作为表面活性剂参与微乳体系的形成,同时作为Brønsted酸催化酯化反应的进行,脂肪酶与DBSA的协同作用是使该酯化反应获得较高产率的原因。
经过响应面优化,DBSA+TX-100/环己烷/BmimBF4微乳体系中脂肪酶催化合成棕榈酸乙酯的较佳工艺条件为:离子液体用量30%,醇酸摩尔比6.3∶1,脂肪酶用量为棕榈酸质量的14%,反应温度34 ℃,反应时间3.0 h。在此条件下,棕榈酸乙酯产率为97.5%。该结果与模型预测值基本相符。
[1]饶蔚兰, 潘志权, 向守信. 稀土固体超强酸的制备及其对硬脂肪酸酯化反应的催化[J]. 应用化学, 2011, 28(8): 907-912
RAO W L, PAN Z Q, XIANG S X. Preparation of rare earth solid superacid and catalysis on the esterification reactions of stearic acid[J]. Chinese Journal of Applied Chemistry,2011, 28(8): 907-912
[2]吴瑞宁, 陈秀免. 纳米级固体超强酸SO42-/TiO2催化合成棕榈酸乙酯[J]. 化工时刊, 2006, 20(2): 18-20
WU R N, CHEN X M. Synthesis of ethyl palmitate catalyzed by SO42-/TiO2nanosolid superacid[J]. Chemical Industry Times, 2006, 20(2): 18-20
[3]张艳, 章亚东, 蒋登高. 固体酸催化合成棕榈酸乙酯[J]. 精细化工, 2003, 20(4): 230-234
ZHANG Y, ZHANG Y D, JIANG D G. Synthesis of ethyl palmitate with solid acid as catalyst[J]. Fine Chemicals, 2003, 20(4): 230-234
[4]Harmer M A, Sun Q. Solid acid catalysis using ion-exchange resins[J]. Applied Catalysis A: General, 2001, 221(1-2): 45-62
[5]杜欢, 宋乐莲, 谈忠琴, 等. Brønsted酸性功能离子液体催化合成棕榈酸乙酯[J]. 中国食品学报, 2016, 16(1): 139-146
DU H, SONG L L, TAN Z Q, et al. Synthesis of ethyl palmitate catalyzed byBrønsted acidic ionic liquids[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(1): 139-146
[6]李玉琴, 马娟. 以油酸为油相的空白O/W微乳体系研究[J]. 中国现代应用药学, 2017, 34(4): 139-146
LI Y Q, MA J. Oil-in-water microemulsion with oleic acid as the oil phase[J]. Chinese Journal of Modern Applied Pharmacy, 2017, 34(4): 139-146
[7]Maria D C, Nehir A, Julien M, et al. Microemulsion versus emulsion as effective carrier of hydroxytyrosol[J]. Colloids and Surfaces B-Biointerfaces, 2016, 137: 146-151
[8]Atefeh A R, Soleiman A. Microemulsion-based lycopene extraction: Effect of surfactants, co-surfactants and pretreatment[J]. Food Chemistry, 2016, 197: 1002-1007
[9]Ren Y, Zhao Y, Zhang Y, et al. Facile synthesis of Au@SiO2core-shell nanoparticles with multiple Au nanodots by a reverse microemulsion (water-in-oil) method[J]. Colloid Surface A Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2015, 486: 14-20
[10]Shishu G, Ramanpreet K, Randeep K. An ionic liquid-in-water microemulsion as a potential carrier for topical delivery of poorly water soluble drug: Development, ex-vivo and in-vivo evaluation[J]. International Journal of Pharmaceutics, 2015, 495(2): 913-923
[11]Paul B K, Moulik S P. Uses and applications of microemulsions[J]. Current Science, 2001, 80(8): 990-1001
[12]Aristotelis X, Maria Z, Haralambos S. Enzymatic reactions in structured surfactant-free microemulsions[J]. Current Opinion in Colloid & Interface Science, 2016, 22: 41-45.
[13]Antonopoulou I, Leonov L, Juetten P, et al. Optimized synthesis of novel prenyl ferulate performed by feruloyl esterases from Myceliophthora thermophila in microemulsions[J]. Applied Microbiology and Biotechnology, 2017, 101(8): 3213-3226
[14]周国伟, 黄锡荣, 李越中, 等. 脂肪酶在微乳液和微乳液凝胶中催化辛酸辛醇的酯化反应[J]. 生物工程学报, 2001, 17(2): 224-227
ZHOU G W, HUANG X R, LI Y Z, et al. Esterification of octanoic acid with 1-octanol catalyzed by lipase in W/O microemulsions and in microemulsion-based organogels[J]. Chinese Journal of Biotechnology, 2001, 17(2):224-227
[15]马松艳,褚莹,吕忠贤, 等. 十二烷基苯磺酸/异辛烷微乳液中脂肪酶催化合成异丁酸异戊酯[J]. 化学学报, 2006, 64(15): 1523-1527
MA S Y, CHU Y, LV Z X, et al. Lipase-catalyzed synthesis of isoamyl isobutyrate in DBSA/isooctane microemulsion system[J]. Chinese Journal of Chemical Engineering, 2006, 64(15): 1523-1527
[16]Zanetteb A F, Zampakidia I, Sotiroudisa G T, et al. Chemo-enzymatic epoxidation catalyzed byC.antarcticalipase immobilized in microemulsion-based organogels[J]. Journal of Molecular Catalysis B-Enzymatic, 2014, 107: 89-94
[17]Tan Z Q, Fang M L, Du H, et al. Production of biodiesel catalyzed byCandidarugosalipase at interface of w/o microemulsion system[J]Journal of the Brazilian Chemical Society, 2014, 25(9): 1704-1711
[18]杜欢, 谈忠琴, 宋乐莲, 等. DBSA/环己烷/水微乳体系中脂肪酶催化合成正辛酸甲酯[J]. 中国粮油学报, 2014, 29(9): 57-64
DU H, TAN Z Q, SONG L L, et al. Caprylate in DBSA/cyclohexane/water microemulsion system[J]. Journal of Chinese Cereals and Oils Association, 2014, 29(9): 57-64
[19]Mireia S, Anne K S, Tomasz P J, et al. Conformation and activity of lipase B fromCandidaantarcticain bicontinuous microemulsions[J]. Colloids and Surfaces B-Biointerfaces, 2015, 131: 108-114
[20]林福平. 离子液体在有机合成中的应用[J]. 河南化工, 2010, 27(4): 39-41
LIN F P. The application of ionic liquids in organic synthesis[J]. Henan Chemical Industry, 2010, 27(4): 39-41
[21]王颖, 苏宝根, 邢华斌, 等. 离子液体在微乳液聚合中的应用[J]. 现代化工, 2014, 34(2): 38-43
WANG Y, SU B G, XING H B, et al. Application of ionic liquids in microemulsion polymerization[J]. Modern Chemical Industry, 2014, 34(2): 38-43
[22]尚树川, 侯宁, 柴金玲, 等. 离子液体微乳液研究进展[J]. 山东科学, 2016, 29(1): 87-92
SHANG S C HOU N, CHAI J L, et al. Research advances of ionic liquidmicroemulsion[J]. Shangdong Science, 2016, 29(1): 87-92
[23]陈旭伟, 毛全兴, 王建华. 离子液体在蛋白质萃取分离中的应用[J]. 化学进展, 2013, 25(5): 661-668
CHEN X W, MAO Q X, WANG J H. Ionic liquids in extraction/separation of proteins[J]. Process in Chemistry, 2013, 25(5): 661-668
[24]Ghamgui H, Miled N, Reha A, et a1. Production of monoolein by immobilized staphy lococcus simulans lipase in a solvent-free system: optimization by response surface methodology[J]. Enzyme and Microbial Technology, 2006, 39(4): 717-723
[25]何梦影, 张康逸, 杨帆, 等. 响应面法优化青麦仁的真空充氮烫漂护色工艺[J]. 核农学报, 2017, 31(8): 1546-1555.
HE M Y, ZHANG K Y, YANG F, et al. Optimization of vacuum nitrogencharge blanching technique of green wheat berry by response surface methodology[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1546-1555.

