大鼠心肌细胞急性分离方法及影响因素探讨
,,,
近年来,有关离子通道与疾病相关报道日益增多。有研究表明,通道的分子结构或其中氨基酸位点的改变可能引发某种疾病;同时,某些药物或疾病可影响某种离子通道的功能和结构,导致机体产生一系列病理性改变[1]。随着心脏电生理技术的发展尤其是膜片钳技术在基础领域中的广泛应用,越来越多证据表明许多心血管疾病的发生与离子通道的功能和结构改变密切相关,但不同药物或疾病其影响通道或其亚型不同,因此,应用膜片钳技术对此方面的变化进行系统探索、指导临床合理用药具有重要意义。利用膜片钳技术对心脏疾病各方面实验探究中,心肌细胞已成为目前研究心肌代谢、病理生理、发病机制及心肌疾病治疗的重要工具[2]。膜片钳研究的首要条件是需要合格的心肌细胞。目前,心肌细胞的来源有机械分离法、组织块酶解法、原代细胞培养、急性分离法等方法。虽然常用的细胞多为培养细胞,但与急性分离细胞在形态和功能存在较大差异,急性分离细胞更接近人体的生理状态,实验结果更具说服力。在细胞分离过程中,许多不稳定因素导致分离得到的细胞在数量和质量方面未满足实验要求。本研究经过反复实验和分析后,总结可能存在的影响因素并加以改进,寻找一种操作简单快捷、重现性高的分离方法,进而获得用于膜片钳实验的高质量心肌细胞。
1 材料与方法
1.1 实验动物 清洁级SD大鼠,雌雄不限,体重为200 g~350 g,由扬州大学医学院实验动物中心提供。
1.2 实验试剂 胶原酶Ⅱ购自Worthington公司,4-羟乙基哌嗪乙磺酸(HEPES)、葡萄糖(glucose)、牛磺酸(Taurine)购自美国Sigma公司,其余试剂均为国产分析纯。
1.3 主要液体配制 无钙台氏液:NaCl 135 mmol/L;KCl 5.4 mmol/L;MgCl2·6H2O 1.0 mmol/L;Na2H2PO4·2H2O 0.3 mmol/L;glucose 10.0 mmol/L;HEPES 5.0 mmol/L。采用NaOH调整pH为7.35~7.40。台氏液:无钙台氏液中加入CaCl21.8 mmol/L。酶液:在无钙台氏液中加入胶原酶Ⅱ0.5 g/L,Taurine 0.4 g/L,牛血清白蛋白(BSA)1 g/L和CaCl230 μmol/L。细胞保存液(KB):Taurine10.0 mmol/L;L-谷氨酸(L-glutamic acid)70.0 mmol/L;KCl 25.0 mmol/L;Na2H2PO4·2H2O 10.0 mmol/L;乙二醇二乙醚二胺四乙酸(EGTA)0.5 mmol/L;HEPES 5.0 mmol/L;glucose 11.0 mmol/L;KOH 89.1 mmol/L。采用KOH调整pH为7.35~7.40,室温存放。
1.4 心肌细胞分离方法 主要操作方法参考文献[3],本研究在细胞酶解分离具体环节进行对应的研究和改进:首先给予大鼠腹腔注射肝素、戊巴比妥钠,麻醉后,将大鼠仰卧固定,迅速取出心脏,置于4 ℃无钙台氏液中对其进行预处理(漂洗、清洗血污、去除多余的结缔组织等)[4],常规插管、结扎、固定[5]。详细比较不同分离流程对细胞分离结果的影响,实验过程分别先采用有钙台氏液灌流,待心脏复跳30 s后改用无钙台氏液灌流8 min~10 min,或直接采用无钙台氏液灌流10 min,之后再用含钙的酶溶液反复灌流20 min~30 min两种不同的灌流方式。停止消化标志以心脏开始明显胀大、心脏滴速增加、溶液变浑浊为准。整个灌流过程持续充纯氧,灌流液流出端口温度始终保持在37 ℃。消化结束后剪下心室组织置于KB液中,使用眼科剪将其剪碎,用粗胶头吸管轻轻捶打数次使细胞分散,再用120目滤网过滤去除残余组织,后放置室温让细胞自然沉降10 min,弃上清液,反复3次,之后避光放置室温2 h~3 h备用。

2 结 果
2.1 心脏细胞的形态和结构 倒置显微镜下观察刚分离心肌细胞的形态结构,长杆状伸直舒展,细胞无明显搏动,横纹清晰、立体感强,且细胞内无小泡则为存活的心肌细胞,此类细胞耐钙性好,通常可作为实验选择对象。详见图1。

图1 显微镜下心肌细胞形态和结构
2.2 不同pH值对细胞存活率比较 实验过程观察发现,灌流液pH值大小对分离细胞质量有较大影响[6-7],因此本研究设计3组不同pH值分析酸碱浓度对细胞存活率的影响。结果所示:pH值7.15~7.25细胞存活率最低(P<0.05),pH值7.25~7.35和7.35~7.45细胞存活率比较,差异无统计学意义(P>0.05),细胞分离效果较好。详见表1。


pH值n细胞存活率7.15~7.25611.5±1.9 7.25~7.35663.7±4.01)7.35~7.45667.5±3.11) 与pH值7.15~7.25比较,1)P<0.05。
2.3 不同复钙方法细胞存活率比较 为降低复钙时心肌细胞不耐钙引起的钙反常现象,设计实验探讨和选择最优复钙步骤:一步复钙法是将分离的细胞直接加入生理浓度为1.8 mmol/L的有钙台氏液中,计算细胞的存活率;二步复钙是将细胞外液浓度按0.9 mmol/L、1.8 mmol/L梯度复钙;三步复钙是按0.6 mmol/L、1.2 mmol/L、1.8 mmol/L的细胞外液浓度复钙。结果所示,三步复钙后的存活率明显高于一步和二步复钙后的存活率。详见表2。


步骤n细胞存活率一步复钙617.0±2.51)二步复钙632.8±2.51)三步复钙656.3±2.8 与三步复钙比较,1)P<0.05。
2.4 不同灌流速度对分离细胞存活率影响 灌流过程中灌流液流速对心脏酶消化有一定的影响,观察灌流过程中不同灌流速度对细胞存活率的影响。结果显示,灌流液流速为3 mL/min细胞存活率最高(以20滴为1 mL)。详见表3。

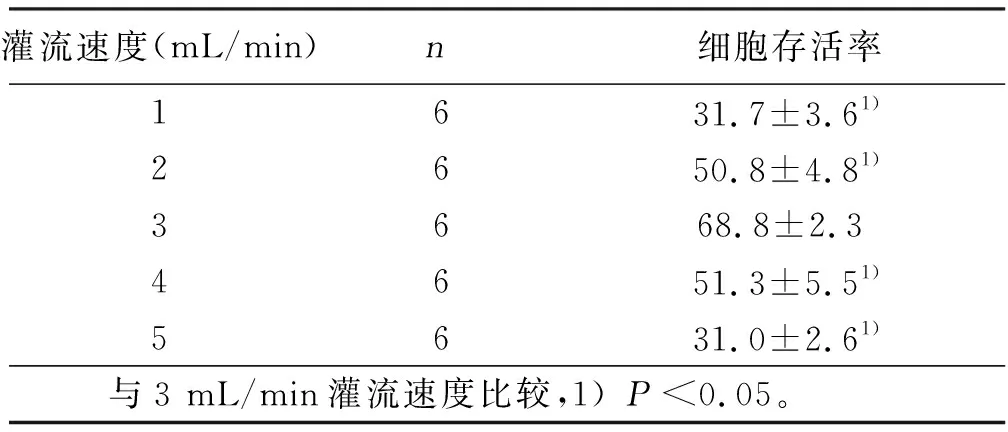
灌流速度(mL/min)n细胞存活率1631.7±3.61)2650.8±4.81)3668.8±2.3 4651.3±5.51)5631.0±2.61) 与3 mL/min灌流速度比较,1)P<0.05。
2.5 不同灌流流程细胞存活率比较 根据上述实验条件的逐项优化,减少外界环境对其影响得出最佳的实验数据,为进一步显示本实验方法优势,为明确灌流过程心脏复跳对本实验有重要意义,采用有钙-无钙台氏液先灌流后再行酶解分离方式和直接使用无钙台氏液灌流后再行酶解分离方法进行比较。结果显示,前者即刻分离细胞的存活率与复钙后的存活率明显高于后者,差异有统计学意义(P<0.05)。详见表4。

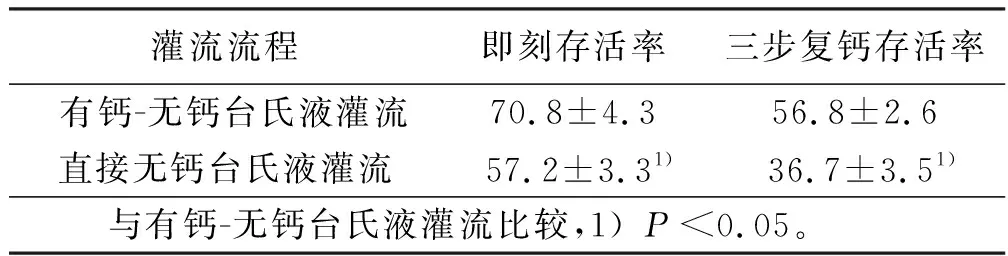
灌流流程即刻存活率三步复钙存活率有钙-无钙台氏液灌流70.8±4.356.8±2.6直接无钙台氏液灌流57.2±3.31)36.7±3.51) 与有钙-无钙台氏液灌流比较,1)P<0.05。
3 讨 论
目前,Langendorff装置酶解法分离心肌细胞的方法已成熟,虽按文献步骤进行,但重复性差、未知因素多,因此,需深入探索细胞分离过程的诸多影响要素。Langendorff灌流系统的稳定性、灌流液的温度、酶的选择、浓度及消化时间等各个细节及操作者的熟练程度等均可能影响心肌细胞的状态[8-9]。因此,本实验选择几个要素,探讨溶液的pH值、不同复钙法、灌流液的流速和不同的灌流流程等因素对大鼠心肌细胞分离的影响。
pH值的控制在整个实验过程中非常重要,由于心肌细胞对生理环境的酸碱度较敏感,过酸或过碱均可能影响心肌细胞及酶的活性。pH<7.20,细胞处在非生理环境,易造成细胞的损伤或死亡;pH>7.40,使细胞外液Ca2+与细胞膜上磷脂结合率增加,此时Ca2+内流增加,导致细胞钙超载,细胞持续收缩,能量大量消耗而死亡[10]。有实验认为,心肌细胞在酸性环境易存活,将溶液pH值调整为7.20±0.05[11]。本实验结果得出,将灌流液及消化液pH值调为7.35~7.40分离结果最优。
目前分离心肌细胞方法主要为酶消化法和机械收集法[12]。本实验采用酶消化法,但酶消化法分离心肌细胞遇到的最大问题是“钙反常现象”。将分离的心室肌细胞直接置入生理浓度环境中复钙,大量细胞因不耐钙而挛缩和死亡,导致心室肌细胞的存活比例大幅降低。因此,本实验采用3种复钙方法比较,三步复钙后的细胞存活率最高:三步复钙可补偿因无钙台氏液灌流造成细胞内Ca2+丢失;梯度复钙逐渐过渡到正常钙环境,使心肌细胞适应生理状态的Ca2+浓度;其在分离过程中破裂的肌膜得到修复[13-15]。因此,逐步复钙可增强细胞对钙的耐受性,有助于减轻“钙反常”提高心肌细胞的存活比例[16]。
相同时间内,滴速太慢导致心脏内部温度很难达到37 ℃,影响酶的活性,使心脏消化不充分;若滴速太快,容易消化过度使细胞膜受损,消化时间难以掌控,因此滴速控制在每秒1滴最佳[17-18]。
不同的灌流流程比较,由于心脏跳动频率缓慢,不足以将心脏内血液全部排出,造成血液堵塞血管使心脏组织坏死且影响下一步酶解。因此,本实验先加有钙台氏液使心脏复跳30 s将残留血液排出,此过程中需控制好灌流时间,由于钙存在可使心脏持续复跳,加快心脏能量代谢,增加细胞氧耗,导致分离细胞活性降低。分离过程要时刻观察心脏的外表状态,避免出现表面发白情况,以红润通透为佳。
分离细胞还应注意一些细节问题,如开胸取出心脏、修剪和悬挂心脏动作需准确迅速,可减少心肌组织缺氧,保证分离出优质的心肌细胞。悬挂心脏所用时间在1 min~3 min内完成,可防止冠状动脉血栓形成并减少心肌耗氧。主动脉根部保留5 mmol/L~10 mmol/L,保证灌流在冠状动脉开口以上,若保留太短,冠状动脉出现无灌流现象[19]。
酶选取可影响实验结果,因此选择合适的酶类型、剂量及控制好分离时间尤为重要。有文献报道采用蛋白酶消化分离细胞,然而蛋白酶主要用于分解组织间质的蛋白成分,且消化程度不易控制,有增加损害细胞膜蛋白的危险,造成细胞受损存活率下降[6,20-21]。目前广泛用于解离细胞间结缔组织的消化酶是Ⅱ型胶原酶,对细胞损伤较小,故本实验采用Worthington公司生产的胶原酶Ⅱ。在酶液中加入BSA和牛磺酸保护心肌细胞[22-23]。酶溶液含有CaCl230 μmol/L保持细胞内Ca2+平衡以提高酶的活性。控制酶的剂量很关键,剂量过大,破坏细胞膜的结构,造成横纹不清晰,在放置过程中易死亡;剂量太小,不足以破坏细胞之间的连接,不能有效分离心肌细胞[24]。因此,本实验采用0.5 g/L剂量,但实验需根据大鼠体型的大小、年龄的不同等适时调整。
通过分析和总结分离细胞中出现的常见影响因素,并对整个实验过程进行优化和改良,使得分离的心肌细胞具有活性高、数量多、满足多种实验的需要、达到高阻易分解等优点。通过钠、钾等离子的动作电位、电流测定结果表明该心肌细胞分离方法具有正常的生理特性,适用于膜片钳技术的研究,且该方法操作简便有效、重复性强、经济等特点也适合其他动物心肌细胞分离实验。
参考文献:
[1] 张宗明,裘法祖.离子通道与疾病[J].世界华人消化杂志,2005,13(5):585-587.
[2] 李德,唐兵,杨大春,等.Ⅱ型胶原酶加压灌流提高成年大鼠心肌细胞分离效率[J].中国实验动物学报,2011,19(2):150-152.
[3] Yazawa K,Kaibara M,Ohara M,et al.An improved method for isolating cardiacmyocytes useful for patch clamp studies[J].Japanese Journal of Physiology,1990,40(1):157-163.
[4] 姚金朋,韩慧蓉,高尔,等.恒流灌注分离心肌细胞及膜片钳记录钾电流方法学探讨[J].中国比较医学杂志,2007,17(10):613-615.
[5] 常翠仙,谷世奎,周欣,等.昆明小鼠心室肌细胞分离及钙电流观察[J].天津医科文学学报,2011,1(17):117-119.
[6] 邓胜利,喻田,文钰纾,等.成年大鼠心肌细胞的分离与培养[J].遵义医学院学报,2008,31(6):587-589.
[7] 童德兵,曹华明.大鼠心肌细胞的分离培养[J].贵州医药,2014,38(7):667-669.
[8] 韦丽兰,莫书荣.成年大鼠心肌细胞的急性分离方法[J].中国组织工程研究,2012,16(11):1969-1972.
[9] 廖华,糜涛,涂志业,等.成年大鼠心肌细胞分离方法的改良[J].中国组织工程研究与临床康复,2009,13(33):6536-6539.
[10] 李泱,程芮.离子通道学[M].武汉:湖北科学技术出版社,2007:11.
[11] Remiao F,Carmo H,Carvalho F,et al.Cardiotoxicity studies using freshly isolated calcium-tolerant cardiomyocytes from adult rat[J].Vitro Cellullar & Development Biology Animal,2001,37(1):1-4.
[12] King N,Lin H,Suleiman MS.Oxidative stress increases SNAT1 expression and stimulates cysteine uptake in freshly isolated rat cardiomyocytes[J].Amino Acids,2011,40(2):517-526.
[13] 龙毅,周亚南,殷跃辉.急性分离大鼠心房肌细胞方法的改进及对钾、钠、钙电流的记录[J].重庆医科大学学报,2011,36(8):910-912.
[14] 李超彦,肖剑锋,沈建新,等.成年SD大鼠心肌细胞分离及其胞内钙离子动态变化测定[J].汕头大学医学院学报,2007,20(3):138-140.
[15] 采智钢,刘维永.成熟心肌细胞培养技术及其应用进展[J].临床心血管病杂志,2001,17(8):383-384.
[16] Bhargava A,Lin X,Novak P,et al.Super-resolution scanning patch-clamp reveals clustering of functional ion channels in the adult ventricular myocyte[J].Circulation Research,2013,112(8):1112-1120.
[17] Eckerle LG,Felix SB,Herda LR,et al.Measurement of antibody effects on cellular function of isolated cardiomyocytes[J].Journal of Visualized Experiments,2013(73):e4237.
[18] 方舟,卢才义,李泱.小鼠心室肌细胞分离方法的改良及钾电流的记录[J].中国心脏起搏与心电生理杂志,2011,25(6):532-535.
[19] 张良胜,李平,许翔,等.大鼠心室肌细胞急性酶分离及瞬时外向钾电流的记录[J].中国当代医药,2014,21(22):20-22.
[20] 孙敏,于海奕,张幼怡,等.成年大鼠心肌细胞分离培养及兴奋-收缩耦联表征[J].中国比较医学杂志,2014,24(3):1-5.
[21] 李勇刚,石应康,陈焕文,等.成年大鼠心肌细胞的分离和培养[J].华西医学,2005,20(2):308-309.
[22] 杜来义,夏艳婓,丰俊鹏,等.膜片钳技术研究中钙耐受的心室肌细胞分离方法[J].中医学报,2014,5(29):685-688.
[23] 张琳,纵静,张庆涛.成年大鼠心肌细胞急性分离方法的探讨[J].徐州医学院学报,2015,35(10):696-699.
[24] Xu H,Tao J,Chen J,et al.Isolation of Ca2 +tolerant cardiomyocytes from adult rats for patch clamp studies[J].J Nanjing Med Univ,2004,1(18):4-6.

