帕金森病患者起始用药分析
赵学军,吴蕾,丁小灵,牛西远,尤和阳,鲁亚楠
帕金森病(PD)是神经系统第二大神经变性疾病,在年龄>65岁的人群中PD发病率为2%~3%,全球PD患者总数达到1千万以上[1]。PD发病机制主要为黑质多巴胺能神经元变性与α突触核蛋白聚集[2]。目前PD以对症治疗为主,尚无治愈方法。PD治疗方法包括药物治疗、手术治疗、细胞移植治疗和基因治疗,以药物治疗为主。使用药物主要包括多巴胺类药物:左旋多巴(LD)、多巴胺受体激动剂(DA)、儿茶酚-O-甲基转移酶(COMT)抑制剂、选择性单胺氧化酶抑制剂;非多巴胺类药物:金刚烷胺、苯海索[3]。近年来国内外对PD的治疗进行了大量研究,治疗指南也进行了多次更新[4-5],但对新发PD患者起始用药现状的相关研究较少。本研究通过调查PD患者起始用药的特点,探讨PD患者的用药现状。
1 对象与方法
1.1 研究对象 选择2015年9月—2017年4月在安徽医科大学附属安徽省立医院神经内科初次住院治疗的PD患者为研究对象。患者分布在安徽省各个地区。
1.2 研究标准 纳入标准:由2位副高职称以上的神经科专科医师参照《中国帕金森病治疗指南(第三版)》[5]诊断标准诊断为PD的患者。排除标准:(1)有明确病因的继发性PD综合征(血管性PD综合征,药物、炎症、中毒、创伤、代谢性疾病引起的PD综合征)及PD叠加综合征患者。(2)不能回忆初始治疗药物、存在认知功能障碍的患者。
1.3 研究方法 记录PD患者性别、发病年龄、发病症状、发病至确诊时间和起始药物选择类型。对于研究期间在本院首次诊断为PD的新发病例及外院诊断为PD但未服药患者,以本次出院时服用药物作为起始药物选择类型。
1.4 统计学方法 采用SPSS 16.0软件对数据进行统计学分析。计数资料以相对数表示,药物选择比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共选择PD患者156例,其中男85例、女71例,年龄34~88岁。156例患者中129例为已经在外院诊断为PD,这部分患者多因在当地医院治疗效果不佳、症状较重而选择至本院进行住院治疗;另外27例为在本院首次确诊为PD。外院诊断为PD尚未服药患者6例,在本次出院时均服用PD。发病年龄中位数为65岁。发病症状包括静止性震颤(93例)、肌强直(32例)、运动迟缓(27例)、姿势平衡障碍(4例)。
2.2 起始药物选择的分类 依据起始药物选择分为单用LD型92例;LD+DA型30例;LD+其他抗PD药物(LD+X)型:LD+(金刚烷胺、苯海索或单胺氧化酶抑制剂)3例;DA+其他抗PD药物(DA+X)型:DA+(金刚烷胺、苯海索或单胺氧化酶抑制剂)23例;非LD并非DA型:金刚烷胺、苯海索或单胺氧化酶抑制剂8例。
2.3 不同分类PD患者起始药物选择的比较 不同性别、发病年龄、发病症状的PD患者起始药物选择情况比较,差异均无统计学意义(χ2=2.062、5.964、12.166,P=0.724、0.202、0.432,见表1~3);不同发病至确诊时间PD患者起始药物选择情况比较,差异有统计学意义(χ2=20.961,P=0.007)。其中发病至确诊时间为<1年和发病至确诊时间1~2年的患者起始治疗药物选择LD型的比例较高,而在发病至确诊时间>2年的患者中选择LD+DA型的比例明显增高(P<0.05,见表4)。
3 讨论
PD是一种常见的神经系统退行性疾病,发病时多表现为运动迟缓、静止性震颤、肌强直和姿势平衡障碍的运动症状。通过药物治疗维持多巴胺乙酰胆碱能系统动态平衡是目前PD主要的治疗方法,目的为临床症状及延缓疾病进展。最新的指南推荐PD治疗宜早,以期延迟并发症出现,或争取修复时机[6-7]。早期药物治疗可以很大限度地保证PD患者的生活质量和工作能力[7]。既往研究主要关注PD治疗药物引起的运动并发症情况,对PD患者起始药物选择现状的研究较少。

表1 不同性别PD患者起始药物选择的比较〔n(%)〕Table 1 Comparison of the choice for initial drugs between patients of different genders

表2 不同发病年龄PD患者起始药物选择的比较〔n(%)〕Table 2 Comparison of the choice for initial drugs between patients with different ages of disease onset
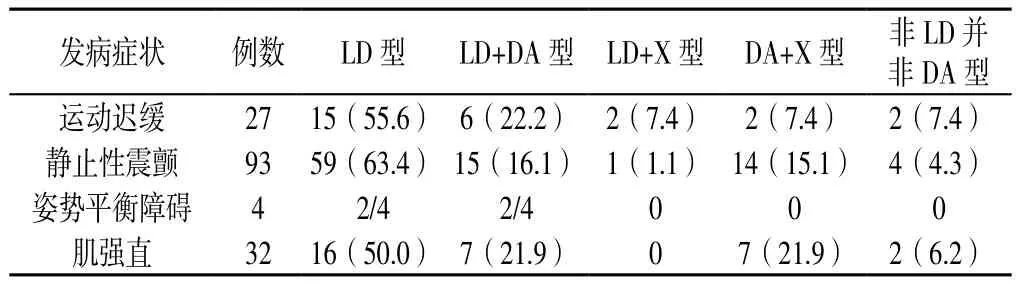
表3 不同发病类型PD患者起始药物选择的比较〔n(%)〕Table 3 Comparison of the choice for initial drugs in patients with different symptoms at the time of onset
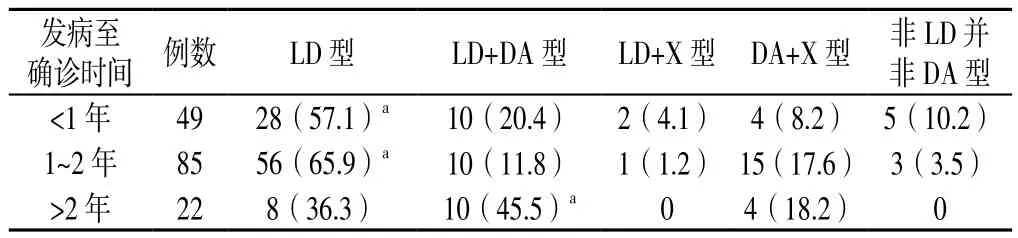
表4 不同发病至确诊时间PD患者起始药物选择的比较〔n(%)〕Table 4 Comparison of the choice for initial drugs in patients with different times from disease onset to definite diagnosis
3.1 发病年龄与起始药物选择 《中国帕金森病治疗指南(第三版)》[5]推荐早发型患者在不伴有智力减退的情况下,可优先选择非麦角类DA、单胺氧化酶抑制剂、金刚烷胺或LD作为起始治疗用药。本研究中,<65岁的患者LD使用率达到76.0%,单用LD的患者比例达到53.3%,而其他药物使用较少。LD因其疗效确切、价格便宜、不良反应少的特点,成为临床首选用药。有研究显示约60%的PD患者服用LD 4~6年后会出现疗效减退、开关现象、异动症等运动并发症[8-9]。应用DA、单胺氧化酶抑制剂可延缓对LD制剂的依赖,甚至能够降低LD相关的运动症状的发生率,并且可能存在神经保护作用,故推荐早期应用于PD治疗[10-14]。本研究发现,DA与单胺氧化酶抑制剂使用很少。药物治疗没有体现出立足当前、长程管理、长期获益的综合治疗原则。
3.2 不同发病症状与起始药物选择 PD的发病症状是患者初始药物选择时需要考虑的因素,抗胆碱能药推荐用于震颤明显的患者,金刚烷胺推荐用于肌强直、震颤的患者[5]。本研究中以静止性震颤为主要运动症状发病的患者为93例(59.6%),以肌强直发病患者32例(20.5%),苯海索、金刚烷胺作为推荐用药,虽然其价格便宜,却很少被使用,多数选择LD。临床治疗应依据患者具体症状特征进行个体化治疗,使患者长期获益最大化。
3.3 发病至确诊时间不同与起始药物选择 确诊时间为<1年和1~2年的患者起始治疗药物选择单用LD的比例分别多达57.1%和65.9%,明显高于选择LD+DA的比例;而确诊时间>2年的患者选择LD+DA的比例增加且多于LD患者。笔者推测由于确诊时间较短,PD症状较轻,临床医师偏向使用单药治疗,LD疗效确切,可能是确诊时间为1~2年和确诊时间<1年的PD患者起始药物选择以LD为主的原因。由于确诊时间较长,患者可能合并的PD症状较重,为控制患者病情,延缓疾病进展,确诊时间>2年的PD患者起始药物选择以LD+DA为主。
PD患者临床症状表现不一,病情严重程度等方面存在差异,因此,患者的治疗方案强调个体化特点。患者起始用药受多种因素的影响:一方面与临床医生对指南及药物特点的认识程度不够有关;随着医疗改革政策深入进行,基层医疗机构将会在多种慢性疾病的治疗中承担更重要的责任,因此,对服务于基层临床医师需要不断进行规范的培训。另一方面与经济水平和医保限制有关;DA价格相对偏高,未纳入医保范畴,药物应用受到限制。
本研究尚存在一些不足之处:(1)新发PD的诊断需要进行一段时间的随访,以排除继发性PD、PD叠加综合征的可能。有研究认为,即使是有经验的专科医师,诊断PD的误诊率依然可能达到25%[15-16]。(2)本研究样本量相对较少,大规模、多中心的研究能够更加充分反应PD治疗用药现状。
作者贡献:赵学军进行研究设计、资料收集、数据整理分析,撰写论文;赵学军、吴蕾进行论文修订,英文修订;牛西远、尤和阳、鲁亚楠进行资料收集;吴蕾、丁小灵进行论文质量控制和审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]POEWE W,SEPPI K,TANNER C M,et al.Parkinson disease[J].Nat Rev Dis Primers,2017,3:17013.DOI:10.1038/nrdp.2017.13.
[2]LOTIA M,JANKOVIC J.New and emerging medical therapies in Parkinson's disease[J].Expert Opin Pharmacother,2016,17(7):895-909.DOI:org/10.1517/146566.2016.1149163.
[3]JANKOVIC J,POEWE W.Therapies in Parkinson's disease[J].Curr Opin Neurol,2012,25(4):433-447.DOI:10.1097/WCO.0b013e3283542fc2.
[4]陈生弟,中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森病治疗指南(第二版)[J].中华神经科 杂 志,2009,42(5):352-355.DOI:10.3760/cma.j.issn.1006-7876.2009.05.020.CHEN S D,Parkinson's Disease and Movement Disorders Group,Chinese Society of Neurology.Chinese guidelinefor treatment of Parkinson's disease(2nd edition)[J].Chin J Neuro,2009,42(5):352-355.DOI:10.3760/cma.j.issn.1006-7876.2009.05.020.
[5]陈生弟,中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森病治疗指南(第三版)[J].中华神经科 杂 志,2014,47(6):428-433.DOI:10.3760/cma.j.issn.1006-7876.2014.06.017.CHEN S D,Parkinson's Disease and Movement Disorders Group,Chinese Society of Neurology.Chinese guidelinefor treatment of Parkinson's disease(3rd edition)[J].Chin J Neuro,2014,47(6):428-433.DOI:10.3760/cma.j.issn.1006-7876.2014.06.017.
[6]POSTUMA R B,BERG D,STERN M,et al.MDS clinical diagnostic criteria for Parkinson's disease[J].Mov Disord,2015,30(12):1591-1601.DOI:10.1002/mds.26424.
[7]HAUSER R A,ZESIEWICZ T A.Advances in the pharmacologicmanagement of early Parkinson's disease[J].Neurologist,2007,13(3):126-132.DOI:10.1097/01.nrl.00256433.15481.eb.
[8]THANVI B R,LO T C N.Long term motor complications of levodopa:clinical features,mechanisms,and management strategies[J].Postgrad Med J,2004,80(946):452-458.DOI:10.1136/pgmj.2003.013912.
[9]PAHWA R,LYONS K E.Levodopa-related wearing-off in Parkinson's disease:identification and management[J].Curr Med Res Opin,2009,25(4):841-849.DOI:10.1185/03007990902779319.
[10]VAN HILTEN J J,RAMAKER C C,STOWE R.Bromocriptine versus levodopa in early Parkinson's disease[J].Cochrane Aatabase Syst Rev,2007,17(4):CD002258.DOI:10.1002/14651858.CD002258.pub2.
[11]MOLLER J C,KORNER Y,DODEL R C,et al.Pharmacotherapy of Parkinson's disease in Germany[J].J Neurol,2005,252(8):926-935.DOI:10.1007/s00415-005-0784-1.
[12]CHEN J J,SWOPE D M.Pharmacotherapy for Parkinson's disease[J].Pharmacotherapy,2007,27(12 Pt 2):161S-173.DOI:10.1592/phco.27.12part2.161S.
[13]Parkinson Study Group.Effect of deprenyl on the progression of disability in early Parkinson's disease[J].N Engl J M e d,1 9 8 9,3 2 1(2 0):1 3 6 4-1 3 7 1.D O I:10.1056/NEJM198911163212004.
[14]JENNER P.Preclinical evidence for neuroprotection with monoamine oxidase-B inhibitors in Parkinson's disease[J].Neurology,2004,63(7 Suppl 2):S13-22.DOI:org/10.1212/wnL.63.7_uppl_2.S13.
[15]MAHLKNECHT P,HOTTER A,HUSSL A,et al.Significance of MRI in diagnosis and differential diagnosis of Parkinson's disease[J].Neurodegener Dis,2010,7(5):300-318.DOI:10.1159/000314495.
[16]HOTTER A,ESTERHAMMER R,SCHOCKE M F,et al.

