口腔鳞状细胞癌病人唾液的代谢组学研究
(青岛大学口腔医学院,山东 青岛 266003)
口腔恶性肿瘤是头颈部最常见的恶性肿瘤,其中90%以上为鳞癌,以口腔鳞状细胞癌(OSCC)最为常见,发病率占全身恶性肿瘤的第6位[1]。目前,治疗OSCC的首选方法仍是综合序列治疗,治疗后易复发,预后并不乐观。研究表明,早期诊断并经过治疗后的口腔鳞癌病人5年生存率可超过80%[2]。但近一半的病人初诊时病情已是中晚期,并伴有淋巴转移[3],故5年生存率仅为50%左右[4]。分子生物学研究证实,OSCC的发生发展是一个多步骤过程[5],包括基因突变、上皮单纯性增生、上皮异常增生、原位癌、浸润癌等。目前临床上对于OSCC的诊断主要是基于组织病理检查,没有无创、便捷、灵敏的诊断方法。代谢组学是近几年兴起的一项研究技术,与肿瘤表型特征关系较基因组学和蛋白组学更为紧密[6-8]。目前正在研究应用于各种肿瘤发展过程中的代谢标志物,以期实现对癌症的早筛选、早发现、早诊断、早治疗,这将对降低癌症的发病率和死亡率有着重要的意义。本文研究应用气相色谱-飞行时间质谱(GC-TOF-MS)代谢组学技术,对临床已确诊的OSCC病人和健康人的唾液进行代谢轮廓的研究,寻找与OSCC相关的潜在代谢标志物,并通过代谢通路对其进行讨论。
1 材料与方法
1.1 试剂及仪器
甲醇(CNW Technologies公司,德国);氯仿、吡啶(Adamas公司,中国);甲氧铵盐(TCI公司,日本);L-2-氯苯丙氨酸(上海恒柏生物科技);BSTFA(REGIS Technologies公司,美国);饱和脂肪酸甲酯(Dr. Ehrenstorfer公司,德国);7890A型气相色谱(Agilent公司,美国);PEGASUS HT型质谱仪(LECO公司,美国);DB-5MS型色谱柱(Agilent公司,美国);Heraeus Fresco17型离心机(Thermo Fisher Scientific公司,美国);TNG-T98型真空干燥仪(华美生化仪器厂);唾液采集管(SARSTEDT公司,德国)。
1.2 研究对象与分组
青岛大学附属医院口腔颌面外科和口腔黏膜病科OSCC病人26例,男16例,女10例;年龄34~84岁,平均(59.8±11.9)岁。样本采集均征得病人本人同意,并由术前病理检查确定诊断。以20例健康志愿者作为正常对照组,男8例,女12例;年龄30~76岁,平均(57.6±11.8)岁。两组性别、年龄比较差异无显著性(P>0.05)。样本采集前确保所有捐献者口腔黏膜均无其他疾病并否认全身系统性疾病,半年内未服用免疫抑制剂,未行化疗。所有研究对象均填写知情同意书,并经伦理委员会审核同意。
1.3 研究方法
1.3.1唾液样本收集及代谢物提取 收集唾液样本前告知病人2 h内禁食、禁饮、禁烟。根据NAVAZESH的方法[9],在上午9:00~11:00收集研究对象唾液样本于唾液采集管中,2 000 r/min离心5 min,得到纯净的唾液样本,置于-80 ℃保存。取200 μL唾液样本加入0.3 mL提取液(甲醇)以及20 μL的L-2-氯苯丙氨酸,涡旋30 s,研磨仪处理4 min,冰浴超声5 min;于4 ℃、13 000 r/min离心20 min;取0.4 mL上清液于2 mL进样瓶(甲烷硅基化)中,每个样本各取70 μL混合成质控(QC)样本;干燥提取物,加入20 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于20 g/L吡啶中),放入80 ℃烘箱中30 min;分别向每个样品中加入30 μL的BSTFA(含有体积分数0.001的TMCS),将混合物70 ℃孵育1.5 h;冷却至室温,加入5 μL饱和脂肪酸甲酯C8-C16(1 g/L)和C18-C24(0.5 g/L);随机顺序上机检测。
1.3.2GC-TOF-MS数据采集 GC条件:DB-5MS毛细管柱(30 m×250 μm×0.25 μm),进样口温度280 ℃,离子源温度250 ℃,以氦气作为载气,前进气流量2 mL/min,气体流量1 mL/min,不分流,进样量2 μL。柱箱升温程序:初始温度50 ℃(保持1 min),以10 ℃/min升至310 ℃(保持8 min)。MS条件:电子轰击离子源温度250 ℃,电子能量70 eV,接口温度270 ℃,全扫描模式下在50~500 m/z范围内以每秒20个光谱的速率在溶剂延迟6.27 min后获得质谱数据。
1.4 数据处理
运用四分位数间距对数据偏离值进行过滤,对原始数据的缺失值进行模拟,用内标归一法对数据进行标准处理。数据预处理后,使用SIMCA软件进行多元变量模式识别分析,运用主成成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA)法对结果进行建模分析,对模型有效性进行评判;最后通过置换检验对模型有效性做进一步的检验。
1.5 差异代谢物的筛选及鉴定
根据OPLS-DA模型第一主成分的变量投影重要度(VIP)>1、Student’st检验的P值(P<0.05)寻找差异性代谢标志物;通过检索LECO-Fiehn Rtx5数据库对所寻找到的代谢标志物进行质谱匹配及保留时间指数匹配,最后使用标准品验证结果。
2 结 果
2.1 GC-TOFMS数据分析结果
OSCC组和正常对照组的唾液样本初步检测出530个峰,数据经过过滤、标准化处理、利用内标(IS)进行归一化,334个峰被保留。两组样本的典型离子流色谱图见图1。为了区分OSCC组和正常对照组,对所有唾液样品的实验数据进行OPLS-DA建模分析,结果见图2。由图2可见,OSCC组与正常对照组表现出明显的分离趋势,说明两组代谢谱间存在着明显差异。置换检验证明模型可靠,解释模型的参数R2Y=0.858,表示模型预测能力的参数Q2=0.322,且无过拟合现象[10]。
2.2 差异代谢物鉴定结果
经鉴定最终确定6个代谢差异物,包括尿酸、核糖、酪氨酸、植物鞘氨醇、二氢神经鞘氨醇、对羟基乳酸。见表1。通过对以上得到的差异代谢物进行层次聚类分析,并以热力图展示[11],见图3。可以清楚地观察到6个代谢标志物中,只有酪氨酸在OSCC组浓度较高,其余5个代谢标志物在OSCC组浓度均较低,在正常对照组浓度均较高。见图4。
3 讨 论
代谢组学是通过观察生物体受刺激或扰动后其代谢产物的变化或代谢产物随时间的变化,来研究生物体代谢途径的一种技术。过去10年中,代谢组学在乳癌、胰腺癌、鼻咽癌等癌症的早期诊断中都有应用,并受到全球范围内的关注[12]。有研究证实,即使对于癌症早期和相对较小的肿瘤来讲,其代谢谱与健康人群的差异也是非常明显的。提示癌症具有全身性的代谢反应[13]。由于唾液样本收集无创伤、易采集、与病人有良好的合作、没有收集地点的限定、检测敏感等优点,更易被受试者接受[14]。
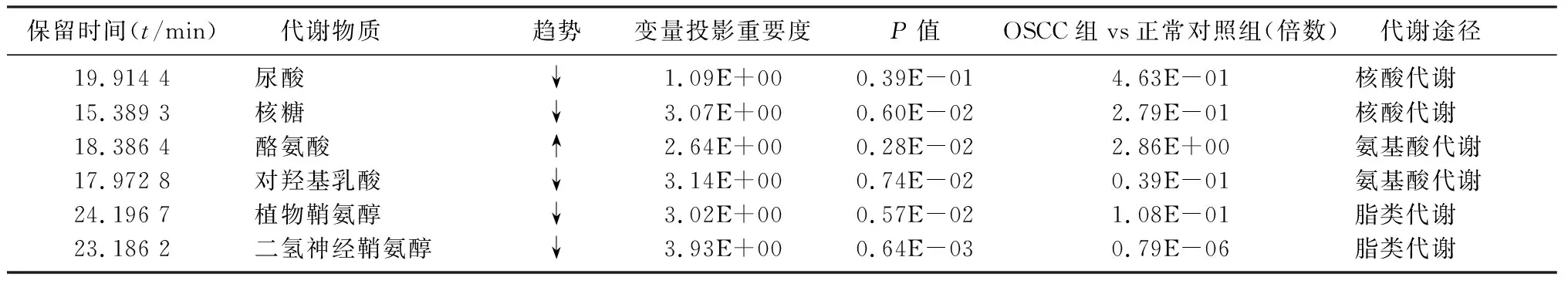
表1 经实验鉴定的OSCC组区别于正常对照组的差异代谢物


图1 两组唾液样本典型离子流色谱图

横坐标t[1]P表示第一主成分的预测主成分得分,纵坐标t[1]O表示正交主成分得分,散点形状和颜色表示不同的实验分组。

横坐标C代表OSCC组,B代表正常对照组,不同的色块代表对应位置代谢物的相对表达量。

亮蓝色标记点为浓度下降趋势,亮红色标记点为浓度升高趋势。
本研究采用GC-TOF-MS的代谢组学方法对OSCC组与正常对照组的唾液样本进行分析,找出并鉴定了6种生物标记物,分别为尿酸、核糖、酪氨酸、植物鞘氨醇、二氢神经鞘氨醇、对羟基乳酸。据Warburg Effct效应,与正常细胞不同,肿瘤细胞主要通过糖酵解作用而产生能量。在有氧的条件下,葡萄糖经过糖酵解作用逐步分解生成乙酰辅酶A进入三羧酸循环(TCA),TCA不仅是三大类物质(糖类、脂类、蛋白质)的最终代谢通路,也是糖类、脂类、蛋白质代谢甚至核酸代谢的联系枢纽。本实验从热力图中可以直观观察到酪氨酸在OSCC组高表达,酪氨酸是由蛋白质代谢产物苯丙氨酸转换而成。肿瘤病人体内蛋白质代谢较为复杂,总体表现为蛋白质分解增加超过合成增加。作为蛋白质代谢的中间产物,氨基酸的代谢也呈明显紊乱,因此酪氨酸作为其分解代谢产物在OSCC病人唾液中浓度呈增高趋势。有动物实验表明,体内及体外去除苯丙氨酸/酪氨酸均可以抑制肿瘤细胞的增殖,使肿瘤细胞阻止于G0/G1期,同时可以降低周期素D1的表达[15]。由此推测,体内酪氨酸与肿瘤有一定的相关性。本文酪氨酸代谢通路分析显示,在该通路里酪氨酸经过谷氨酸草酰转氨酶(2.6.1.1)和酪氨酸转氨酶(2.6.1.5)的协同作用后,共同调控其代谢产物对羟基乳酸,从而使对羟基乳酸的含量呈现下调趋势。
本文结果显示,OSCC唾液二氢神经鞘氨醇和植物鞘氨醇浓度均呈下调趋势,这与WANG等[16]的研究结果相似。二氢神经鞘氨醇和植物鞘氨醇均与神经酰胺的合成和代谢有关,神经酰胺为鞘脂的代谢产物,被认为是诱导细胞凋亡的重要细胞信号,参与调节细胞的生长、分化、衰老和细胞程序性死亡等许多重要的信号转导过程。脂代谢紊乱与肿瘤的发生与转移有一定的关系。恶性肿瘤细胞增殖时,胆固醇的摄取量增多、合成加速。二氢神经鞘氨醇作为抑制低密度脂蛋白诱导胆固醇酯化的阻滞剂,引起未酯化的胆固醇积聚在细胞核周区;同时,植物鞘氨醇在结构上类似于鞘氨醇。因此,OSCC病人唾液中二氢神经鞘氨醇和植物鞘氨醇浓度均呈下调趋势。提示这些具有生物活性的鞘脂代谢物有望成为OSCC的生物标志物。
尿酸是由核酸的中间代谢产物嘌呤核苷酸在黄嘌呤作用下转换而成。其中,嘌呤核苷酸在机体的能量供应和代谢调节等方面都有十分重要的意义。核酸作为生命活动的基本物质之一,储存在人体细胞的细胞核和线粒体中,由RNA和DNA两部分构成,在机体的生长和遗传等生命活动过程中起着至关重要的作用。在肿瘤病人核酸代谢的过程中,DNA和RNA聚合酶活性均较正常组织高,由于核酸代谢明显降低,从而导致尿酸浓度也明显降低,因此,尿酸的浓度在OSCC病人唾液中呈下调趋势。核糖是核酸的基本构成单位,其浓度在OSCC病人唾液中也呈现下调的趋势。本实验结果从代谢角度提示尿酸和核糖作为OSCC代谢标志物的潜在可能性。
综上所述,应用代谢组学研究方法,从OSCC病人唾液中成功筛选出6种口腔鳞癌唾液代谢标志物;相关代谢通路分析显示,OSCC病人与健康人群相比存在着氨基酸代谢和能量代谢紊乱以及脂类代谢失衡的现象,还表现出TCA异常。由于本实验样本数量有限,导致了此次实验的局限性,因此本实验结果还需要通过更多的实验样本进行验证,若今后研究同时结合血液样本和尿液样本,可以得到更加完善的代谢图谱,这将为OSCC的诊断提供可靠的代谢证据,为将来的临床工作提供有效的帮助。
[参考文献]
[1] WARNAKULASURIYA S. Global epidemiology of oral and oropharyngeal Cancer[J]. Oral Oncology, 2009,45(4/5):309-316.
[2] CANDIOTA A P, MAJS C, JULI-SAPÉ M, et al. Non-invasive grading of astrocytic tumours from the relative contents of myo-inositol and glycine measured by in vivo MRS[J]. JBR-BTR, 2011,94(6):319-329.
[3] CHENG Y s-l. Advances in diagnostic adjuncts for oral squamous cell carcinoma[J]. Open Pathology Journal, 2011,5(1):3-7.
[4] FUNK G F, KARNELL L H, ROBINSON R A, et al. Pre-sentation, treatment, and outcome of oral cavity cancer: a National Cancer Data Base report[J]. Head Neck, 2002,24(2):165-180.
[5] JESSRI M, DALLEY A J, FARAH C S. MutSα and MutLα immunoexpression analysis in diagnostic grading of oral epithelial dysplasia and squamous cell carcinoma[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2015,119(1):74-82.
[6] KALMAR J R. Advances in the detection and diagnosis of oral precancerous and cancerous lesions[J]. Oral Maxillofac Surg Clin North Am, 2006,18(4):465-482.
[7] DIXON R A, GANG D R, CHARLTON A J, et al. Applications of metabolomics in agriculture[J]. J Agric Food Chem, 2006,54(24):8984-8994.
[8] HERMAN C, CETINGUL M P. Quantitative visualization and detection of skin Cancer using dynamic thermal imaging[J]. J Vis Exp, 2011,51(51): e2679-e2679.
[9] NAVAZESH M. Methods for collecting saliva[J]. Ann N Y Acad Sci, 1993,694(1):72-77.
[10] SACCENTI E, HOEFSLOOT H J, SMILDE A K, et al. Reflections on univariate and multivariate analysis of metabolomics data[J]. Metabolomics, 2014,10(3):361-374.
[11] KOLDE R. Pheatmap: Pretty heatmaps [J]. R Package Version, 2012:61.
[12] BONNE N J, WONG D T. Salivary biomarker development using genomic, proteomic and metabolomic approaches[J]. Genome Med, 2012,4(10):82-85.
[13] TIZIANI S, LOPES V, GUNTHER U L. Early stage diagnosis of oral Cancer using 1H NMR-based metabolomics[J]. Neoplasia (New York, N.Y.), 2009,11(3):269-276.
[14] TABAK L A. A revolution in biomedical assessment: The development of salivary diagnostics[J]. J Dent Educ, 2001,65(12):1335-1339.
[15] FU Y M, YU Z X, FERRANS V J, et al. Tyrosine and phe-nylalanine restriction induces G0/G1cell cycle arrest in murine melanoma in vitro and in vivo[J]. Nutr Cancer, 1997,29(2):104-113.
[16] WANG Q H, GAO P, WANG X Y, et al. The early diagnosis and monitoring of squamous cell carcinoma via saliva metabolomics[J]. Sci Rep, 2014,4(4):6802-6809.

