食管原发性小细胞神经内分泌癌78例临床特点及预后分析
孙亚星,李建生,吕笑娟,李东颖,冯永星
郑州大学第一附属医院消化内科,河南 郑州 450052
神经内分泌癌是具有高度侵袭性的恶性肿瘤且临床表现多样化,在消化系统中,常见于小肠、阑尾和胰腺[1]。食管癌是中国最常见的恶性肿瘤之一,也是世界第四大癌症死亡原因[2]。最常见的组织类型是鳞状细胞癌和腺癌,原发性食管神经内分泌癌较为罕见。而小细胞癌是最常见的肺部恶性肿瘤,肺外小细胞癌非常少见,仅为2.5%~4.1%[3],食管原发性小细胞神经内分泌癌(esophageal primary small cell neuroendocrine carcinoma, ESCNC)是一种罕见的恶性肿瘤,占所有食管恶性肿瘤的0.5%~2.8%[4]。随着临床医师认识水平及诊断技术的提高,该病的发病率逐年升高[5]。但由于相关研究数据的不足,ESCNC的治疗策略尚未达成共识[6]。本研究通过对郑州大学第一附属医院收治的ESCNC患者的临床资料进行回顾性分析,为ESCNC的诊治及预后评估提供参考。
1 资料与方法
1.1一般资料收集2011年10月至2017年6月郑州大学第一附属医院收治的经病理证实的ESCNC患者78例的临床资料,男51例,女27例,男女比例为1.89∶1,年龄(64.7±8.9)岁(44~86岁)。本研究得到郑州大学第一附属医院伦理委员会的批准。
1.2纳入及排除标准纳入标准:参照2010年WHO神经内分泌肿瘤诊断标准[7]:HE染色下肿瘤的细胞形态特点符合ESCNC;Ki-67阳性指数>20%或核分裂像>20个/10高倍视野;结合免疫组织化学染色检测神经内分泌标志物,如突触素(synaptophysin, Syn)、嗜铬粒素A(chromogranin A, CgA)、CD56、神经元特异性烯醇化酶(neuron-specific enolase, NSE)等。排除标准:食管转移性神经内分泌癌,原发部位不明的神经内外分泌癌,临床资料不完整的ESCNC病例。
1.3方法对收集到的临床资料进行回顾性分析,包括病例的一般资料、食管钡餐造影、CT、胃镜、病理表现、治疗和随访情况。
1.4随访采用电话、复诊方式获得随访信息。随访截至2017年10月。总生存期为患者自病理学确诊至死亡日期或随访截止日期。
2 结果
2.1食管钡餐造影、CT检查结果本组患者食管钡餐造影主要表现为食管黏膜紊乱、增粗,管壁僵硬、不规则充盈缺损、龛影,病变部位管腔狭窄及病变以上扩张(见图1)。胸部CT表现为食管增厚,软组织密度影突向管腔,管腔狭窄。增强后病变部位不均匀强化或强化不明显(见图2)。

图1 ESCNC食管钡餐表现Fig 1 The barium esophagography manifestation of ESCNC

图2 ESCNC的CT表现Fig 2 The CT presentation of ESCNC
2.2胃镜检查结果本组患者胃镜下主要表现为不规则隆起,溃疡,息肉、不平结节,黏膜粗糙(见图3)。病变部位以食管中、下段为主。

图3 ESCNC的内镜下表现Fig 3 The endoscopy presentation of ESCNC
2.3免疫组化及肿瘤分期78例手术或活检标本行免疫组化染色阳性率分别为:Syn 94.9%、CgA 45.8%、CD56 91.0%、NSE 80.0%(见表1)。
本组78例患者中,局限期53例,广泛期25例。45例(57.7%)发生淋巴结转移。首诊25例(32.1%)发生远处转移,其中肝脏转移15例、肺部转移6例、颈部或锁骨上窝淋巴结转移5例、腹膜后淋巴结转移1例、骨转移2例、脑转移1例。

表1 ESCNC患者的临床病理表现Tab 1 Clinical and pathological features of ESCNC patients
2.4治疗方法局限期患者中综合治疗35例,其中手术联合化疗29例(54.7%),手术联合放化疗6例(11.3%)。单一治疗18例,其中手术9例(17.0%),化疗7例(13.2%),放疗2例(3.8%)。组内53例患者接受化疗,依托泊苷联合顺铂是最常用的方案。
2.5随访结果本组患者随访时间为6~64个月,至随访截止,78例患者中,7例失访,17例存活,54例死亡。中位生存时间12个月。1年、3年、5年生存率分别为55.70%、23.87%和13.82%(见图4)。不同临床特征患者的中位生存时间如表2所示。局限期患者中位生存时间为14个月,广泛期患者为7个月,差异有统计学意义(P<0.05)。局限期患者行单一治疗的中位生存时间是9个月,综合治疗的中位生存时间是17个月,差异有统计学意义(P<0.05,见图5~6)。
3 讨论
食管癌是进展迅速的恶性肿瘤类型之一。ESCNC是一种罕见的恶性肿瘤,占所有食管恶性肿瘤的0.5%~2.8%。近年来,ESCNC越来越受到人们的关注,相关报道逐年增多。ESCNC的流行病学表现与其他食管恶性肿瘤相似。结果显示,ESCNC好发于中老年人,男性多于女性,且病变主要发生在中下段食管。肉眼可见的隆起和溃疡型肿瘤类型相对较常见。这些结果与之前报道[3,8]相似。
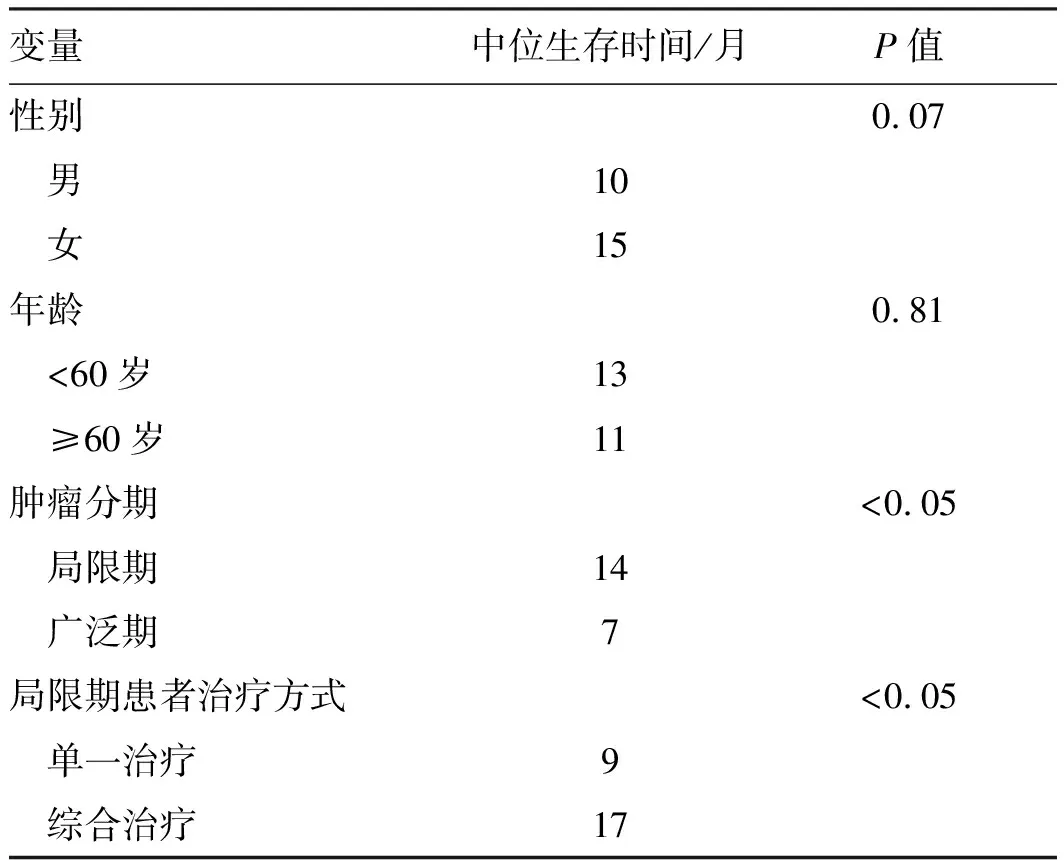
表2 ESCNC患者生存分析Tab 2 Survival analysis of ESCNC patients

图4 ESCNC患者生存曲线;Fig 4 Survival curves of patients with ESCNC;

图5 局限期与广泛期患者生存曲线;Fig 5 Survival curves depending on localized stage versus extended stage ESC-NC;

图6 局限期患者中单一治疗与综合治疗生存曲线Fig 6 Survival curves depending on single treatment versus comprehensive treatment
ESCNC的食管钡餐造影及CT表现较食管其他类型恶性肿瘤无特异。但食管钡餐造影有助于术前辅助病变范围的判断。而CT对于了解病变及与周围组织的关系、转移情况有重要意义,且可辅助排除原发性支气管和肺小细胞癌。食管钡餐造影及CT作为非侵入性无创检查,易被患者接受,对于辅助诊断有一定的意义。以生长抑素受体显像为主的放射性核素扫描对于神经内分泌肿瘤的诊断、随访有一定的价值,但ESCNC相关报道较少,有待进一步研究。
胃镜是确诊ESCNC的重要辅助检查。胃镜下ESCNC的表现与常见食管癌类似,主要为不规则隆起(32/78),溃疡(21/78),息肉、不平结节(23/78)。胃镜下活检是术前诊断常用的方法。但常规活检诊断的准确率较低,多点活检及结合免疫组化检查对最终明确诊断尤为重要。BEASLEY[9]报道,免疫组化标志物如Syn、CgA、NSE、CK、CD56的IHC评估在诊断神经内分泌癌是有帮助的。本研究中,Syn、CgA、CD56、NSE的阳性率分别为94.9%、45.8%、91.0%、80.0%,与既往报道[10-11]相符。临床中联合检测多种免疫组化标记物有助于提高ESCNC的诊断率。
ESCNC具有高度侵袭性,淋巴结及远处转移发生早。之前的一项研究[12]显示,65.1%(84/129)的患者发生淋巴结转移。ZHU等[3]报道的64例食管小细胞癌淋巴结转移率为79.0%。在本研究中,57.7%的患者发生淋巴结转移,32.1%的患者发生远处转移。
现阶段对于ESCNC尚无相应的分期系统,临床中常根据美国退伍军人医院肺癌研究组(veteran’s administration lung study group, VALSG)分期系统将ESCNC分为局限期和广泛期[8]。局限期ESCNC指肿瘤局限在食管及其临近组织,可存在或不存在区域淋巴结转移。而广泛期则为肿瘤超出上述范围。本研究显示,局限期患者生存时间明显优于广泛期患者,中位生存时间分别为14个月、7个月,差异有统计学意义(P<0.05),与既往报道[11]相符。提示早期诊治对于改善ESCNC的预后有重要价值。
由于ESCNC是较为少见的恶性肿瘤,支持这些治疗策略的证据仅限于小型回顾性研究。外科根治性手术是治愈局限期食管癌的唯一方式,但对于食管小细胞癌,既往研究[13]表明,化疗应是主要治疗方法。因此,现阶段ESCNC的最佳和标准治疗尚未确立。
本研究显示,综合治疗较单一治疗能显著提高患者的生存时间,差异有统计学意义。DENG等[14]的研究认为,综合治疗可显著延长患者的存活时间,由于样本量较小,在他们的多因素分析中,综合治疗不是独立危险因素。ZOU等[15]的研究结果显示,综合治疗可改善患者总生存期,单一手术、化疗不能改善患者生存。李静如等[16]报道,早期手术及放射治疗联合化疗的患者预后较好,而单纯放疗或化疗的患者预后较差。
目前的研究有一些局限性,首先,本研究是一个回顾性研究,失访率较高(9.0%),可能不可避免地影响我们的结果;其次,没有获取足够的神经内分泌癌的免疫组化数据,因此我们主要关注患者的临床特征。
综上所述,ESCNC是一种罕见且具侵袭性的恶性肿瘤,确诊依赖于组织病理学及免疫组织化学检查。肿瘤分期及治疗方式的选择对患者的生存期有较大影响,综合治疗可使患者有更大生存获益。但仍需大规模的前瞻性研究确定最佳的治疗方案。
[1] RAMAGE J K, AHMED A, ARDILL J, et al. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs) [J]. Gut, 2012, 61(1): 6-32. DOI: 10.1136/gutjnl-2011-300831.
[2] LAN L, ZHAO F, CAI Y, et al. Epidemiological analysis on mortality of cancer in China, 2015 [J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2018, 39(1): 32-34. DOI: 10.3760/cma.j.issn.0254-6450.2018.01.006.
[3] ZHU Y, QIU B, LIU H, et al. Primary small cell carcinoma of the esophagus: review of 64 cases from a single institution [J]. Dis Esophagus, 2014, 27(2): 152-158. DOI: 10.1111/dote.12069.
[4] MEDGYESY C D, WOLFF R A, PUTNAM J B, et al. Small cell carcinoma of the esophagus: the University of Texas M. D. Anderson Cancer Center experience and literature review[J]. Cancer, 2000, 88(2): 262-267
[5] LEE C G, LIM Y J, PARK S J, et al. The clinical features and treatment modality of esophageal neuroendocrine tumors: a multicenter study in Korea [J]. BMC Cancer, 2014, 14: 569. DOI: 10.1186/1471-2407-14-569.
[6] CHATNI S S, RAVINDRAN H K, NARAYANAN A, et al. Small cell carcinoma of the esophagus [J]. Saudi J Gastroenterol, 2008, 14(3): 149-150. DOI: 10.4103/1319-3767.41738.
[7] BOSMAN F T, CARNEIRO F, HRUBAN R H, et al. WHO classification of tumours of the digestive system [M]. Lyon: IARC Press, 2010.
[8] WANG S Y, MAO W M, DU X H, et al. The 2002 AJCC TNM classification is a better predictor of primary small cell esophageal carcinoma outcome than the VALSG staging system [J]. Chin J Cancer, 2013, 32(6): 342-352. DOI: 10.5732/cjc.012.10161.
[9] BEASLEY M B. Immunohistochemistry of pulmonary and pleural neoplasia [J]. Arch Pathol Lab Med, 2008, 132(7): 1062-1072. DOI: 10.1043/1543-2165(2008)132[1062:IOPAPN]2.0.CO;2.
[10] HUANG Q, WU H, NIE L, et al. Primary high-grade neuroendocrine carcinoma of the esophagus: a clinicopathologic and immunohistochemical study of 42 resection cases [J]. Am J Surg Pathol, 2013, 37(4): 467-483. DOI: 10.1097/PAS.0b013e31826d2639.
[11] EGASHIRA A, MORITA M, KUMAGAI R, et al. Neuroendocrine carcinoma of the esophagus: Clinicopathological and immunohistochemical features of 14 cases [J]. PLoS One, 2017, 12(3): e0173501. DOI: 10.1371/journal.pone.0173501.
[12] LU X J, LUO J D, LING Y, et al. Management of small cell carcinoma of esophagus in China[J]. J Gastrointest Surg, 2013, 17(7): 1181-1187. DOI: 10.1007/s11605-013-2204-7.
[13] YAMASHITA H, NAKAGAWA K, ASARI T, et al. Concurrent chemoradiation alone with curative intent for limited-disease small-cell esophageal cancer in nine Japanese patients [J]. Dis Esophagus, 2009, 22(2): 113-118. DOI: 10.1111/j.1442-2050.2008.00863.x.
[14] DENG H Y, NI P Z, WANG Y C, et al. Neuroendocrine carcinoma of the esophagus: clinical characteristics and prognostic evaluation of 49 cases with surgical resection [J]. J Thorac Dis, 2016, 8(6): 1250-1256. DOI: 10.21037/jtd.2016.04.21.
[15] ZOU B, LI T, ZHOU Q, et al. Adjuvant therapeutic modalities in primary small cell carcinoma of esophagus patients: a retrospective cohort study of multicenter clinical outcomes [J]. Medicine (Baltimore), 2016, 95(17): e3507. DOI: 10.1097/MD.0000000000003507.
[16] 李静如, 唐英, 仇学明, 等. 食管原发性小细胞神经内分泌癌的临床分析:9例报道[J]. 胃肠病学和肝病学杂志, 2017, 26(12): 1335-1336. DOI: 10.3969/j.issn.1006-5709.2017.12.004.
LI J R, TANG Y, QIU X M, et al. Clinical analysis of esophageal primary small cell neuroendocrine carcinoma: nine cases report [J]. Chin J Gastroenterol Hepatol, 2017, 26(12): 1335-1336. DOI: 10.3969/j.issn.1006-5709.2017.12.004.

