克罗恩病治疗的新理念
巫协宁,吴坚炯
上海市第一人民医院消化科,上海 200080
克罗恩病(Crohn’s disease, CD)是一复杂的自身免疫性疾病,有自身免疫加慢性炎症的内涵,针对其发病机制、病理生理及其病理变化进行多环节、多靶点多管齐下的中西医结合治疗是我们的治疗策略。三联疗法中泼尼松、硫唑嘌呤和中药CD方能起到相辅相成的协同作用,其中抑制自身免疫、调节免疫,纠正Th17/Treg与Th1/Treg的失衡、抑制炎症和饮食调整是治本;抑制氧化应激、氧自由基和脂质过氧化,抑制血管新生、血管通透性、渗血以及抗肠壁纤维化等作用是治标,CD的全程治疗是治本与治标相结合。
1 概述
三联疗法中,泼尼松的初始剂量为30 mg/d,分2次服用,60岁以上患者减为20 mg/d同样有效,硫唑嘌呤50 mg/d加中药CD方是始自2000年,2016年起方内加入青蒿,小剂量泼尼松长服的三联疗法已17年。服用方法:一般是三联治疗3或4个月后复查肠镜,肠镜缓解后的6~12个月间每2个月减2.5 mg/d直至10 mg/d,服用1~2年,再复查肠镜,待病变静止后以5 mg/d维持1~2年再单服硫唑嘌呤50 mg/d或联合小剂量激素5 mg/d长期、终生服用,泼尼松的减量主要根据肠镜下的改变。已有9例完全缓解,61例临床缓解伴黏膜愈合(2000-2014年),作饮食调整后又有6例完全缓解,11例临床缓解伴黏膜愈合(2016年至今),达到这一要求的时间比前述的9例短。症状减失多在三联治疗2~4周时,部分病例在几天内脐周腹痛、长期腹泻、便血即行消失,有成形便,食欲、体质量增加,不影响正常生活及工作,患者的生活质量提高,无一发生忧郁。三联疗法的作用与作用机制如表1所示,中药CD方药味与作用如表2所示。

表1 三联疗法的作用与作用机制Tab 1 The role and mechanism of triple therapy

表2 中药CD方中的药味与作用Tab 2 Constituents and function of CD prescription of traditional Chinese medicine
注:禁用黄芪;该处方是根据CD的发病机制结合中药的药理作用构建而成。
2 CD治疗的治本与治标
CD是由与自身免疫相关的Th17和Th1细胞共同启动的,而Th17/Treg和Th1/Treg反应失衡是CD发病机制中的核心环节,Th17细胞主要参与和促进自身免疫的发生与发展,同时又分泌了许多促炎细胞因子,包括IL-17A、IL-17F、TNF-α、INF-γ、IL-1β、IL-6、IL-8、IL-21、IL-22、IL-26、GM-CSF、IL-10,还有趋化因子CCL20,黏附分子ICAM-1、VCAM-1等诱导并放大炎症反应;还有,Th1细胞分泌IFN-γ、TNF-α及IL-2,产生炎症和肠黏膜损伤[1]。肠黏膜免疫系统原本对肠腔内食物抗原与细菌抗原处于耐受状态,当炎症导致肠黏膜稳态发生崩解时可以激活免疫活性与免疫反应。Treg为调节性T细胞,具有Foxp3+转录因子的Treg细胞能抑制Th17和Th1细胞,Treg细胞能维持肠道免疫耐受和纠正Th17/Treg失衡,是CD核心环节中的核心因素。在活动期CD,患者外周血[2]与肠黏膜[3]的Th17和Th1细胞的比率有显著升高和Treg细胞减少,不活动期情况则相反。泼尼松与硫唑嘌呤可增加Treg细胞使Treg/Th17和Treg/Th1比率增高,疾病由此趋向于稳定甚至趋于缓解,肠黏膜多发性溃疡消失或结疤。小剂量泼尼松与硫唑嘌呤加中药CD方长期服用能维持对Th17及Th1免疫反应的抑制,阻断自身免疫从而减轻肠黏膜炎症反应。素食能通过产生短链脂肪酸(SCFAs)及其产生的丁酸、乙酸、丙酸增加Treg数量与功能。一些肠道有益的共栖菌如梭菌Ⅳ及ⅩⅣ菌群有诱导Foxp3+Treg细胞的作用,脆弱类杆菌也能诱导产生Treg细胞。鉴于Th17、Th1和Treg免疫反应贯穿了CD的全过程,三联治疗使Th17转向Treg反应占优势,Th1转向Treg反应占优势,长期的Treg反应占优势可能是保持长期缓解的原因[4]。
此外,饮食调整是指增加蔬菜水果配以适量鱼和瘦肉,限制脂食与甜品饮料,增加多种维生素与微量元素,禁烟和酒。蔬菜水果有抗炎作用,是维持肠上皮完整与肠道稳态的重要物质。三高一少类似西方饮食,在中国是以高动物蛋白较高脂质和甜品饮料为主,西方人群采用高脂食、红肉、高糖饮料、牛乳、含黄油的面包、蛋糕、饼干,内中的饱和脂肪酸与不饱和脂肪酸可作用于免疫细胞增加促炎细胞,加工食品中盐分浓度高可上调Th1及Th17细胞影响肠道免疫与炎症。还有红肉等肉食过多会增加有害的肠杆菌和类杆菌,包括侵袭、粘附、毒力强的大肠杆菌,减少有益共栖菌,促进Treg细胞与反应增加的药物与食物如表3所示。
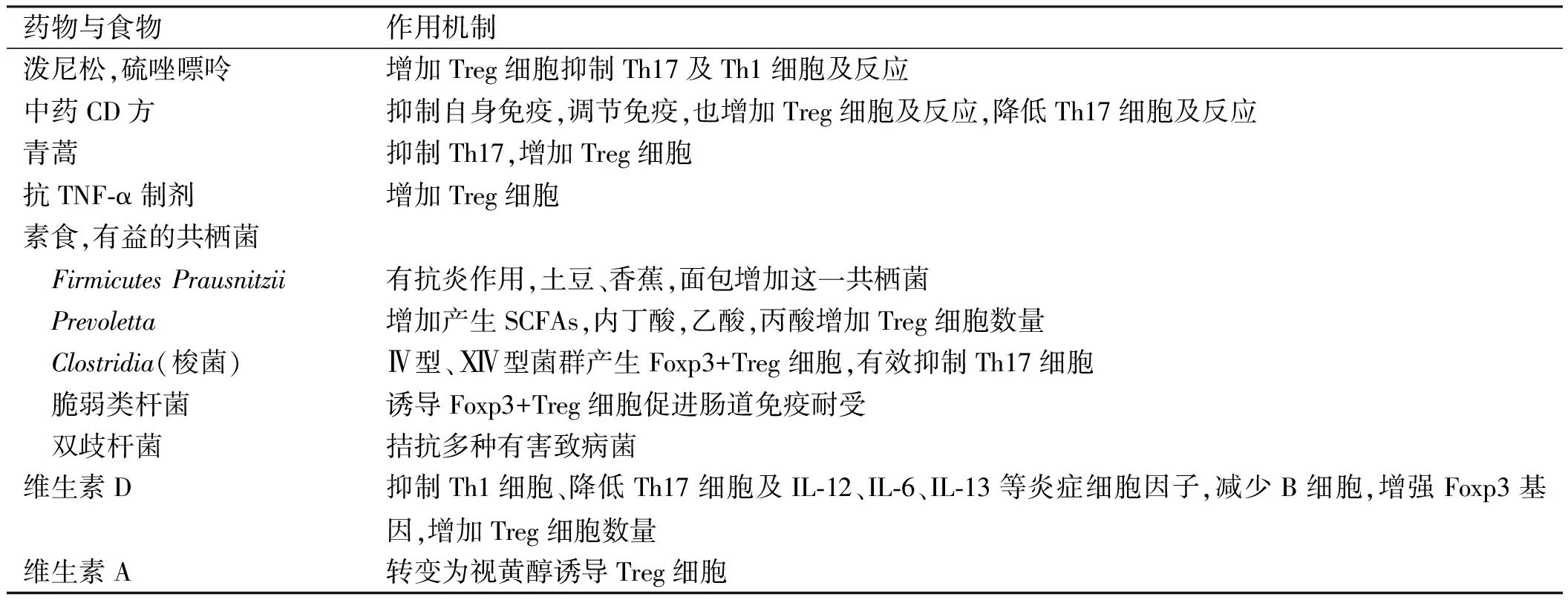
表3 促进Treg细胞与反应的药物与食物Tab 3 Drugs and foods that promote Treg cells and response
注:因泼尼松尿钙排出增加,TNF-α也增加尿钙排出,故中年以后的CD患者均加服钙尔奇及维生素D3。
3 CD的发病机制和药物、食物治疗的作用靶点
CD发病机制中的6个组分的衔接[5]与整合如图1所示:
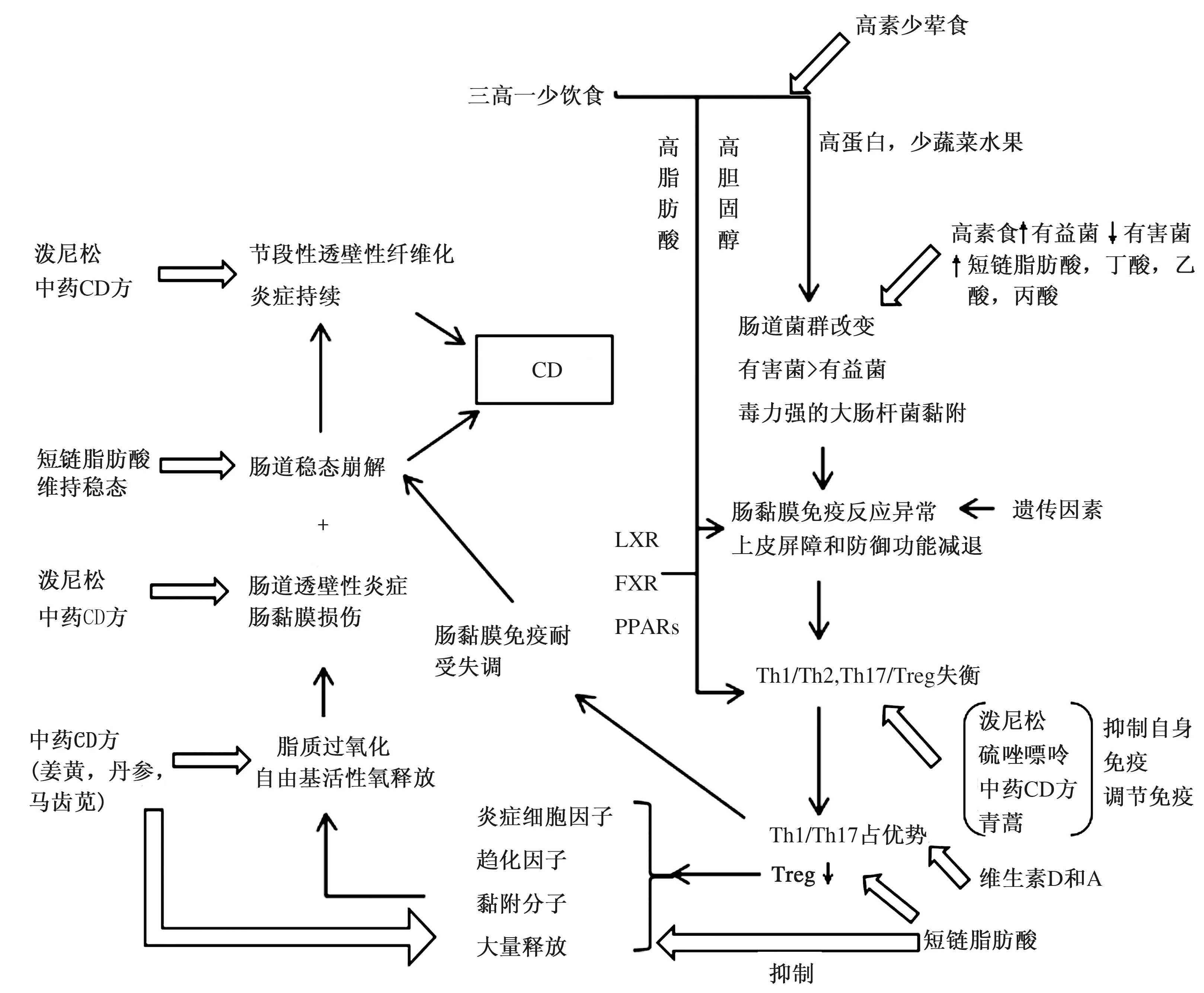
图1 CD发病机制和药物、食物治疗的作用靶点Fig 1 CD pathogenesis and drug, food therapy targeting points注:Th:辅助性T细胞;Treg:调节性T细胞;LXR:肝细胞X受体;FXR:法尼醇X受体;PPARs:过氧化物酶体增殖物激活受体;治疗:总的治疗是针对CD的发病机制、病理生理和一些病理变化。
(1)三高一少饮食可影响肠道菌群的组分,肉食过多引起肠杆菌、类杆菌及毒力强的大肠杆菌等有害菌增多,素食患者这些有害菌少而一些有益菌增多。饮食也影响免疫,维生素A和D能诱导与增加抑制Th1及Th17细胞的Treg细胞活性,抑制自身免疫与炎症。
与SCFA结合的蛋白偶联受体感知器(GRP)有调节Treg细胞数量的作用;一种芳香烃受体AhR能调节多种调控免疫与炎症的基因。来自花椰素、甘蓝、卷心菜的AhR配体能激活AhR。色氨酸存在于多种蔬菜也有抗炎作用,能促进Treg细胞和免疫耐受。
(2)肠道菌群组分的改变也可影响免疫干扰耐受,有些共栖菌能增加Th17细胞,有些则能限制Th17细胞的过度扩张。
(3)肠道菌群可导致肠黏膜免疫反应异常和上皮屏障功能减退。初始免疫中的巨噬细胞分泌TNF-α及ROS(活性氧),中性粒细胞产生氧爆发释出氧自由基,树突状细胞提呈抗原释放出炎症细胞因子,NK细胞分泌穿孔素及颗粒酶,NKT细胞改变紧密连接增加通透性。过继免疫中CD4+T细胞在抗原及细胞因子的作用下分泌为Th1、Th2、Th17和Treg细胞,Th17细胞参与和促进自身免疫的发生与发展,Treg细胞抑制自身免疫维持自身耐受。上皮屏障功能因分泌抗菌肽、防御素的潘氏细胞减少、IgA分泌不足以及自噬作用受损而减退。
(4)Th17/Treg和Th1/Treg失衡见前述。检测Th细胞的转录因子和相关的细胞因子可以反映Th细胞的类型(见表4)。
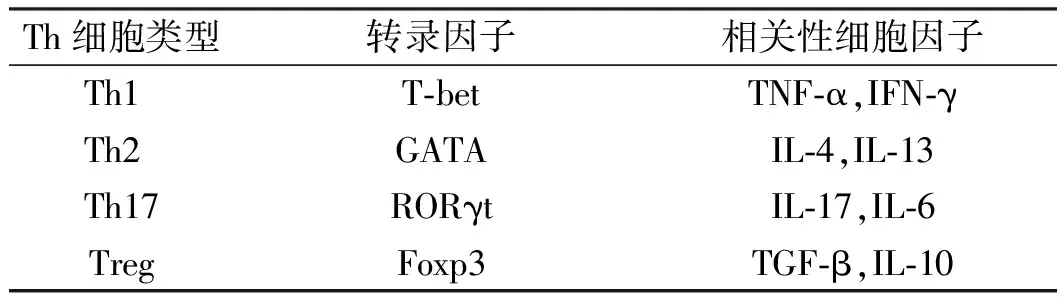
表4 Th细胞类型的转录因子与相关性细胞因子Tab 4 Transcription factor and associated cytokine of each Th cell type
(5)炎症细胞因子、生长因子和自由基的作用,产生多种肠道病变,包括:肠黏膜充血水肿、糜烂、多发性溃疡、纵行溃疡;铺路石黏膜、黏膜桥;微穿孔形成瘘管;VEGF导致肠系膜动脉增粗、扭曲,小血管增多,有木梳征;假性息肉;炎症纤维性狭窄;肠段透壁性增厚,肠壁僵硬,僵直;回盲瓣病变:充血、糜烂、溃疡、疤痕、变形。
(6)遗传对中国CD患者的影响很小,我们门诊所见300余例仅父子、母子各一对患CD;全基因组基因联合研究(GWAS)仅26%可解释CD的遗传;遗传风险只能解释30%的CD,而70%为环境因素[6];此外认为与CD的系列肠管病变有关的基因如NOD2、ATG16L1、IRGM自噬基因在中国、日本、韩国CD患者中未被发现,且这仅仅是见于有欧洲血统的白种人[7]。
4 国外CD治疗现状
美国学者有关CD的治疗屡屡失败的原因何在?至今仍没有1例获得完全缓解,而临床缓解伴黏膜愈合观察最长时间也仅70周,没有我们5年、8年、10年长期缓解的病例。其原因包括:
(1)对CD的自身免疫本质缺乏认识,没有治本与治标相结合的理念和思维。
(2)没有抑制Th17和Th1细胞反应和促进Treg细胞反应,包括有明显疗效的糖皮质激素的治疗研究和药物。
(3)没有衔接CD多个环节并加以整合的CD发病机制以及针对这些环节进行多靶点、多管齐下的药物治疗。
(4)英夫利昔(Infliximab,IFX)也能增加Treg细胞[8],活动期CD、外周血及肠黏膜Treg细胞凋亡增加,IFX治疗Treg细胞增多,而凋亡减少。1次注射Foxp3+Treg细胞增多,治疗10周有显著增加。它只能抗TNF-α而对其余众多促炎细胞因子无遏止作用,以致于炎症继续进展;或因产生IFX的自身抗体导致IFX失效。一种单克隆抗体治疗只是一治标措施,更换另一种单克隆抗体仅作用于细胞间的黏附因子(抗整合素),作用更小,自然会导致治疗的失败。
(5)国外很多基础研究很少和临床相结合,而临床治疗又未能联系相关的基础理论,研究者和治疗者互不沟通。
5 怀孕问题的处理
男性CD不影响婴儿的健康,因为妻子身体健康,这已有3例。女性CD患者宜在活动期积极治疗,使达到不活动状态,然后停止三联疗法争取受孕,可分娩健康婴儿,这已有5例,分娩后复发的母亲再行三联治疗仍有效。这也是一个创新。
6 创新点和建议
6.1创新点(1)将引起CD的多个环节进行衔接与整合形成一理念[5],为国内外所仅有,是一理论上的创新。(2)确认三高一少饮食为中国CD患者的重要病因[9],饮食调整联合三联疗法可缩短取得完全缓解的时间,恢复三高一少饮食立时导致疾病的复燃或复发;我们在国内首次提出了饮食调整。(3)针对其发病机制、病理生理及一些病理变化,抑制自身免疫,调节免疫,结合抑制炎症形成有效的治疗方案是决策上的创新[4]。
6.2建议(1)CD的有效治疗方案是治本与治标相结合,三联疗法的中西医结合治疗值得大家采用,可以增进疗效和提高患者的生活质量。(2)研究Th1、Th2、Th17和Treg细胞和免疫反应及其转录因子与相关性细胞因子可能有助于阐明溃疡性结肠炎的发病机制和正确治疗的探究。
[1] 巫协宁. 辅助性T细胞1,辅助性T细胞17和调节性T细胞及其相关细胞因子在克罗恩病发病机制中的作用[J]. 中华消化杂志, 2016, 36(7): 497-499.DOI: 10.3760/cma.j.issn.0254-1432.2016.07.019.
[2] CHAO K, ZHANG S, YAO J, et al. Imbalances of CD4(+) T-cell subgroups in Crohn’s disease and their relationship with disease activity and prognosis [J]. J Gastroenterol Hepatol, 2014, 29(10): 1808-1814. DOI: 10.1111/jgh.12592.
[3] ZHAO C, BAO C H, LI J, et al. Moxibustion and acupuncture ameliorate Crohn’s disease by regulating the balance between Th17 and Treg cells in the intestinal mucosa [J]. Evi Based Complement Alternat Med, 2015, 2015: 938054. DOI: 10.1155/2015/938054.
[4] 巫协宁. 克罗恩病的治疗策略和机制[J]. 国际消化病杂志, 2017, 37(5): 306-310. DOI: 10.3969/j.issn.1673-534X.2017.05.011.
[5] 巫协宁. 克罗恩病发病机制的初步探索[J]. 国际消化病杂志, 2017, 37(3): 135-139. DOI: 10.3969/j.issn.1673-534X.2017.03.001.
[6] 巫协宁. 克罗恩病发病机制中的重要因素:种族还是遗传?[J]. 国际消化病杂志, 2017, 37(2): 71-72. DOI: 10.3969/j.issn.1673-534X.2017.02.001.
[7] BRAND S. Crohn’s disease: Th1, Th17 or both? The change of a paradigm: new immunological and genetic insights implicate Th17 cells in the pathogenesis of Crohn’s disease [J]. Gut, 2009, 58(8): 1152-1167. DOI: 10.1136/gut.2008.163667.
[8] GUIDI L, FELICE C, PROCOLI A, et al. Foxp3+Treg regulatory cell modifications in inflammatory bowel disease patients treated with anti-TNFα agents [J]. Biomed Res Int, 2013, 2013: 286368. DOI: 10.1155/2013/286368.
[9] 巫协宁. 饮食、肠道菌群、免疫等因素在克罗恩病发病机制中的作用[J]. 国际消化病杂志, 2016, 36(6): 325-328. DOI: 10.3969/j.issn.1673-534X.2016.06.001.

