白细胞介素-6在溃疡性结肠炎模型小鼠Th17/Treg细胞失衡中的作用
庞艳华,吴东方,马亚会,解有福,郝建宇,刘 振,李 宁,刘心娟
1.首都医科大学附属北京朝阳医院消化内科,北京 100020;2.北京市海淀区妇幼保健院内科
溃疡性结肠炎(ulcerative colitis, UC)的发病率呈逐年上升趋势,发病机制尚不明确,目前认为,具有遗传倾向的个体发生了不适当的黏膜免疫反应是其主要发病机制[1]。最近研究[2]发现,Th17和CD4+T细胞亚群形成一个新的免疫轴,与UC的发生、发展密切相关。Th17是炎症性肠病的重要细胞因子,能产生IL-17A等前炎症因子,促进局部组织损伤。调节性T细胞(Treg)是CD4+T细胞的一个亚群,属于免疫抑制细胞,在UC的发病中起重要作用。Th17和Treg无论是在分化上还是功能上都是此消彼长的关系。研究[3]发现,UC中存在着Th17与Treg细胞的失衡,我们的研究[4]进一步证实,UC时Treg细胞分化及功能的异常突出表现在结肠固有层局部。IL-6在Th17细胞的分化中发挥着至关重要的作用,IL-6和TGFβ可共同诱导原始T细胞分化为Th17细胞[5]。因此,我们进一步关注IL-6在UC小鼠结肠固有层局部Treg/Th17失衡中的作用。本研究以DSS诱导的UC模型小鼠作为研究对象,检测结肠固有层Treg细胞和Th17细胞及其相关细胞因子的水平,及IL-6在外周血及不同组织中的表达,探讨IL-6在UC小鼠结肠固有层Th17/Treg失衡中的作用。
1 材料和方法
1.1动物模型的建立6~8周龄实验动物选用SPF级雄性C57BL/6小鼠10只,购自北京维通利华实验动物技术有限公司,体质量18~20 g,每日给予标准饲养、自由饮水及日常光照。将C57BL/6雄性小鼠完全随机分成实验组(UC组,5只)和对照组(NC组,5只)。UC组应用质量浓度为25 g/L的DSS溶液作为饮用水7 d,继之饮用蒸馏水7 d;对照组饮用蒸馏水14 d,造模为期14 d,14 d后脱颈处死小鼠。按照Murthy评分系统,评估UC组小鼠活动度指数(disease activity index, DAI),结肠组织病理学表现证实并评估UC,证实造模成功。
1.2主要试剂葡聚糖硫酸钠 (DSS) (MP Biomedical),流式抗体及相关试剂CD4-PerCP (BD PharmingenTM)、CD25-APC(BD PharmingenTM)、CD45RA-PE(BD PharmingenTM)、IL-17-Alexa Fluor®488(BD PharmingenTM)、FoxP3-PE-Cyanine7(eBioscience)、CD3e-PE-CF594(BD HorizonTM)、CD8a-BV510(BD HorizonTM),fixation and permeabilization (eBioscience),Human Th1/Th2/Th9/Th17/Th22 13plex Kit (BD PharmingenTM)。
1.3Treg及Th17细胞的检测提取小鼠结肠固有层黏膜单个核细胞在24孔培养皿中加入2 μl白细胞混合刺激剂/106个细胞,放置体积分数为5%的CO2,37 ℃恒温箱培养5 h,室温避光孵育CD4、CD25、CD45RA抗体15 min;按照操作手册细胞破膜后避光孵育FoxP3、IL-17抗体20 min,应用Beckman流式细胞仪分析Treg细胞及Th17细胞水平。
1.4细胞因子的检测按照操作说明,应用小鼠Th1/Th2/Th9/Th17/Th22细胞因子试剂盒,分别用荧光抗体标记外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜、脾脏单个核细胞培养上清液,利用FACSCanto Ⅱ流式细胞仪(美国BD公司)检测细胞因子的水平。
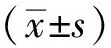
2 结果
2.1结肠固有层黏膜Treg细胞及其细胞因子的表达UC组结肠固有层黏膜Treg细胞水平高于NC组[(14.240±1.693)%vs(4.786±0.4709)%,P=0.0007];但UC组结肠固有层黏膜单核细胞培养上清中IL-10的水平低于NC组[(2.758±0.5339)pg/mlvs(4.383±0.07667)pg/ml,P=0.049]。
2.2结肠固有层黏膜Th17细胞及其相关细胞因子的表达UC组结肠固有层黏膜中Th17细胞的水平高于NC组[(4.700±0.2477)%vs(2.806±0.2150)%,P=0.0004];同时,UC组结肠固有层单核细胞培养液中IL-17A的水平也高于NC组[(3.032±0.3099)pg/mlvs(2.150±0.2161)pg/ml,P=0.047]。
2.3UC小鼠不同组织中IL-6的表达水平UC小鼠血清和结肠固有层单个核细胞培养上清液中IL-6水平分别高于回肠、外周血、脾脏、肠系膜淋巴结(与血清比较:P=0.0071、0.0003,P=0.0003、0.0003;与结肠比较:P=0.0014、<0.0001,P<0.0001、<0.0001);血清培养上清液中IL-6水平高于结肠(P=0.0145);回肠单个核细胞培养上清液中IL-6水平高于外周血、脾脏、肠系膜淋巴结(P=0.0435、0.0331、0.0223),外周血、脾脏、肠系膜淋巴结单个核细胞培养上清液中IL-6水平比较,差异无统计学意义(P>0.05)(见表1)。

表1 两组小鼠不同组织单个核细胞上清培养液中IL-6水平的比较Tab 1 The expression of IL-6 in different tissues of each group pg/ml
注:与NC组比较,aP<0.05。
3 讨论
UC是免疫介导的肠道炎症性疾病,存在多种发病机制[6],免疫学因素与UC的发生最为密切,而CD4+T细胞亚群在免疫调节方面尤为重要[7]。祝斌等[8]研究发现,UC模型小鼠中结肠黏膜和外周血Treg细胞升高。公认地,无论是Treg细胞还是Th17细胞的分化,TGFβ都是必需的细胞因子。Naïve T细胞在TGFβ和IL-2的作用下可以分化为Treg细胞[9-10],在TGFβ和IL-6的作用下可以分化为Th17细胞[11]。我们前期研究[4]发现,UC模型小鼠结肠固有层单核细胞中Treg水平高于其他组织,但FoxP3 mRNA表达下降,IL-10水平降低,提示UC发病时虽然结肠局部Treg细胞的比例升高,但其免疫抑制功能存在缺陷。Th17细胞属于炎症反应性细胞,特征性分泌IL-17A、IL-17F等促炎症细胞因子对抗外来病原菌或异物[12],此外,Th17细胞在IL-23促炎症因子的协同下可以引起肠道黏膜和肠道益生菌群的破坏[13]。研究[14-15]发现,在UC肠道黏膜中,Th17细胞数量明显升高,且Th17细胞浸润水平与肠道炎症反应呈正相关。也有文献[16]报道,UC外周血Th17细胞数量增多。由此可见,Th17细胞参与UC的发病。在本研究中,我们发现,UC模型小鼠结肠固有层黏膜中Treg细胞及Th17细胞比例同时升高,同时伴有Treg细胞功能受限,提示UC模型鼠结肠中,不仅存在免疫抑制功能的不足,同时存在过度的炎症反应,在UC中存在Th17和Treg细胞的免疫失衡。这与YANG等[17]研究一致。
UC主要累及肠道,而其他风湿免疫性疾病,如狼疮、类风湿性关节炎等,往往累及多个系统共同发病[18]。我们通过UC模型小鼠实验的研究,同时观察外周淋巴器官和中枢淋巴器官,发现IL-6在UC组结肠固有层黏膜的表达高于NC组,而在外周血、肠系膜淋巴结、回肠固有层黏膜及脾脏表达与NC组差异无统计学意义。说明IL-6参与了UC的发病,且在结肠黏膜局部发挥免疫作用。这种免疫紊乱在肠黏膜最显著,也与UC多累及局部肠管,很少累及其他系统的临床特点相一致。
IL-6是一个在许多免疫系统反应中起重要作用的多效性细胞因子,包括活化B细胞的生长和最终分化、刺激T细胞增殖及细胞毒性T细胞的分化。炎症性肠病患者IL-6主要来源于活化的单核和巨噬细胞,IL-6是UC中参与调节炎症强有力的细胞因子[19-20]。IL-6在Th17的应答和抑制Treg功能两方面都起关键作用。Treg能分泌IL-10、IL-35、TGFβ等细胞因子,通过细胞与细胞接触的方式影响效应T细胞的增殖及炎性细胞因子的释放,调节免疫系统,维持对自身抗原的免疫耐受和防止自身免疫性疾病的发生[21]。Treg细胞的异常参与了多种自身免疫性疾病和炎症性疾病的发病,如1型糖尿病、多发性硬化症、系统性红斑狼疮、类风湿关节炎及炎症性肠病等。UC患者肠上皮屏障破坏、持续性的肠腔抗原刺激使巨噬细胞和树突状细胞分泌大量促炎症因子IL-6和IL-12等,促进Th1和Th17细胞系的分化,抑制Treg的功能。Treg细胞功能缺陷与UC发病有关,提示UC炎性反应亢进,而免疫抑制不足[22]。TGFβ可诱导初始T细胞产生Treg,Treg活化在IL-6存在时可导致TGFβ产生。之后,IL-6和TGFβ诱导Treg向Th17亚群分化,产生IL-17。而当IL-6过度表达时,在这个复杂的网络关系作用下Treg细胞与Th17细胞间出现分化及功能的失衡。此外,已有研究[23]显示,阻止IL-6可能控制Th17介导的免疫反应。
UC为炎症性肠病的一种常见类型,主要病理表现为结肠黏膜炎症。国内学者在多发性硬化鼠模型中发现IL-6升高[24]。本研究也发现,除了结肠固有层局部IL-6水平升高外,UC小鼠血清中IL-6水平也高于对照组。国外POWELL等[25]研究认为,在UC患者症状出现前可有IL-6等血清学异常。IL-6信号系统在肠黏膜免疫稳态和IBD发病机制中起作用,但在IBD症状前监测IL-6是否足够特异还无定论。本研究发现,UC模型小鼠存在IL-6升高,特别是在结肠固有层黏膜,这种UC结肠黏膜IL-6的表达异常可能是引起UC患者结肠黏膜病变的免疫基础,其机制还需进一步研究。
[1] KHOR B, GARDET A, XAVIER R J. Genetics and pathogenesis of inflammatory bowel disease [J]. Nature, 2011, 474(7351): 307-317. DOI: 10.1038/nature10209.
[2] SUN J, ZHANG H, WANG C, et al. Regulating the balance of Th17/Treg via electroacupuncture and moxibustion: an ulcerative colitis mice model based study [J]. Evid Based Complement Alternative Med, 2017, 2017: 7296353. DOI: 10.1155/2017/7296353.
[3] FONSECA-CAMARLLO G, YAMAMOTO-FURUSHO J K. Immunoregulatory pathways involved in inflammatory bowel disease [J]. Inflamm Bowel Dis, 2015, 21(9): 2188-2193. DOI: 10.1097/MIB.0000000000000477.
[4] MA Y H, ZHANG J, CHEN X, et al. Increased CD4+ CD45RA- FoxP3low cells alter the balance between Treg and Th17 cells in colitis mice [J]. World J Gastroenterol, 2016, 22(42): 9356-9367. DOI: 10.3748/wjg.v22.i42.9356.
[5] WANG B, MA Z, WANG M, et al. IL-34 upregulated Th17 production through increased IL-6 expression by rheumatoid fibroblast-like synoviocytes [J]. Mediators Inflamm, 2017, 2017: 1567120. DOI: 10.1155/2017/1567120.
[6] MOLODECKY N A, SOON I S, RABI D M, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review [J]. Gastroenterology, 2012, 142(1): 46-54. DOI: 10.1053/j.gastro.2011.10.001.
[7] SHALE M, SCHIERING C, POWRIE F. CD4 (+) T-cell subsets in intestinal inflammation [J]. Immunol Rev, 2013, 252(1): 164-182. DOI: 10.1111/imr.12039.
[8] 祝斌, 张寒仙, 曾今诚, 等. 美沙拉嗪对DSS诱导小鼠溃疡性结肠炎模型Th1、Th17及Treg细胞亚群的影响[J]. 中国病理生理杂志, 2014, 30(12): 2219-2225. DOI: 10.3969/j.issn.1000-4718.2014.12.018.
ZHU B, ZHANG H X, ZENG J C, et al. Effect of mesalazine on Th1, Th17 and Treg cells in mice with DSS-in-duced ulcerative colitis [J]. Chinese Journal of Pathophysiology, 2014, 30(12): 2219-2225. DOI: 10.3969/j.issn.1000-4718.2014.12.018.
[9] BUDHU S, SCHAER D A, LI Y, et al. Blockade of surface-bound TGF-β on regulatory T cells abrogates suppression of effector T cell function in the tumor microenvironment [J]. Sci Signal, 2017, 10(494). DOI: 10.1126/scisignal.aak9702.
[10] XU A, LIU Y, CHEN W, et al. TGF-β-induced regulatory T cells directly suppress B cell responses through a noncytotoxic mechanism [J]. J Immunol, 2016, 196(9): 3631-3641. DOI: 10.4049/jimmunol.1501740.
[11] ZHANG S, TAKAKU M, ZOU L, et al. Reversing SKI-SMAD4-mediated suppression is essential for TH17 cell differentiation [J]. Nature, 2017, 551(7678): 105-109. DOI: 10.1038/nature24283.
[13] XU X R, LIU C Q, FENG B S, et al. Dysregulation of mucosal immune response in pathogenesis of inflammatory bowel disease [J]. World J Gastroenterol, 2014, 20(12): 3255-3264. DOI: 10.3748/wjg.v20.i12.3255.
[14] IVANOV I I, ATARASHI K, MANEL N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria [J]. Cell, 2009, 139(3): 485-498. DOI: 10.1016/j.cell.2009.09.033.
[15] NIESS J H, LEITHUSER F, ADLER G, et al. Commensal gut flora drives the expansion of proinflammatory CD4 T Cells in the colonic lamina propria under normal and inflammatory conditions [J]. J Immunol, 2007, 180(1): 559-568.
[16] DONG Z, DU L, XU X, et al. Aberrant expression of circulating Th17, Th1 and Tc1 cells in patients with active and inactive ulcerative colitis [J]. Int J Mol Med, 2013, 31(4): 989-997. DOI: 10.3892/ijmm.2013.1287.
[17] YANG F, WANG D, LI Y, et al. Th1/Th2 balance and Th17/Treg-mediated immunity in relation to murine resistance to Dextran sulfate-induced colitis [J]. J Immunol Res, 2017, 2017: 7047201. DOI: 10.1155/2017/7047201.
[18] BALLOCCA F, D'ASCENZO F, MORRETTI C, et al. Predictors of cardiovascular events in patients with systemic lupus erythematosus (SLE): a systematic review and meta-analysis [J]. Eur J Prev Cardiol, 2015, 22(11): 1435-1441. DOI: 10.1177/2047487314546826.
[19] WINE E, MACK D R, HYAMS J, et al. Interleukin-6 is associated with steroid resistance and reflects disease activity in severe pediatric ulcerative colitis [J]. J Crohns Colitis, 2013, 7(11): 916-922. DOI: 10.1016/j.crohns.2012.12.012.
[20] MUDTER J, NEURATH M F. IL-6 signaling in inflammatory bowel disease: pathophysiological role and clinical relevance [J]. Inflamm Bowel Dis, 2007, 13(8): 1016-1023. DOI: 10.1002/ibd.20148.
[21] OUYANG W, RUTZ S, CRELLIN N K, et al. Regulation and functions of the IL-10 family of cytokines in Inflammation and disease [J]. Annu Rev Immunol, 2011, 29: 71-109. DOI: 10.1146/annurev-immunol-031210-101312.
[22] 马亚会, 张杰, 邵淑琳, 等. 溃疡性结肠炎模型鼠中调节性T细胞亚群变化的研究[J]. 胃肠病学和肝病学杂志, 2016, 25(3): 294-298. DOI: 10.3969/j.issn.1006-5709.2016.03.016.
MA Y H, ZHANG J, SHAO S L, et al. The changes of regulatory T cell subsets in DSS-induced ulcerative colitis mice [J]. Chin J Gastroenterol Hepatol, 2016, 25(3): 294-298. DOI: 10.3969/j.issn.1006-5709.2016.03.016.
[23] NISHIHARA M, OGURA H, UEDA N, et al. IL-6-gp130-STAT3 in T cells directs the development of IL-17+ Th with a minimum effect on that of Treg in the steady state [J]. Int Immunol, 2007, 19(6): 695-702. DOI: 10.1093/intimm/dxm045.
[24] ZHANG R, TIAN A, WANG J, et al. miR26a modulates Th17/T reg balance in the EAE model of multiple sclerosis by targeting IL6 [J]. Neuromolecular Med, 2015, 17(1): 24-34. DOI: 10.1007/s12017-014-8335-5.
[25] POWELL N, LO J W, BIANCHERI P, et al. Interleukin 6 increases production of cytokines by colonic innate lymphoid cells in mice and patients with chronic intestinal inflammation [J]. Gastroenterology, 2015, 149(2): 456-467. e15. DOI: 10.1053/j.gastro.2015.04.017.

