悬浮固化分散液液微萃取-高效液相色谱法测定水体中邻苯二甲酸酯
吴翠琴, 李 颖, 常淑萍, 陈永亨, 陈迪云, 龚 剑, 许良智
(1. 广州大学环境科学与工程学院, 珠江三角洲水质安全与保护教育部重点实验室, 广东省放射性核素污染控制与资源化重点实验室, 广东 广州 510006; 2. 四川大学华西第二医院妇产科, 四川 成都 610041)
邻苯二甲酸酯(PAEs),又称酞酸酯,是邻苯二甲酸与醇类物质经酯化反应得到的一系列有机化合物。PAEs作为增塑剂被大量应用于塑料制品中以提高产品的可塑性、柔韧性和弹性[1]。PAEs是环境内分泌干扰物,具有生殖毒性、致病、致畸和致癌性[2]。美国国家环保署(EPA)早已将邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸苄基丁酯(BBP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸(2-乙基己基)酯(DEHP)6种PAEs列为优先控制污染物[3],其中DMP、DBP和DNOP也被列入“中国环境优先控制污染物黑名单”中。国家标准GB 3838-2002《地表水环境质量标准》规定,集中式生活饮用水和地表水源地特定项目中DBP和DEHP的限量值分别为3 μg/L和8 μg/L;国家标准GB 5749-2006《生活饮用水卫生标准》规定,生活饮用水水质非常规指标中DEHP的限量值为8 μg/L。因此,建立简单、高效测定水体中邻苯二甲酸酯的检测方法尤为重要。
由于PAEs在环境中含量较低,因此在进样分析前要进行样品预处理,主要方法有液液萃取法[4,5]、固相萃取法[6,7]、固相微萃取法(SPME)[3,8,9]和液相微萃取法(LPME)[10-12]等。液液萃取法和固相萃取法存在需消耗大量有机溶剂、操作繁琐费时等缺点;固相微萃取法纤维较贵,易碎,且容易超载;液相微萃取法所需溶剂极少,但是萃取时间较长。因此,一种新的集萃取、浓缩于一体的分散液液微萃取技术(DLLME)[13-15]近年来在样品预处理中被广泛使用。但是DLLME的萃取溶剂大部分是密度大于水的四氯化碳(CCl4)、氯仿(CCl3)和1,2-二氯乙烷(CH2ClCH2Cl)等,这些萃取溶剂毒性较大。2008年,Leong等[16]提出悬浮固化(SFO)分散液液微萃取,该技术使用熔点接近室温、密度小于水且低毒的溶剂作为萃取剂,样品经离心和冷冻后,固化的有机相漂浮在水面上,易取出。因此本文利用毒性较小的十二烷醇(熔点24 ℃)作为萃取溶剂,建立了悬浮固化分散液液微萃取-高效液相色谱分离富集环境水样中6种PAEs的方法,并获得了满意的结果。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1200高效液相色谱仪、Agilent Extend-C18液相色谱柱(250 mm×4.6 mm, 5 μm)(美国Agilent公司); SB3200DT超声波清洗器(宁波新芝生物科技有限公司); SK-1快速混匀器(江苏省金坛市荣华仪器制造有限公司); Anke TDL-4离心机(上海安亭科学仪器厂);电热恒温水浴锅(上海慧泰仪器制造有限公司);电子天平(赛多利斯科学仪器北京有限公司); PHB-5 pH计(上海伟业仪器厂); AL-01型溶剂过滤器(天津奥特赛恩斯仪器有限公司); 0.45 μm水性滤膜(上海安谱科学仪器有限公司); 25 μL微量进样器(美国Hamilton公司)
DMP、DEP、BBP、DBP、DNOP和DEHP标准品(2.0 mg/mL,美国AccuStandard公司);十二烷醇(色谱纯,北京百灵威科技有限公司);甲醇和乙腈均为色谱纯(上海安谱集团有限公司);其他试剂均为分析纯。
NaCl固体(分析纯)和能高温灼烧的玻璃器皿使用前均于400 ℃马弗炉内灼烧4 h,冷却后密封保存,一周内使用;超纯水密封于玻璃器皿中,当天使用;实验中避免使用塑料器材。
1.2 样品前处理
广州沥滘污水处理厂污水、珠江水、广州大学湖水、广州南沙海水和实验室自来水样品用可密封的玻璃瓶保存,置于4 ℃冰箱中,于24 h内测定。塑料瓶装纯净水和矿泉水,开封后立即检测。除海水样品外,其余水样均用氯化钠配制质量浓度为20 g/L的氯化钠溶液,然后过0.45 μm滤膜,待进一步预处理。
用移液管移取2 mL抽滤后的水样,置于5 mL离心管中,于60 ℃恒温水浴锅中加入萃取溶剂十二烷醇20 μL,快速涡旋混匀1 min,以3 000 r/min离心10 min,然后置于冰浴中,用金属药匙将上层固化的十二烷醇固体取出,置于进样瓶中,待融化后,用进样针移取10 μL,进行HPLC测定。
1.3 色谱条件
色谱柱:Agilent Extend-C18柱(250 mm×4.6 mm, 5 μm);柱温:30 ℃;流动相A:乙腈,流动相B:超纯水;流速:1 mL/min。梯度洗脱程序:0~6.0 min, 45%A~100%A; 6.0~17.0 min, 100%A; 17.0~17.1 min, 100%A~45%A。进样量:10 μL;检测波长:225 nm。
2 结果与讨论
2.1 样品前处理条件的优化
2.1.1萃取溶剂种类和体积的考察
合适的萃取溶剂是决定DLLME萃取效率的关键因素。实验考察了不同萃取溶剂对PAEs萃取效率的影响。如密度小于水、熔点接近室温的十一烷醇和十二烷醇,采用悬浮固化的方法分离萃取剂和水相;密度大于水的3种离子液体(1-丁基-3-甲基咪唑六氟磷酸盐([C4MIM][PF6])、1-己基-3-甲基咪唑六氟磷酸盐([C6MIM][PF6])、1-辛基-3-甲基咪唑六氟磷酸盐([C8MIM][PF6]))和四氯化碳、三氯甲烷离心后直接取底层的液滴进样。结果表明,采用离子液体、四氯化碳和三氯化碳时萃取效率较低;采用十一烷醇和十二烷醇时萃取效果较好,但是十一烷醇的色谱峰对目标分析物的色谱峰有干扰。因此最终选择十二烷醇作为萃取溶剂。
在水样体积为2 mL的条件下,考察了不同体积(20、30、40、50、60和70 μL)的十二烷醇对PAEs萃取效率的影响(见图1a)。可以看出,随着萃取溶剂体积的增加,萃取效率反而降低,原因可能是随着十二烷醇体积的增加,悬浮固化后收集到的萃取溶剂体积也随之增加,导致待测物的浓度过低。如果萃取溶剂体积过小(<20 μL),会导致后续进样困难,因此本实验未考察更小的萃取溶剂体积对萃取效率的影响。在后续实验中,将十二烷醇的体积设为20 μL。
2.1.2离子效应的考察
为了考察离子浓度对萃取效率的影响,向水样中加入不同质量的NaCl固体,使NaCl的质量浓度分别为0、10、20、30、40和50 g/L。如图1b所示,当NaCl的质量浓度为0~20 g/L时,PAEs的萃取效率随质量浓度的增加而增加;当质量浓度为20~50 g/L时,PAEs的萃取效率趋于平缓,没有显著差别。因此,选择20 g/L的NaCl来控制离子浓度。
2.1.3萃取温度的考察
在萃取过程中,升高温度能增大目标物的扩散速度,提高萃取效率。实验考察了萃取温度为30~70 ℃时,十二烷醇对PAEs的萃取效果(见图1c)。当萃取温度为30~60 ℃时,萃取效率缓慢增加,特别是BBP、DBP、DEHP和DNOP;当萃取温度从60 ℃增加到70 ℃时,萃取效率没有明显变化。因此本实验选择60 ℃为最佳萃取温度。
2.1.4水样pH值的考察
考察了样品溶液的pH值(pH 2~8)对PAEs萃取效率的影响(见图1d)。结果表明,在所考察的pH范围内,pH值对萃取效率没有明显影响,这可能是因为PAEs的极性很弱,受pH值的影响很小。因此后续实验不调节水样的pH值。
2.1.5涡旋辅助萃取时间的考察
涡旋能够加速互不相溶两相间的质量传递,从而缩短萃取时间,提高萃取效率。实验尝试采用涡旋的方式辅助萃取,设置时间为1~5 min,考察涡旋时间对PAEs萃取效率的影响(见图1e)。结果表明,萃取效率不随涡旋辅助萃取时间的增加而增加,这也体现了分散液液微萃取的优势,所需的萃取时间较短。因此本实验选择1 min作为最佳萃取时间。
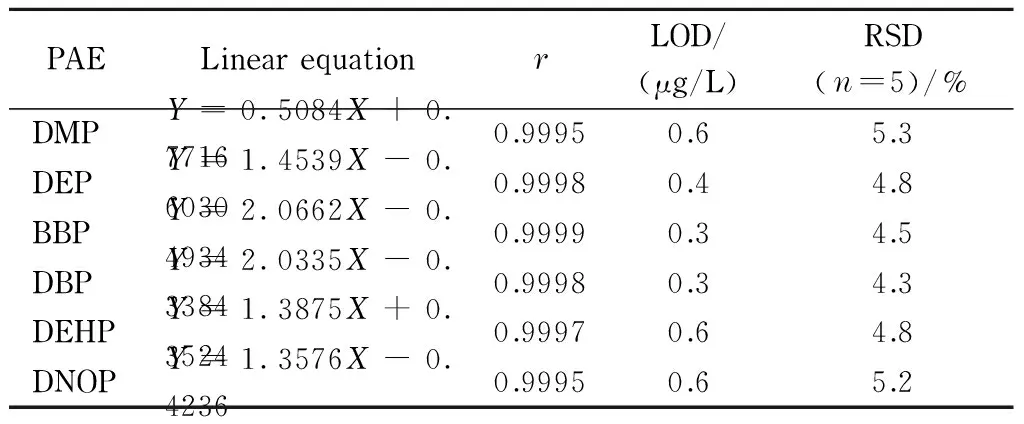
PAELinearequationrLOD/(μg/L)RSD(n=5)/%DMPY=0.5084X+0.77160.99950.65.3DEPY=1.4539X-0.60300.99980.44.8BBPY=2.0662X-0.49340.99990.34.5DBPY=2.0335X-0.33840.99980.34.3DEHPY=1.3875X+0.35240.99970.64.8DNOPY=1.3576X-0.42360.99950.65.2
DMP: dimethyl phthalate; DEP: diethyl phthalate; BBP: benzyl butyl phthalate; DBP: dibutyl phthalate; DEHP: di-(2-ethylhexyl) phthalate; DNOP: di-n-octyl phthalate;Y: peak area;X: mass concentration, μg/L.
2.2 线性范围和检出限
在1.3节的条件下对2~2 000 μg/L的加标超纯水溶液进行分析,以6种PAEs的峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线(见表1)。结果表明,6种PAEs在线性范围内线性关系良好,相关系数(r)均>0.99。PAEs的检出限(S/N=3)为0.3~0.6 μg/L,其中DBP(0.3 μg/L)和DEHP(0.6 μg/L)的检出限能够满足GB 3838-2002《地表水环境质量标准》中二者的限量值(3 μg/L和8 μg/L);目前还没有国家标准明确给出其他4种PAEs的限量值。对10 μg/L的加标超纯水样品进行分析,6种PAEs峰面积的RSD为4.3%~5.3%(n=5),满足分析要求。
2.3 实际水样的测定和加标回收率
在1.2节和1.3节的条件下,对实际水样进行测定,每个样品平行测定3次,同时测定方法的全程空白值以监控PAEs的背景值。结果发现,只有DBP的背景值大于检出限,为0.9 μg/L,其他PAEs的背景值均低于本方法的检出限,实际样品中6种PAEs的含量见表2。可以看出,DEP在所有水样中均有检出,含量为1.4~1.7 μg/L,与Zhu等[17]报道的江苏镇江某些河流中某些河段DEP的含量(2.98 ~ 5.75 μg/L)相当,Wu等[18]也曾报道某个河流中DEP的含量为4 μg/L; Liang等[13]测得某矿泉水中DEP的含量为3.2 μg/L。DMP在湖水、江水、污水、海水中有微量检出,含量为1.6~2.0 μg/L,与Liang等[13]测得某湖水中DMP的含量(6.4 μg/L)相当。DBP在大部分水样中都有测出,且含量较高,污水中DBP的含量为50.4 μg/L,这可能是因为DBP被大量用于不同的消耗品和个人护理产品[18]。Ye等[19]报道某河水和池塘水中DBP的含量分别为41.3和112.4 μg/L。BBP、DEHP和DNOP在实际水样中均未检出。
在3个添加水平(10、100、1 000 μg/L)下对自来水、湖水、江水、污水、海水等实际水样进行加标回收试验,计算回收率时扣除背景值,具体结果见表3。
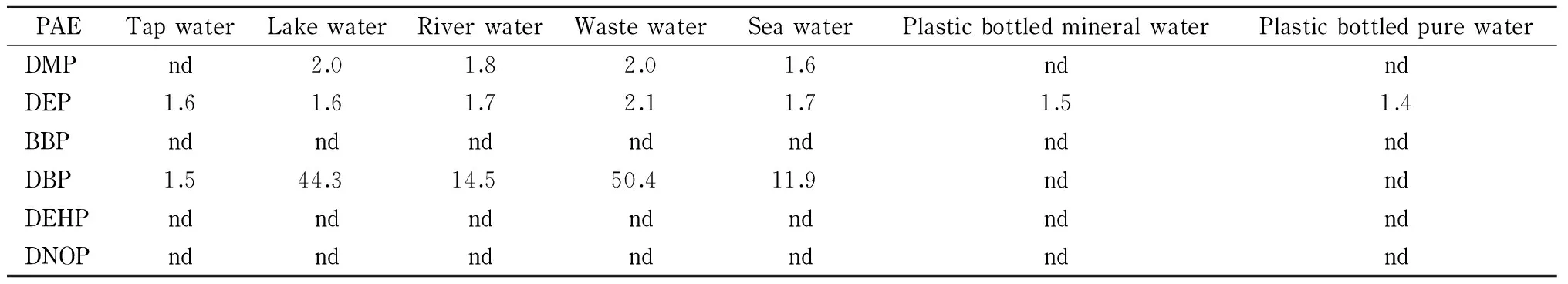
表 2 实际水样中6种PAEs的含量
nd: not detected.
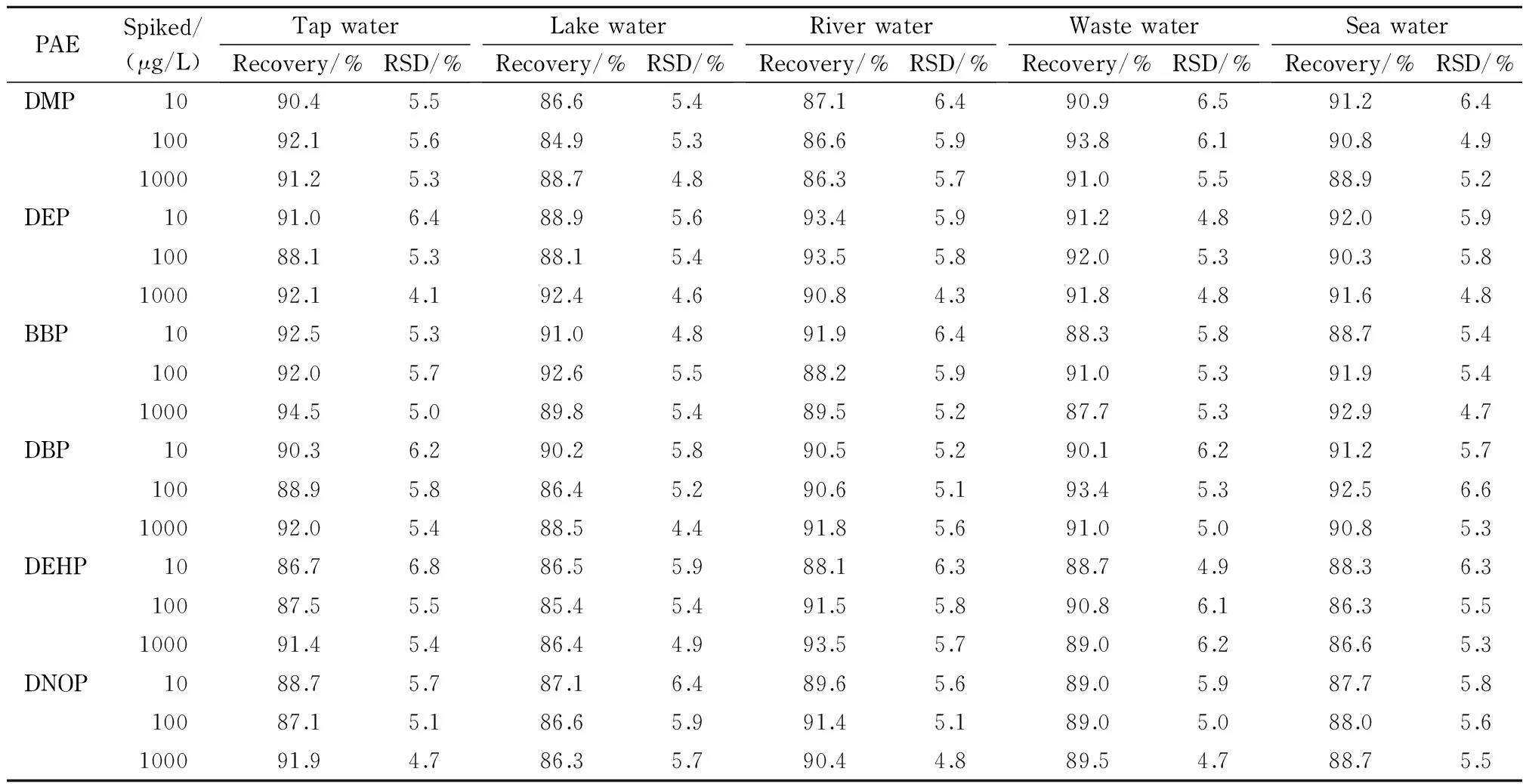
表 3 6种PAEs在实际水样中的加标回收率和精密度(n=5)
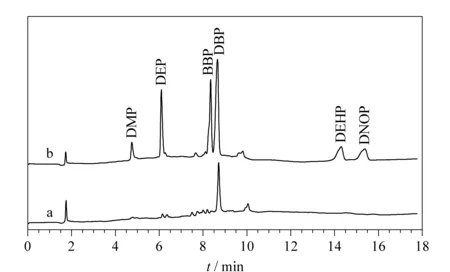
图 2 (a)空白和(b)加标(100 μg/L)湖水水样中6种PAEs的色谱图Fig. 6 Chromatograms of the six PAEs in (a) bland lake water and (b) spiked lake water (100 μg/L)
由表3可知,6种PAEs的加标回收率为84.9%~94.5%,相对标准偏差为4.1% ~ 6.8%(n=5)。空白和加标湖水水样中6种PAEs的色谱图见图2。
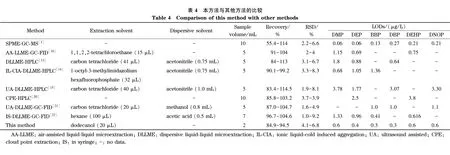
2.4 与其他方法的比较
将本方法与文献[10,13-15,20-22]报道方法进行比较(见表4),可以看出,本方法有机试剂用量和所需样品量少,检出限低。虽然本方法的灵敏度比文献[3]低,但本方法的检测手段为液相色谱,较气相色谱-质谱更普及,且本方法采用的悬浮固化分散液液微萃取技术相对于固相微萃取技术,操作简单,成本低。
3 结论
建立了基于悬浮固化的分散液液微萃取技术结合高效液相色谱测定水样中6种邻苯二甲酸酯类化合物的分析方法。该方法操作简单,所需溶剂少,回收率高,检出限低,重复性好,适用于PAEs的分析检测。
:
[1] Xu D M, Deng X J, Fang E H, et al. J Chromatogr A, 2014, 1324: 49
[2] Benjamin S, Masai E, Kamimura N, et al. J Hazard Mater, 2017, 340: 360
[3] Zhang Z M, Zhang H H, Li J L, et al. Chinese Journal of Analytical Chemistry, 2017, 45(3): 348
张泽明, 张洪海, 李建龙, 等. 分析化学, 2017, 45(3): 348
[4] Sheng J W, Zhu J H, Zhang H, et al. Journal of Analytical Science, 2012, 28(6): 855
盛建伟, 祝建华, 张卉, 等. 分析科学学报, 2012, 28(6): 855
[5] HJ/T/72-2001
[6] Liu H C, Den W, Chan S F, et al. J Chromatogr A, 2008, 1188: 286
[7] Huang S J, Wang Y J, Xu Z C. Journal of Analytical Science, 2012, 28(6): 762
黄思静, 汪义杰, 许振成. 分析科学学报, 2012, 28(6): 762
[8] Amanzadeh H, Yamini Y, Moradi M, et al. J Chromatogr A, 2016, 1465: 38
[9] Song X L, Chen Y, Yuan J P, et al. J Chromatogr A, 2016, 1468: 17
[10] Farajzadeh M A, Mogaddam M R A. Anal Chim Acta, 2012, 728: 31
[11] Xu J, Liang P, Zhang T Z. Anal Chim Acta, 2007: 597: 1
[12] Mtibe A, Msagati T A M, Mishra A K, et al. Phys Chem Earth, 2012, 50/52: 239
[13] Liang P, Xu J, Li Q. Anal Chim Acta, 2008, 609: 53
[14] Zhang H, Chen X Q, Jiang X Y. Anal Chim Acta, 2011, 689: 137
[15] Ma Y L, Chen L X, Ding Y J, et al. Chinese Journal of Chromatography, 2013, 31(2): 155
马燕玲, 陈令新, 丁养军, 等. 色谱, 2013, 31(2): 155
[16] Leong M I, Huang S D. J Chromatogr A, 2008, 1211: 8
[17] Zhu F, Mao C M, Du D L. Sci Total Environ, 2017, 601/602: 723
[18] Wu X L, Hong H J, Liu X T, et al. Sci Total Environ, 2013, 444: 224
[19] Ye Q, Liu L H, Chen Z B, et al. J Chromatogr A, 2014, 1329: 24
[20] Wang L, Jiang G B, Cai Y Q, et al. J Environ Sci, 2007, 19: 874
[21] Yan H Y, Liu B M, Du J J, et al. Analyst, 2010, 135: 2585
[22] Sargazi S, Mirzaei R, Rahmani M, et al. J Chromatogr Sci, 2015, 53: 1420

