超高效液相色谱-串联质谱法测定红薯叶中15种功效成分
周劭桓, 梁 川, 唐 阳, 廖艳华, 林文斯
(广西壮族自治区疾病预防控制中心, 广西 南宁 530028)
红薯也叫甜薯(sweet potato)或甘薯,在北纬40°和南纬32°间广泛种植。目前我国是世界上最大的红薯生产国,年产量约占世界总产量的80%[1]。在2005~2014年间,我国共鉴定红薯品种106种[2]。广西地处亚热带,适合红薯生长,每年红薯栽培面积约23.33万公顷[3]。红薯叶是红薯产业中主要的副产物,在广西每年可收获四季,如能加工利用,对红薯产业的发展有重大意义。
红薯叶营养丰富包含蛋白质、粗纤维以及矿物质等[4],同时还富含多种功效成分。已报道的功效成分包括单咖啡酰奎宁酸、双咖啡酰奎宁酸、三咖啡酰奎宁酸、咖啡酸(CA)、芥子酸(SA)、槲皮素类以及类胡萝卜素等[5-8]。许多研究表明,这些功效成分具有广泛的生物活性[9,10]。但是目前仍没有关于红薯叶功效成分系统的研究报道。
在农副产品的开发利用中,分析不同品种中功效物质的含量是选择优势品种的关键环节。目前针对植物中功效物质的分析方法主要有高速逆流色谱法、超临界流体色谱法、高效液相色谱法和液相色谱-质谱联用法等[11-13],其中液相色谱-串联质谱法由于定性、定量准确,已成为研究植物功效组分的重要分析方法。
本研究建立了一种超高效液相色谱-串联质谱(UHPLC-MS/MS)分析红薯叶中15种功效成分的方法。该方法快速、准确、前处理简单,可快速分析红薯叶中的功效成分。本研究发现了红薯叶中3种未被报道的组分,并通过定性定量分析系统研究10种红薯叶中的主要功效成分,发现可供开发的潜在优势品种,为红薯产业深度利用开发、拓展红薯产业链提供基础研究依据。
1 实验部分
1.1 仪器、试剂与材料
LC-30A超高效液相色谱仪(日本岛津公司); AB-4000 Q TRAP三重四极杆质谱仪(美国AB公司); KQ-800KDE超声波清洗机(昆山超声仪器有限公司); FDU-1200冷冻干燥机(日本Eyela公司); Milli-Q超纯水处理仪(美国Millipore公司); 3k-15离心机(德国西格玛公司)。
标准品:3-咖啡酰奎宁酸(绿原酸,3-CQA)、咖啡酸、芥子酸、奎宁酸(QA)、1-咖啡酰奎宁酸(1-CQA)、4-咖啡酰奎宁酸(4-CQA)、5-咖啡酰奎宁酸(5-CQA)、3,4-二咖啡酰奎宁酸(3,4-DiCQA)、3,5-二咖啡酰奎宁酸(3,5-DiCQA)、4,5-二咖啡酰奎宁酸(4,5-DiCQA)、槲皮素-3-β-D-葡萄糖苷(quercetin 3-β-D-glucoside)、芦丁(rutin)、杨梅素(myricetin)和木樨草素(luteolin)均为HPLC级,购自美国Sigma公司;3,4,5-三咖啡酰奎宁酸(3,4,5-TrisCQA)购自成都曼思特生物科技有限公司。色谱纯甲醇、乙腈购自德国Merck公司,其他分析纯试剂均购自国药集团化学试剂有限公司。
10个品种的红薯叶采摘自广西壮族自治区农业科学院,采摘时间为2017年5~8月。10个品种编号、名称和颜色分别是:桂粉2号(S1,绿色)、观赏紫秧(S2,紫色)、桂紫薇薯1号(S3,绿色)、心香(S4,绿色)、万薯5号(S5,绿色夹杂紫色)、安哥拉白心薯(S6,绿色夹杂紫色)、桂经薯2号(S7,绿色)、广薯87号(S8,绿色)、越南黄心薯(S9,绿色)和观赏黄秧(S10,黄色)。取新鲜红薯叶,洗净后,于-18 ℃冷冻干燥24 h,磨粉过40目筛,密闭封口袋,保存待用。
1.2 标准溶液的配制
准确称取各标准品,用甲醇溶解并配制成500 mg/L的标准储备液。准确移取0.20 mL各标准储备液,置于10 mL容量瓶中,用50%(v/v)甲醇水溶液定容,配制10 mg/L各标准中间液。分别取0.2 mL各标准中间液,用50%(v/v)甲醇水溶液稀释,定容至10 mL,得到质量浓度为200 μg/L的各标准工作液。
分别取0.4 mL各标准中间液,用50%(v/v)甲醇水溶液稀释,配制400 μg/L的混合标准溶液;用50%(v/v)甲醇水溶液逐级稀释,配制成质量浓度为0.1~200 μg/L的系列混合标准溶液。
1.3 样品前处理
准确称量1 g红薯叶冻干粉末,加入15 mL 80%(v/v)甲醇水溶液,超声波提取20 min后,以10 000 r/min离心10 min,移取上清液,重复提取3次,汇集上清液,用50%(v/v)甲醇水溶液定容至50 mL,取适量上清液,用50%(v/v)甲醇水溶液稀释适量倍数后,过滤,待测。
1.4 分析条件
色谱柱为Phenomenex C18柱(100 mm×2.1 mm, 1.8 μm);柱温为30 ℃;流动相A为0.15%(v/v)甲酸水溶液;流动相B为乙腈;流速为0.3 mL/min。梯度洗脱程序:0~15 min, 10%B~40%B; 15~16 min, 40%B~80%B; 16~22 min, 80%B; 22.00~22.03 min, 80%B~10%B; 22.03~27.50 min, 10%B。进样体积5 μL。
离子源:ESI源,负离子模式;离子源温度:550 ℃;多反应监测(MRM)模式;电离电压:-4.5 kV;雾化气压力:344 kPa;碰撞气压力:344 kPa;气帘气压力:241 kPa。预四极杆入口电压(EP): -10 V;碰撞室出口电压(CXP): -13 V。15种功效成分的定性、定量离子对、解簇电压(DP)和碰撞电压(CE)见表1。
1.5 统计分析
数据处理采用美国AB公司分析软件Analyst 1.6.2,所有样本均重复测定3次,取平均值,结果均表达为平均值±SD。
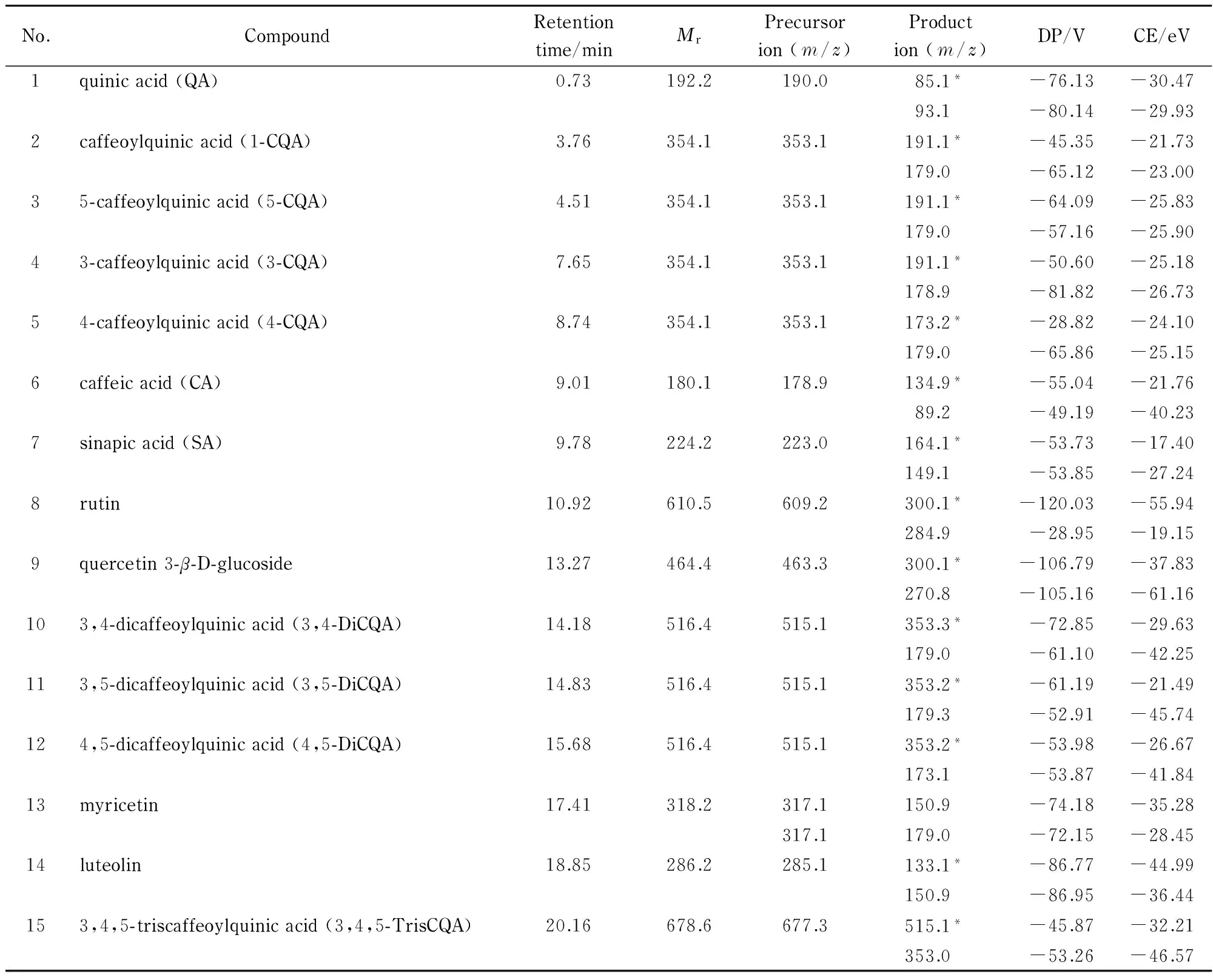
表 1 15种化合物的质谱参数
DP: declustering voltage; CE: collision energy; * quantitative ion.
2 结果与讨论
2.1 质谱条件的优化
一般而言,如果待测化合物含有氨基,应优先考虑使用ESI+扫描模式;如果待测物含有强负电性基团,如-Cl、-OH等,需优先考虑ESI-扫描模式;当待测物酸碱性不明显时,两种方式都要进行尝试。本次实验待测化合物大都带有一个或多个-OH基团,具有一定酸性,更适合ESI-模式,但有些中性化合物如芦丁等,在正离子模式下的响应值会优于负离子模式下的响应值。因此实验首先采用针泵进样,测定不同化合物在正离子和负离子模式下的质谱信号。结果显示大多数待测化合物在ESI-模式下的响应值较强,芦丁在ESI+与ESI-模式下的响应值相差不大,但是红薯叶提取液在ESI+扫描模式下受干扰较大。因此最终本实验采用ESI-模式分析待测化合物。
在负离子模式下,选择出各化合物的母离子,对其进行碰撞解离以获得二级离子碎片,并对二级碎片离子进行碰撞能量的优化,选择两组干扰少、响应值高的离子对作为定性离子和定量离子对,优化后的参数见表1。
实验过程发现,1-CQA、3-CQA、4-CQA和5-CQA均含有m/z为353.1、191.1、179.1和135.0的离子碎片;3,4-DiCQA、3,5-DiCQA和4,5-DiCQA均含有m/z为515.2、353.1、190.1和179.1的离子碎片。采用针泵进样在MRM模式下进行优化,发现这两组同系物无法通过选择离子来区分,还需进一步优化色谱条件以达到分离要求。
2.2 色谱条件的优化
考察了甲醇-水和乙腈-水两种不同流动相体系对待测物分离效果的影响,结果显示,大多数待测化合物在乙腈-水体系下峰形更为尖锐、清晰。实验还发现酚酸类物质在乙腈-水体系和甲醇-水体系下色谱峰均有拖尾现象,尤其是双咖啡酰奎宁酸类和三咖啡酰奎宁酸,拖尾较为严重。尝试在乙腈-水体系中加入体积分数分别为0.05%、0.1%、0.15%和0.2%的甲酸,结果显示,在乙腈-0.15%(v/v)甲酸水和乙腈-0.2%(v/v)甲酸水两种流动相条件下,各化合物的峰形清晰,基本无拖尾现象。考虑到在负离子模式下,过高的酸性环境可能对化合物的电离产生抑制效应,因此最终采用乙腈-0.15%(v/v)甲酸水溶液作为流动相。
在乙腈-0.15%(v/v)甲酸水流动相体系下对100 μg/L的混合标准溶液进行分析,其总离子流图色谱谱见图1。由图1可知,在本研究的色谱分离体系下,4种单咖啡酰奎宁酸同系物和3种双咖啡酰奎宁酸同系物均能得到良好分离。

图 1 混合标准溶液中15种功效成分(100 μg/L)的总离子流色谱图Fig. 1 Total ion current chromatogram of the 15 functional components (100 μg/L) in the mixed standard solution Nos. 1-15 were the same as that in Table 1.

图 2 样品S9的总离子流色谱图Fig. 2 Total ion current chromatogram of the sample S9Nos. 1-15 were the same as that in Table 1.
2.3 未知峰的分析
图2为典型红薯叶样品(S9)的总离子流色谱图。与图1对比可知,S9样品中含有11种已知的功效物质,分别为QA、5-CQA、3-CQA、4-CQA、CA、芦丁、槲皮素-3-β-D-葡萄糖苷、3,4-DiCQA、3,5-DiCQA、4,5-DiCQA和3,4,5-TrisCQA,同时还含有未知化合物1(8.15 min)和未知化合物2(12.80 min)。
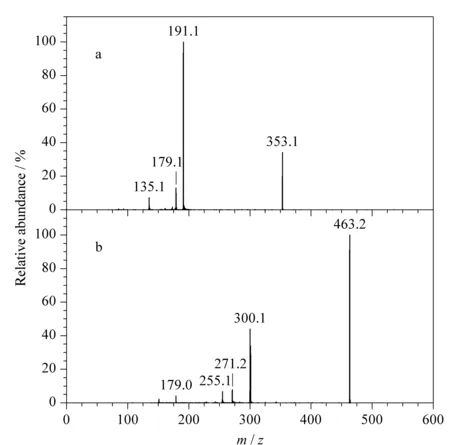
图 3 (a)未知化合物1和(b)未知化合物2的二级质谱图Fig. 3 MS/MS spectra of (a) unknown compound 1 and (b) unknown compound 2
针对这两个未知化合物,进一步采用多反应监测-条件判断-增强离子扫描(MRM-IDA-EPI)模式扫描其二级子离子。MRM-IDA-EPI是三重四极杆质谱仪一种特有的扫描方式,其实现方法为对某一组离子对在MRM模式下的响应值进行条件判断,当采集强度超过预设值后,将触发EPI模式,从而获得二级扫描图谱。本实验对191.1/353.1和300.1/463.2两组离子对进行MRM-IDA-EPI扫描。在m/z50~800的扫描范围内,未知化合物1和未知化合物2的二级质谱图分别见图3a和图3b。
未知化合物1母离子的m/z为353.1,子离子的m/z分别为135.1、179.1和191.1,均为单咖啡酰奎宁酸的典型分子离子,由于该化合物与4种单咖啡酰奎宁酸的出峰时间均不相同,推断其可能为单咖啡酰奎宁酸的同分异构体。
未知化合物2的质谱图与槲皮素-3-β-D-葡萄糖苷类似,母离子的m/z为463.2,子离子具有槲皮素典型分子离子碎片(m/z为300.1和179.0),而且该物质与槲皮素-3-β-D-葡萄糖苷出峰时间十分接近。实验中尝试通过改变流动相体系及流动相比例来分离这两种物质,结果发现不论如何改变均无法分离这两个物质(见图4)。因此推测未知化合物2为槲皮素-3-β-D-葡萄糖苷的异构体,可能为槲皮素-3-α-D-葡萄糖苷。
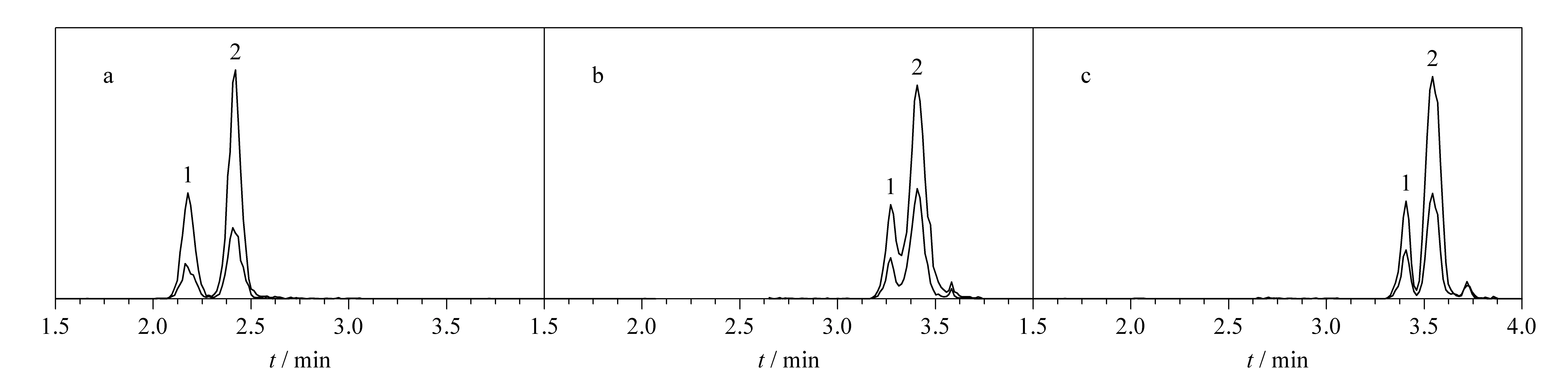
图 4 未知化合物2和槲皮素-3-β-D-葡萄糖苷在不同流动相条件下的色谱图Fig. 4 Chromatograms of the unknown compound 2 and quercetin 3-β-D-glucoside using different mobile phases Conditions: a. acetonitrile-0.15% (v/v) formic acid aqueous solution; b. acetonitrile-5mmol/L ammonium acetate; c. acetonitrile-5 mmol/L ammonium acetate-0.15% (v/v) formic acid aqueous solution. Peaks: 1. unknown 2; 2. quercetin 3-β-D-glucoside
CompoundLinearrange/(μg/L)LinearequationrLOD/(μg/L)Recovery/%RSD/%QA1.4-271.5Y=9.46×103X+4.56×1030.99970.1787.76.7Quercetin3-β-D-glucoside1.3-263.4Y=4.61×103X+2.37×1030.99980.1692.54.5Rutin1.4-281.5Y=1.60×104X+1.87×1030.99980.1591.43.6Myricetin1.3-263.5Y=1.07×103X+9.37×1020.99960.13103.63.9Luteolin1.3-259.5Y=1.06×103X+9.37×1020.99960.2695.45.01-CQA1.4-284.6Y=9.23×103X+6.00×1030.99980.2890.45.14-CQA1.3-252.5Y=1.64×103X+6.56×1030.99980.1382.24.83-CQA1.3-269.3Y=1.21×103X+3.56×1030.99970.1386.75.25-CQA1.4-271.4Y=2.12×103X+3.79×1030.99970.3494.56.5CA1.4-278.5Y=1.49×103X+2.41×1030.99950.64131.44.43,4-DiCQA1.3-261.0Y=1.60×104X+3.49×1030.99960.1396.78.33,5-DiCQA1.4-280.5Y=9.77×103X+4.23×1030.99970.1494.46.04,5-DiCQA1.3-252.0Y=2.21×104X-3.37×1030.99970.13104.25.7SA1.3-257.8Y=8.67×103X+6.74×1030.99980.6097.65.23,4,5-TrisCQA1.4-275.6Y=1.10×104X+1.01×1030.99970.2682.67.3
Y: peak area;X: mass concentration, μg/L.
2.4 方法学考察
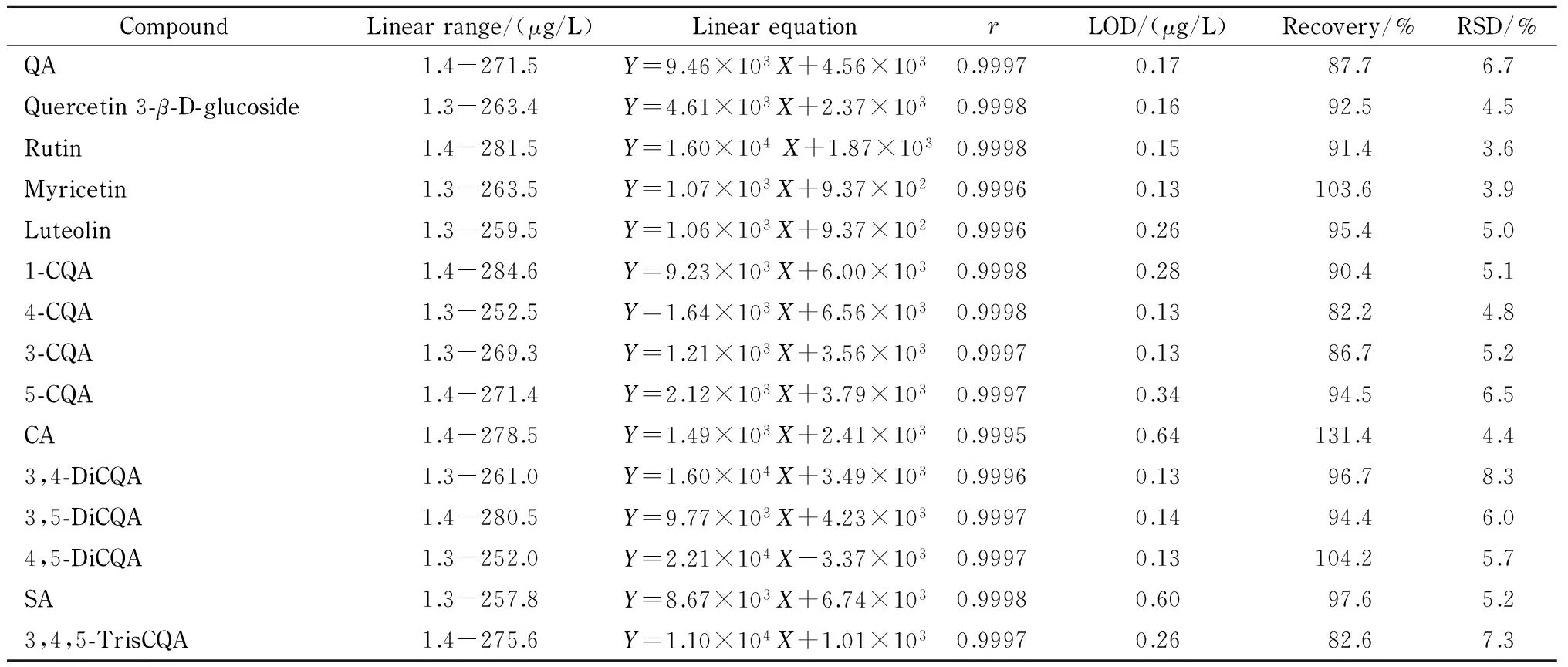
采用1.4节的分析条件,考察15种功效成分的线性关系、检出限、回收率以及相对标准偏差(见表2)。由表2可知,15种功效成分在各自的范围内线性关系良好,相关系数(r)为0.999 5~0.999 8,方法的检出限为0.13~0.64 μg/L。
以S9样品为研究对象,针对可检测出的组分,根据计算值,分别加入测定含量50%、80%、100%水平的化合物;对未检测出的组分,按空白加标方法加入不同水平的标准物质,使其质量浓度分别为5、10和20 μg/L。按1.3节和1.4节方法操作,测定平均回收率和精密度,结果见表2。可以看出,除咖啡酸的回收率明显偏高(131.4%)外,其余各化合物的回收率(82.2%~104.2%)均在合理范围内。
2.5 实际样品分析
利用本方法测定10个品种红薯叶(S1~S10)中的功效成分,测定结果见表3。由表3可知,不同品种红薯叶中各组分含量差异巨大,15种功效成分中,1-咖啡酰奎宁酸、杨梅素、木樨草素和芥子酸在所有样品中均未检出,芦丁在部分样品中有检出。咖啡酰奎宁类物质是红薯叶中的主要成分,占所测功效成分的35.1%~84.2%,其中3,5-二咖啡酰奎宁酸在不同红薯叶品种中含量最高,为122.1~1 080.3 mg/100g。相比咖啡酰奎宁类物质,黄酮类物质在红薯叶中含量不高,仅占所测功效成分的0.4%~6.9%。
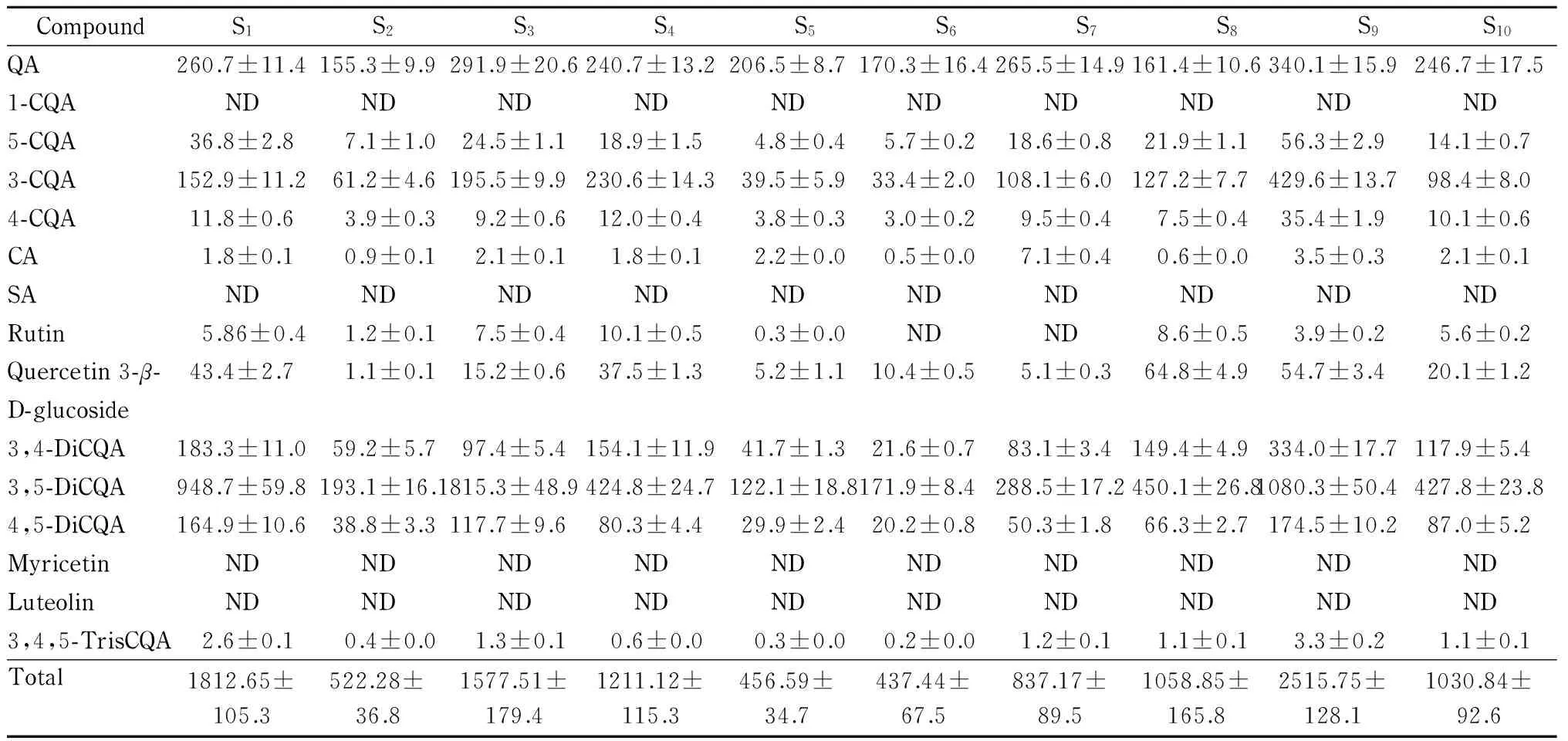
表 3 红薯叶样品中15种功能成分的测定结果(n=3)
The values were expressed as mean±SD. ND: not detected.
3 结论
本文建立了一种快速、高效分析红薯叶功效物质的超高效液相色谱-串联质谱分析方法。应用本方法分析10个不同品种的红薯叶,确定了红薯叶富含的多酚类物质,其中咖啡奎宁酸类物质是红薯叶中的主要功效成分。对大多数品种而言,3,5-二咖啡酰奎宁酸和奎宁酸是红薯叶中含量最高的两种酚类物质。本方法的建立为红薯叶的开发利用及深度研究提供了技术支撑。
:
[1] Tang Z H, Wei M, Chen X G, et al. Scientia Agricultura Sinica, 2014, 47(9): 1705
唐忠厚, 魏猛, 陈晓光, 等. 中国农业科学, 2014, 47(9): 1705
[2] Wang L J, Lei J, Su W J, et al. Hubei Agricultural Sciences, 2015, 54(12): 2844
王连军, 雷剑, 苏文瑾, 等. 湖北农业科学, 2015, 54(12): 2844
[3] Wu C R, Lu S Q, Li Y Q, et al. Guangxi Agricultural Sciences, 2010, 41(8): 845
吴翠荣, 卢森权, 李彦青, 等. 广西农业科学, 2010, 41(8): 845
[4] Sun H N, Mu T H, Xi L S, et al. Food Chem, 2014, 156: 380
[5] Jeng T L, Chiang Y C, Lai C C, et al. J Food Drug Anal, 2015, 23: 399
[6] Jeng J K, Lee S U, Kozukue N, et al. J Food Compos Anal, 2011, 24: 29
[7] Shekhar S, Mishra D, Buragohain A K, et al. Food Chem, 2015, 173: 957
[8] Isabel S C, Teresa C, Lara M C. Food Chem, 2010, 118: 384
[9] Alan C, Indu B J, Michael N C. Nat Prod Rep, 2009, 26(8): 965
[10] Lincoln W M, Rima A C, Ian B P, et al. Clin Exp Pharmacol P, 2000, 27: 152
[11] Ioana I, Irina V, Valentin I P. Food Chem, 2011, 126: 1821
[12] Zhang J, Wan H H, Zhang H. Chinese Journal of Chromatography, 2017, 35(9): 963
张婧, 万慧慧, 张华. 色谱, 2017, 35(9): 963
[13] Lai G Y, Wang L J, Lu H, et al. Chinese Journal of Chromatography, 2017, 35(5): 502
赖国银, 王俐娟, 卢鹤, 等. 色谱, 2017, 35(5): 502

