咖啡酰奎宁酸类化合物研究进展
吴琪珍
(1. 赣南卫生健康职业学院,江西 赣州341000; 2. 赣州卫生学校,江西 赣州 341000)
咖啡酰奎宁酸类化合物,是一种常见的天然酚酸类化合物,其酰基由咖啡酸(3,4-二羟基肉桂酸)和奎宁酸(1-羟基六氢没食子酸)酯化而成。该类化合物主要有单咖啡酰奎宁酸(Mono-caffeoylquinic acids,MCQA)、双咖啡酰奎宁酸(Dicaffeoylquinic acids,DCQA)和三咖啡酰奎宁酸(Tricaffeoylquinic acids,TCQA)及各种衍生物。咖啡酰奎宁酸类化合物存在于很多中草药及水果蔬菜中,比较有代表性的有金银花、款冬花、茵陈、菜蓟、咖啡豆、红薯等。本文将从咖啡酰奎宁酸类化合物的化学结构,检测分析及药理活性等方面做一简要概述。
1 化学结构
根据咖啡酰基个数,该类化合物可分为单咖啡酰奎宁酸、双咖啡酰奎宁酸和三咖啡酰奎宁酸。此外,咖啡酰和奎宁酸母核上由于各种取代,得到了许多咖啡酰奎宁酸的衍生物。
1.1 单咖啡酰奎宁酸
根据取代基位点不同,MCQA主要包括4种同分异构体:1-咖啡酰奎尼酸(1-CQA)、3-咖啡酰奎尼酸(绿原酸,3-CQA)、4-咖啡酰奎尼酸(4-CQA)、5-咖啡酰奎尼酸(5-CQA)[1]。
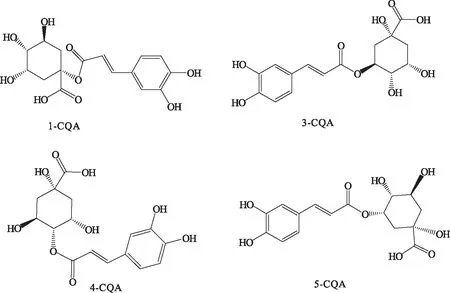
图1 单咖啡酰奎宁酸化合物的结构式Fig.1 Structure of MCQA
1.2 双咖啡酰奎宁酸
植物中常见的双咖啡酰奎宁酸有6种,为奎尼酸母核上羟基二取代的同分异构体,主要包括1,3-二咖啡酰奎尼酸(1,3-DCQA,洋蓟素)、1,4-二咖啡酰奎尼酸(1,4-DCQA)、1,5-二咖啡酰奎尼酸(1,5-DCQA)、3,4-二咖啡酰奎尼酸(3,4-DCQA,异绿原酸B)、3,5-二咖啡酰奎尼酸(3,5-DCQA,异绿原酸A)、4,5-二咖啡酰奎尼酸(4,5-DCQA,异绿原酸C)。


图2 双咖啡酰奎宁酸化学结构Fig. 2 Structure of DCQA注:1,3-DCQA(1)、1,4-DCQA(2)、1,5-DCQA(3)3,4-DCQA(4)、3,5- DCQA(5)、4,5- DCQA(6)
1.3 三咖啡酰奎宁酸
目前植物中分离得到的三咖啡酰奎宁酸主要为3,4,5-三咖啡酰奎宁酸、1,3,5-三咖啡酰奎宁酸和1,4,5-三咖啡酰奎宁酸。
1.4 咖啡酰奎宁酸类衍生物
咖啡酰奎宁酸类化合物衍生物有多种,主要分为3种。第一种是奎宁酸母核上1位羧基发生酯化,如5-O-咖啡酰基奎宁酸甲酯[2]。吴琪珍[3]从菊科植物款冬花中分离得到3,4-二咖啡酰奎宁酸甲酯、3,5-二咖啡酰奎宁酸甲酯、4,5-二咖啡酰奎宁酸甲酯和5-咖啡酰奎宁酸甲酯。
第二种是奎宁酸母核上1位羟基上的氢被烃基取代,如Ela等[4]从植物InulacrithmoidesL.根中分离得到3,5-二咖啡酰奎宁酸-1甲酯和4,5-二咖啡酰奎宁酸-1甲酯。
第三种取代主要是除咖啡酰外,奎宁酸母核上羟基被其他取代基,如香草酰(vanilloyl)、阿魏酰(feruloyl)、丁香酰(syringoyl)、葡萄糖等其他取代。Liu等[5]从丁公藤中分离得到11种新的咖啡酰奎宁酸衍生物,包括4-O-咖啡酰-3-O-香草酰奎宁酸(1)、5-O-咖啡酰-4-O-香草酰奎宁酸(2)、5-O-咖啡酰-3-O-香草酰奎宁酸(3)、4-O-咖啡酰-3-O-香草酰奎宁酸甲酯(4)、5-O-咖啡酰-3-O-香草酰奎宁酸甲酯(5)、5-O-咖啡酰-3-O-丁香酰奎宁酸(6)、4-O-咖啡酰-3-O-丁香酰奎宁酸甲酯(7)、4-O-(7"S, 8"R)-糖苷酰-5-O-咖啡酰奎宁酸(8)、4-O-(7"S, 8"R)- 糖苷酰-5-O-咖啡酰奎宁酸甲酯(9)、3-O-(7"S, 8"R)- 糖苷酰-4-O-咖啡酰奎宁酸(10)、3-O-(7"S,8"R)-糖苷酰-4-O-咖啡酰奎宁酸甲酯(11)。
Yang等[6]从拐轴鸦葱中分离得到4种咖啡酰奎宁酸类衍生物:(-)-1-O-阿魏酰-3-O-二氢咖啡酰奎宁酸、(-)-1-O-阿魏酰-4-O-二氢咖啡酰奎宁酸、(-)-1-O-阿魏酰-5-O-二氢咖啡酰奎宁酸、(-)-1,4-O-二阿魏酰-3-O-二氢咖啡酰奎宁酸。
1.5 稳定性
咖啡酰奎宁酸类化合物中存在酯键、不饱和双键、邻二酚羟基、羟基等,是这类化合物容易发生变化的主要因素。在提取过程中,酯基容易发生水解,异构化,邻二酚羟基容易发生氧化。
张倩等[7]对金银花提取过程中,三个双咖啡酰奎宁酸的比例变化规律进行了检测。随着提取时间的变化, 3,5-DCQA所占比例逐渐下降,3,4-DCQA和4,5-DCQA所占比例逐渐升高,作者推测提取过程中3,5-DCQA会异构化为另外2种成分。
在药材提取过程中,咖啡酰奎宁酸类成分发生变化不可避免。在单体分离纯化及储存的过程中要极力避免这种变化,严格控制温度,避免过长时间加热,同时也要注意pH等条件,尽量干燥后保存。在提取分离过程中,多采用旋转蒸发仪等进行浓缩,必要时采用真空冷冻干燥,尽可能地减少咖啡酰奎尼酸类化合物发生变化。
2 检测分析
咖啡酰奎宁酸类化合物常用的检测分析及含量测定手段有薄层层析色谱、紫外分光光度法、高效液相色谱、液质联用色谱等。
薄层层析色谱(TLC)是提取分离中常用的鉴别手段。常用展开系统有BAW系统(正丁醇-醋酸-水:4:1:1),可以鉴别绿原酸和异绿原酸类成分。药典记载的金银花鉴别绿原酸的展开剂是乙酸丁酯-甲酸-水(7.5:2.5:2.5)上层溶液[8]。薄层展开后置紫外灯下展示,365 nm处有荧光。薄层鉴别检测时间短,仪器简单易得,缺点是灵敏度不高,尤其是不能有效鉴别同分异构体。
紫外分光光度法常用于总咖啡酰奎宁酸含量的测定。苟占平等[9]以绿原酸为对照品,直接采用紫外分光光度法,在327 nm处对川渝6种忍冬叶进行了总咖啡酰奎宁酸含量的测定。甄攀等[10]则采用络合比色法测定吴茱萸及其炮制品中总酚酸含量,以绿原酸为对照品,1%铁氰化钾-1%三氯化铁(1:1)混合液络合显色,于760 nm处采用分光光度法测定了总酚酸含量。
高效液相色谱法(HPLC)是常用的咖啡酰奎宁酸类化合物定性定量鉴别的手段。通常采用的是反相色谱柱,如C18柱,洗脱溶剂为甲醇-水、乙腈-水加入少量的弱酸盐,如甲酸、乙酸、磷酸等。刘长河等[11]发现以0.025%磷酸、0.3%醋酸的混合酸为缓冲盐比单一的缓冲盐洗脱效果更好,能提高洗脱峰的分离度。李丹等[12]以绿原酸为内标,同时测定山银花提取物中六个咖啡酰奎宁酸类化合物含量。这种一测多评定量分析方法以一种标准品为内标,同时检测多种化合物,逐渐受到了广泛关注。高效液相色谱法主要用于化合物的定量分析,但是在定性鉴别上面仍有缺憾。
液质联用色谱技术为咖啡酰奎宁酸类化合物的定性和定量分析提供了便利,能够对微量成分进行定性定量分析。Gouveia等[13]采用HPLC-DAD-ESI/MSn在30 min内分离了1,5-DCQA、3,5-DCQA和3,5-DCQA,进行了定性鉴别与纯度测定。
此外,超高效液相色谱(UHPLC)也应用于咖啡酰奎宁酸类化合物的分析,得到了很好地分离效果。
3 药理活性
3.1 抗菌、抗炎作用
分离得到的的咖啡酰奎宁酸类化合物小鼠肺泡灌洗试验发现,绿原酸、3,5-DCQA、4,5-DCQA和3,4-DCQA能有效抑制白细胞数目的增高,说明有抗炎作用[14]。HAN等[15]对3种二咖啡酰奎宁酸进行活性比较发现,3,4-DCQA、3,5-DCQA和4,5-DCQA都具有显著的抗菌作用。此外,从金银花中分离得到的3-DCQA对金黄色葡萄球菌和大肠杆菌有明显的抗菌作用[16]。
3.2 抗氧化、清除自由基作用
咖啡酰奎宁酸类化合物普遍具有抗氧化,清除自由基的作用。从旋覆花中分离得到的1,3-DCQA能够抑制各种因素引起的氧化损伤,清除羟自由基和超氧自由基,具有显著的抗氧化作用[17]。从细裂叶莲蒿Artemisiagmelinii中分离得的绿原酸、4-CQA、3,5-DCQA及其乙酯化物,具有抗氧化活性[18]。
菜蓟头中含有许多多酚类化合物,如1-CQA、3-CQA、1,4-DCQA、4,5-DCQA、3,5-DCQA、1,5-DCQA、3,4-DCQA等。作为一种常用的地中海食物,Garbetta等[19]研究了经消化道消化前后多酚类化合物抗氧化能力,结果发现除1,5-DCQA外,菜蓟头水体物及其中的多酚类抗氧化能力不变。
3.3 抗病毒作用
3,4-DCQA和3,5-DCQA具有抗呼吸道合胞体病毒(RSV)的作用,但是对流感病毒A(Flu A)、柯萨奇病毒 B3(Cox B3)及1型单纯性疱疹病毒(HSV-1)无效[20]。
DCQA同分异构体具有明显的抗HIV病毒活性,作为一种新型的整合酶抑制剂,无论是培养的细胞系还是体内整合酶催化下,DCQA都能够抑制HIV-1病毒复制[21]。 同样,1,5-O-DCQA作为已知的一种无毒的HIV-1 整合酶抑制剂,在体内和体外的多种动物模型中均表现抗病毒活性[22]。
3.4 降血糖、降血脂作用
Renalison等[23]通过肥胖模型对绿色咖啡豆的提取物和5-CQA进行筛选试验,发现5-CQA是咖啡豆的主要减肥成分。Zhang等[24]从菊科植物魁蒿叶中提取的绿原酸能显著抑制天然蛋白质酪氨酸磷酸酶1B (PTP1B) 的活性,并且能选择性地抑制PTPs同工酶的作用,说明绿原酸可能成为潜在的肥胖症、糖尿病治疗药物。
3.5 保肝作用
咖啡酰奎宁酸类化合物普遍存在于具有保肝作用的草药中,如茵陈、旋覆花等具有显著抗肝炎,抗肝纤维化的作用。从具有保肝作用的Inula crithmoides 根中分离得到的3,5-二咖啡酰奎宁酸甲酯、4,5-二咖啡酰奎宁酸甲酯及1,5-二咖啡酰奎宁酸能降低大鼠SGOT、SGPT、ALP和胆红素水平,说明具有保肝活性[4]。Shi等[25]发现绿原酸能够抑制四氯化碳诱导的肝纤维化,其机制可能为抑制TLR4/MyD51/NF-κB信号通路。
Kim等[26]发现从山莴苣中提取出的3,4-DCQA、3,5-di-O-caffeoyl-muco-quinic acid和5-O-(E)-p-coumaroylquinic acid能抑制乙肝病毒病毒颗粒的释放,显著降低细胞内乙肝病毒 DNA水平,表明它们可能为潜在的抗乙肝病毒化疗药物。
3.6 神经保护作用
1,5-DCQA对1-甲基-4-苯基吡啶离子(MPP+)诱导的大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)氧化应激损伤具有浓度依赖性的抑制作用,并抑制α-synuclein的过表达[27]。1,5-DCQA对缺血再灌注诱导的大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)损伤具有保护作用,能够通过减轻氧化应激、保护线粒体功能,减轻缺血再灌注诱导的PC12细胞损伤[28]。
3,5-DCQA能够促进人神经母细胞瘤细胞(SH-SY5Y细胞)中磷酸甘油酸酯激酶1(PGK1)的mRNA表达,提高细胞内ATP水平,从而发挥对神经元的神经保护作用[29]。李春雨等[30]发现3,5-DCQA对大鼠试验性局灶性脑缺血-再灌注损伤模型具有保护作用,能降低血清中丙二醛(MDA)水平,增强总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)的活性。此外,3,4-DCQA、3,5-DCQA和绿原酸能保护视网膜神经节细胞(RGC-5),抑制小鼠前脑匀浆的脂质过氧化,防止氧化应激诱导的神经毒性[31]。
3.7 抗肿瘤作用
绿原酸对肝癌、肺癌、胃癌、口腔癌、白血病、乳腺癌、鼻咽癌、结肠癌、宫颈癌、黑色素瘤、皮肤癌等发病率较高的肿瘤均表现出较好的防治效果[32]。试验发现,绿原酸在缺氧条件下能降低人肝癌细胞株Hep3B中HIF-1a的水平,从而降低了HIF-1a的表达[33]。
3.8 心血管保护作用
研究表明,DCQA能够抑制血小板聚集。治疗心脑血管疾病时,含有一定量的DCQA灯盏细辛注射液等中成药经常与阿司匹林联合使用,疗效显著[34]。5-CQA能够保护1型对氧磷脂酶(PON-1)活性,防止低氧化氯引起的高密度脂蛋白(HDL)的对氧磷脂酶失活,可能具有心脏保护作用[35]。
5-CQA能够抑制P-选择素[36]。P-选择素是一种1型跨膜糖蛋白,常常作为一种血小板激活的生物标记,能够与P-选择素配体1(PSGL-1)结合,参与血小板-白细胞及血小板-内皮细胞的作用中。
3.9 止咳化痰作用
吴琪珍等[14]通过小白鼠氨水引咳试验发现,款冬花中提取出的绿原酸、3,4-DCQA、3,5-DCQA和4,5-DCQA四种咖啡酰奎宁酸类化合物均能延长小鼠咳嗽潜伏期,降小鼠咳嗽次数,其中混合物抑制率最高,为61.7%。此外,小鼠注射酚红后,给药组酚红排泌浓度显著降低,说明咖啡酰奎宁酸类化合物具有一定的化痰效果。
4 小结
咖啡酰奎宁酸类成分在植物中广泛存在,主要是由CQA、DCQA和TCQA组成。这些化合物由许多同分异构体组成,容易发生异构化。然而多数药理试验结果表明,咖啡酰奎宁酸类的药理活性不仅跟与奎宁酸所连接的个数有关,而且与绝对构型密切相关,不同异构体的药理活性效果不同。因此,如何能得到单一的稳定的化合物也是该类化合物的研究重点。咖啡酰奎宁酸类化合物对当前人们所关注的病症有极大的潜力,如降血糖、降血脂、抗肿瘤等。研究该类化合物的作用机制,结合药理试验应用于临床中,对未来医学的研究具有深远的意义。

