醒脑静注射液对颅脑外伤大鼠脑细胞凋亡及相关凋亡蛋白影响的研究
赵军苍,王献明,张莹莹,郭宏盛
(河北省邯郸市中心医院,河北 邯郸 056001)
颅脑外伤是急诊外科常见的急危重症,其中70%~80%是交通事故造成的,另一部分是意外伤害导致的。颅脑外伤是目前青壮年死亡和致残的主要原因,也是备受社会关注的公共卫生问题。依据颅脑外伤发生的时间先后,可将其分为原发性和继发性。原发性颅脑外伤是指创伤发生的瞬间,暴力直接作用于脑组织所造成的机械损伤;继发性颅脑外伤是损伤发生数小时后,由于脑组织缺氧、缺血、水肿、大量自由基生成、炎性递质释放、凋亡蛋白基因过度表达等因素导致的。继发性颅脑外伤不仅在脑损伤的发病机制中占有重要地位,而且对患者预后有很大影响。细胞凋亡是由基因控制的、细胞自主有序的死亡,它涉及一系列基因的激活、表达及调控[1]。近年来研究表明,细胞凋亡是继发性颅脑外伤主要的细胞死亡方式,脑外伤后,各种刺激信号可导致多种病理生理因子的表达,通过多种途径诱导神经细胞凋亡[2]。目前,颅脑外伤抗细胞凋亡治疗的研究仍处于初始阶段,大部分只限于基础实验。醒脑静注射液是一种复方中药制剂,已经开始用于颅脑外伤的临床治疗,并显示出一定的疗效。本实验通过建立SD大鼠颅脑外伤模型,观察了脑组织细胞凋亡情况及醒脑静注射液对脑细胞凋亡的影响,旨在为颅脑外伤的临床治疗探索新的思路和方法。
1 实验资料
1.1实验动物 SPF级健康成年SD大鼠108只(雌雄不拘),体质量250~300 g,由河北医科大学实验动物中心提供,动物合格证号:SCXK(冀)2016-0004。
1.2材料及试剂 醒脑静注射液(无锡济民可信山禾药业股份有限公司生产,国药准字Z32020563);SABC免疫组化染色试剂盒、兔抗鼠Fas多克隆抗体、兔抗鼠Fas-L多克隆抗体、兔抗鼠Caspase-3多克隆抗体(均购自南京建成生物工程研究所);原位末端标记(TUNEL)试剂盒(武汉博士德生物工程有限公司生产)。自由落体颅脑损伤器具、离心机、XSZ-4显微手术电钻、-85 ℃超低温冰箱、彩色病理图文分析系统、电热恒温水箱等。
1.3分组、造模及干预 将108只SD大鼠按随机数字表法分成假手术组、损伤组、醒脑静组,每组36只。损伤组和醒脑静组采用Feeney’s自由落体脑损伤装置造模,该装置由支架、撞击杆、下落击锤三部分组成。大鼠乙醚麻醉后,剪去头部皮毛,俯卧位固定于平台上,用碘伏消毒头顶皮肤,将头皮沿正中线矢状切开,用止血钳分离皮下组织和骨膜,充分暴露颅骨前囟区域,以中线旁2.5 mm、矢状缝后1.5 mm为中心,用手术电钻磨一直径约5 mm骨窗,注意止血,避免损伤硬脑膜并保持其外形完整。将撞击杆的头端对准骨窗,用质量为50 g的击捶从30 cm处自由落下打击骨窗,保持硬膜完整,造成严重的脑损伤,随后用骨蜡封闭骨窗,缝合头皮。假手术组仅做头皮切开、颅骨开窗和清创缝合处理。醒脑静组在脑打击后5 min内腹腔注射醒脑静20 mL/kg,假手术组和损伤组大鼠注射等量0.9%氯化钠溶液,均每天1次,直至取标本。造模完成后,把大鼠放入饲养笼内,隔离喂养,避免清醒后相互撕咬,并放置充足的水源和食物。
1.4取材及样品制备 在实验第1,3,5,7,14,21天清晨,每组各随机取出6只空腹大鼠,行乙醚麻醉后,处死并置于冰上取出全脑组织, PBS缓冲液冲洗,4%中性甲醛固定,保存于4 ℃冰箱,选取挫伤周围区域约5.0 mm的脑组织石蜡包埋,连续切片,层厚5.0 μm,以备HE染色、免疫组化染色及TUNEL染色。
1.5脑组织病理观察 选取HE染色切片进行光镜下观察。
1.6脑组织中Fas、Fas-L、Caspase-3蛋白表达检测 严格按照SABC试剂盒操作说明进行免疫组化染色:取出大鼠脑组织石蜡切片,平铺于多聚赖氨酸玻片,在60 ℃的恒温箱内固定1 h,室温下3%H2O2孵育10 min,灭活内源性过氧化物酶的活性,高压抗原热修复,羊血清工作液封闭,滴加兔抗鼠一抗工作液,4 ℃ 孵育过夜,PBS液冲洗3次×5 min,滴加适量生物素标记二抗工作液,37 ℃孵育30 min,PBS液再次冲洗3次×5 min,滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min,PBS冲洗3次×5 min,二氨基联苯胺(DAB)显色剂反应染色,自来水充分冲洗。从每组选取切片5张,每张切片任意选取10个完整并且不重叠的高倍视野。结果判定:以细胞核和/或细胞质出现棕黄色颗粒或斑片为阳性细胞,用光学显微镜观察并拍照,并采用Image-Pro Plus(IPP)7.0图像分析系统测定各个视野内的平均吸光度值,然后进行统计学处理。
1.7脑细胞凋亡检测 采用TUNEL法标记,严格参照说明书操作:将含有脱氧核苷酸末端转移酶(TdT)的TUNELⅠ液和生物素标记X-dUTP的TUNELⅡ液,按1∶9混合并摇匀,每玻片滴50 μL,常温下孵育30 min,在TdT的作用下,生物素标记X-dUTP被给合至凋亡细胞DNA断裂后形成3’-OH末端,然后把辣根过氧化物酶标记的链霉亲和素结合到X-dUTP上,最后加入底物,通过DAB显色剂显色。结果判定:细胞核出现棕黄色或棕红色颗粒为阳性细胞,每张切片随机选取5个完整不重叠的视野,在10×40倍荧光显微镜下观察,采用MoticMed6.0图像分析系统进行处理,计算出阳性细胞平均积分光密度值。

2 结 果
2.13组大鼠脑组织病理学变化 假手术组变化不明显,光镜下观察可见脑组织形态结构均正常,细胞质和细胞核清晰可见,细胞结构完整,排列有序,无充血、水肿、空泡变性、坏死以及胶质细胞增生等情况发生。损伤组损伤第1天光镜下见大脑皮质表面不连续,细胞排列紊乱,形态结构异常,胞质肿胀、结构不清,随着时间延长,细胞损伤逐渐加重,细胞结构更加紊乱,胞质出现空泡变性,线粒体受损严重,粗面内质网颗粒脱落,细胞核溶解、破裂,上述变化以第5天最重,见图1;14 d以后细胞水肿逐渐减轻。醒脑静组脑组织病理结构损伤明显减轻,第3天脑组织细胞轻度水肿;第5天胞核固缩,细胞内虽有空泡变性、线粒体损伤,但较损伤组明显减轻,见图2。
2.23组大鼠脑组织中Fas、Fas-L和Caspase-3蛋白表达情况 假手术组中,Fas、Fas-L和Caspase-3蛋白在脑细胞中多不表达或微弱表达;损伤组和醒脑静组中,Fas、Fas-L和Caspase-3蛋白主要表达于伤侧大脑半球损伤区及周围水肿区域。损伤第1天,损伤组和醒脑静组脑组织中即有Fas、Fas-L和Caspase-3明显表达;损伤第3天,Fas 表达达高峰,其后逐渐下降;损伤第5天,Fas-L和Caspase-3表达达高峰,其后逐渐下降。损伤组各时间点和醒脑静组第1—14天上述指标均明显高于假手术组(P均<0.05),醒脑静组第3—21天Fas蛋白表达量和各时间点Fas-L、Caspase-3蛋白表达量均明显低于损伤组(P均<0.05)。见表1~3。

图1 损伤组损伤第5天光镜下表现(HE,×400)

图2 醒脑静组损伤第5天光镜下表现(HE,×400)
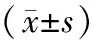
表1 3组大鼠各时间点脑组织中Fas表达情况
注:①与假手术组比较,P<0.05;②与损伤组比较,P<0.05。
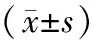
表2 3组大鼠各时间点脑组织中Fas-L表达情况
注:①与假手术组比较,P<0.05;②与损伤组比较,P<0.05。
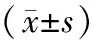
表3 3组大鼠各时间点脑组织中Caspase-3表达情况
注:①与假手术组比较,P<0.05;②与损伤组比较,P<0.05。
2.33组大鼠脑细胞凋亡情况 光镜下观察,凋亡主要发生在损伤区域及周围水肿区域,细胞皱缩,细胞核为黄色颗粒状或条块状,多数为神经元细胞,也有少量神经胶质细胞及血管内皮细胞。假手术组无凋亡细胞或少量细胞凋亡。损伤第7天,损伤组和醒脑静组细胞凋亡率达高峰,此后逐渐下降。损伤组各时间点和醒脑静组第1—14天脑细胞凋亡率均明显高于假手术组(P均<0.05),醒脑静组第3—21天脑细胞凋亡率均明显低于损伤组(P均<0.05)。见表4。
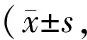
表4 3组大鼠各时间点脑细胞凋亡情况%)
注:①与假手术组比较,P<0.05;②与损伤组比较,P<0.05。
3 讨 论
颅脑外伤后由于损伤造成大量炎性细胞因子、乳酸、自由基等物质堆积于伤灶局部,引起能量失调和氧化应激,进而导致细胞死亡。细胞死亡一般分为坏死和凋亡。细胞坏死是早已被认识到的一种细胞死亡方式,而细胞凋亡则是近年来逐渐被认识的一种细胞死亡方式,又称程序性细胞死亡。已有研究证实,颅脑外伤早期脑组织细胞的坏死是由直接损伤导致的,随后出现的继发性脑损伤既有坏死也有凋亡的参与[3]。直接损伤导致的坏死虽然不可修复,但可以通过调控细胞凋亡而阻止继发性脑损伤的进展。
脑外伤后,由于暴力打击以及应激反应等因素,脑血流调节出现异常,脑组织缺氧缺血,造成细胞膜、线粒体膜等生物膜功能障碍,导致神经细胞能量代谢异常、大量自由基产生、细胞内钙超载、脂质过氧化反应,这些因素均可启动凋亡调控基因的表达,使细胞进入凋亡过程[4]。凋亡调控基因所表达的蛋白中就包括Caspase-3、Fas、Fas-L等调控因子。研究发现,脊椎动物细胞的凋亡主要有2种方式,一种是依赖Caspase家族的调控,另一种不依赖Caspase家族的参与[5]。根据启动因子的不同,Caspase通路又分为2种:①Fas/Fas-L启动的死亡受体通路,该通路通过活化Caspase-8,进一步激活其下游的效应因子Caspase-3,诱导细胞凋亡。②线粒体凋亡通路,该通路在受到凋亡信号的刺激下,线粒体内膜上细胞色素C脱落,与凋亡活化因子-1结合形成凋亡复合体活化Caspase-9, 进而激活其下游因子Caspase-3、Caspase-6、Caspase-7,启动级联反应的凋亡程序。由此可见,Caspase-3在细胞凋亡中起关键作用,在整个凋亡过程中处于核心地位,是细胞凋亡的最终执行者。细胞凋亡的过程是Caspase家族参与的蛋白酶级联反应,当Caspase-3被激活后,对不同的底物蛋白进行切割,这些蛋白降解产物不仅会引起线粒体通透性发生改变,还可导致细胞骨架蛋白断裂、DNA修复蛋白裂解,干扰细胞DNA复制和修复,损伤细胞核的结构,从而使细胞最终出现符合凋亡改变的生化和形态学特征。
研究表明,在传递凋亡信号的通路中,死亡受体通路被认为是经典的传递通道。凋亡信号传到细胞内部是通过死亡配体(如Fas-L、TRAIL、TNF-α、sPD-1等)与细胞膜上相应的受体(如Fas、TNF-R1、DR3、DR4、DR5和RANK等)结合,启动凋亡程序,诱导细胞凋亡[6]。死亡受体/配体家族的共同点是在细胞内存在特异性结构域,该结构域可特异性的激活Caspase[7]。已有的实验显示,Fas/Fas-L是重要的启动死亡受体通路的复合物[8]。Fas蛋白为I型跨膜蛋白,分子量为45 kDa,属于肿瘤坏死因子受体(TNFR)/神经生长因子受体(NGFR)家族成员,包括3个半胱氨酸基团,半胱氨酸基团是细胞外配体的识别位点。受体Fas广泛分布于许多正常细胞以及激活的T、B淋巴细胞上,在好多系统都可以检测到Fas的表达。Fas-L是Fas的天然配体,分子量为40 kDa,属于Ⅱ型膜蛋白,也是TNFR/ NGFR家族成员,Fas-L有可溶性和膜结合性2种形式,均可与Fas受体结合。Fas在细胞内有氨基酸伸展链称之为死亡域(Dead Domain,简称DD)。当Fas-L与Fas分子结合后,导致Fas相互聚集形成三聚体复合物,进一步使细胞内的DD募集,从而形成活化的Fas相关蛋白(FADD),FADD作为调试蛋白,在Fas及其下游分子前半胱天冬氨酸蛋白酶8 (Pro-caspase-8)之间起桥梁作用,负责激活Pro-caspase-8,活化的Caspase-8释放到细胞质中,通过直接/间接途径活化或裂解其下游的Caspases家族成员,如Caspase-1、Caspase- 3、Caspase- 6、Caspase- 7,激活的Caspases通过对底物蛋白的水解把凋亡信号从细胞外传递到细胞内,或者直接作为凋亡的效应分子降解细胞骨架、切割DNA使之成为寡聚核苷酸片段,染色质浓缩,细胞凋亡[9]。
本实验结果显示,损伤组伤后第1天即出现脑细胞凋亡和Fas、Fas-L、Caspase-3蛋白表达,脑细胞凋亡第7天达到高峰,Fas蛋白表达第3天达高峰,Fas-L和Caspase-3蛋白表达第5天达高峰,此后缓慢下降,上述这些变化均符合继发性脑损伤的病理生理机制。
尽管许多重要的凋亡蛋白已被证实,但对凋亡发生的分子机制仍未完全阐明,因此也对颅脑外伤的治疗提出了挑战。醒脑静注射液主要成分包括栀子、麝香、郁金、冰片等,其中麝香芳香开窍;冰片可以改善血脑屏障的通透性,兴奋呼吸中枢,提高血氧分压;栀子清热开窍,具有降压、止血、脱水作用;郁金化痰开窍,行气解瘀通经络。整个方剂具有清热凉血、醒神止痉、解毒止痛、行气活血的功效[10]。现代药理学研究显示,醒脑静注射液可通过血脑屏障直接作用于中枢神经系统,改善微循环,减轻水肿,改善脑细胞的缺氧缺血状态,减轻细胞炎性反应,清除氧自由基,抑制细胞凋亡,对受损部位的神经细胞发挥修复和保护作用[11]。杨超等[12]在常规西药治疗基础上加用醒脑静注射液治疗急性脑外伤合并意识障碍患者40例,结果治疗后GCS评分及NIHSS评分明显好转,预后良好。张红等[13]用自由落体方法制造脑外伤大鼠模型观察凋亡调节蛋白c-fos的表达情况,发现外伤组及醒脑静组造模24 h后均检测到c-fos蛋白的高表达,但是醒脑静组c-fos蛋白表达量明显低于外伤组,证实醒脑静注射液可抑制损伤细胞的凋亡。本实验结果显示,醒脑静组各时间点Fas-L、Caspase-3蛋白表达量和第3—21天Fas蛋白表达量和细胞凋亡率均明显低于损伤组,进一步证实了醒脑静注射液可通过抑制凋亡调节蛋白从而起到抑制凋亡的作用。
综上所述,Fas、Fas-L和Caspase-3蛋白参与了颅脑外伤大鼠脑细胞损伤过程;醒脑静注射液干预可明显减少颅脑外伤大鼠脑细胞的凋亡,降低Fas、Fas-L和Caspase-3蛋白的表达,其可能是通过影响信号转导的死亡受体通路发挥作用的,但其涉及哪些分子调控及信号转导的具体路径还有待进一步研究探讨。
[]
[1] Jia LT,Chen SY,Yang AG. Cancer gene therapy targeting cellular apoptosis machinery[J]. Cancer Treat Rev,2012,38(7):868-876
[2] Logue SE,Cleary P,Saveljeva S,et al. New directions in ER s-tress-induced cell death[J]. Apoptosis,2013,18(5):537-546
[3] Huang X,Lu Z,Lv Z,et al. The Fas/Fas-L Ligand death receptor pathway contributes to phenylalanine-induced apoptosis in cortical neurons[J]. PLoS One,2013,8(8):71553
[4] 姜交德,刘运生,方文华. 鼠脑外伤后人工脑脊液灌洗对 ERK 通路和神经细胞凋亡的影响[J]. 中南大学学报:医学版,2014,39(11):1111-1117
[5] 赵彦超,顾耘. 细胞凋亡通路研究进展[J]. 现代医学,2013,41(4):285-288
[6] 王海燕,王来栓. 细胞凋亡通路研究进展[J]. 国外医学·生理、病理科学与临床分册,2003,23(5):490-492
[7] 谷牧宇,孙殿军. Fas/FasL信号通路与砷致神经系统损伤[J]. 中华地方病学杂志,2017,36(3):231-234
[8] Lavrik IN. Regulation of death receptor-induced apoptosis induced via CD95/FAS and other death receptors[J]. Mol Biol(Mosk),2011,45(1):173-179
[9] 周琼. 丁苯肽联合亚低温对大鼠局灶性脑缺血再灌注损伤后Caspase-3表达的影响研究[J]. 中外医学研究,2014,12(25):151-152
[10] 郭宗泽,曹春阳,杨毅,等. 醒脑静粉针对实验性脑外伤的保护作用[J]. 沈阳药科大学学报,2006,23(6):384-387
[11] 李俊芳. 醒脑静注射液的药理分析研究[J]. 中国药物经济学,2014,9(1):48-49
[12] 杨超,陈光明,雷鹏,等. 醒脑静治疗急性脑外伤合并意识障碍的疗效分析[J]. 中西医结合心血管病电子杂志,2016,4(26):85-86
[13] 张红,朱志安,陈鑫,等. 醒脑静注射液对大鼠脑外伤后脑组织c-fos基因表达的影响[J]. 药学服务与研究,2002,2(4):246-248

