温针灸对膝骨关节炎SD大鼠软骨中TNF-α和MMP-3的影响
宋昳星,郭冬梅
(新疆医科大学附属中医医院,新疆 乌鲁木齐 830000)
膝骨关节炎是一种以疼痛为早期表现,随着时间的延长,可以出现关节僵硬、肿胀以及屈伸功能异常,并最终导致关节变形、行走功能丧失的慢性退行性疾病。该病的发病机制尚不明确,其中年龄、运动习惯、体质量以及遗传等因素均与其发生和发展有关[1],而软骨的退行性改变是该病发生的核心所在,且炎症细胞因子损伤机制逐渐受到重视[2]。炎症细胞因子主要包括肿瘤坏死因子、基质金属蛋白酶、白细胞介素以及一氧化氮等,目前对肿瘤坏死因子-α(TNF-α)和基质金属蛋白酶-3(MMP-3)的研究最多,前者主要由单核吞噬细胞产生,对软骨细胞具有较强的分解作用,可抑制软骨基质合成[3];后者在正常生理状态下主要以基质蛋白酶原的形式存在,但在膝骨关节炎患者中,其被过度激活,导致软骨细胞外基质蛋白分解酶过度激活,从而加速了软骨的分解和代谢,加速软骨损伤[4]。目前西医多以对症治疗为主,早期主要以患者教育、功能锻炼为主,中期主要以镇痛、消炎为主,后期则主要以关节腔注射药物、腔镜手术为主[5-6]。中医将本病归为“痹证”“筋痹”“骨痹”的范畴,治疗上有方药内治、方药外治以及针灸治疗等方法,其中针灸疗法作为中医外治的主要方法,具有操作简单、疗效确切、价廉的特点,非常适合本病的早期治疗[7],但作用机制不明确。本研究通过动物实验,观察了温针灸对膝骨关节炎SD大鼠行为学以及软骨中TNF-α和MMP-3的影响,旨在为该病的临床治疗提供依据。
1 实验资料
1.1实验动物 清洁级雄性SD大鼠90只,体质量200~250 g,由山东中医药大学动物实验室提供,合格证号:SCXK(鲁)2014-0025。所有动物饲养于我院实验动物实验室,饲养温度保持在(22±2)℃,湿度(60±10)%,敏感周期为12 h。自由摄水,标准饲料适应性喂养1周。
1.2主要试剂和仪器 水合氯醛(广州化学试剂厂,批号:20160223-3);苏木精染料(天津化学试剂厂,批号:20160305-6);甲醛(北京普博欣科技有限公司,批号:20150105-6);二甲苯(天津化学试剂厂,批号:20160316-1);TNF-α试剂盒(美国Sigma公司生产,购自北京定国化学生物技术有限公司,批号:LOT#035M1523V);MMP-3试剂盒(美国Sigma公司生产,购自北京定国化学生物技术有限公司,批号:LOT#113M3652V);离心机(德国制造,型号:5810R);石蜡包埋机(浙江金华益迪制造,型号:YD62);切片机(美国制造,型号:RM2235);760日立全自动生化仪(日本制造);放射免疫测量仪(中国制造,型号:SN-682)。
1.3分组、造模及干预 将喂养1周后SD大鼠随机分为正常组、模型组和针灸组,每组30只。模型组和针灸组大鼠参照文献[8]采取关节腔注射木瓜酶法复制右膝关节炎模型,并于造模后第4周测量左右膝关节厚度,若右膝关节较左侧肿胀大于20%,则视为造模成功。本实验中大鼠全部造模成功。然后针灸组给予温针灸治疗,选取血海、阳陵泉、内膝眼为主穴,穴位位置参照《实验针灸学》[9]。血海位于右后肢髌骨底与髌骨内侧连线上方约0.8 cm处;阳陵泉位于腓骨头下方凹陷处;内膝眼位于后肢髌骨下方,髌骨韧带内侧凹陷处。针刺前,大鼠板固定后进行穴位定位,采用太和牌0.22 mm×0.25 mm一次性针灸针,每穴刺入3~5 mm,采用平补平泻手法上下提插5次后,于针柄处粘贴一蚕豆大艾柱后点燃,持续10 min,连续针灸2周。正常组和模型组大鼠不给予任何干预。
1.4观察指标
1.4.1大鼠行为学表现 干预前后采用改良版Lequesne MG量表评估大鼠行为学表现,主要评估内容包括大鼠局部疼痛度、步态、关节肿胀情况以及关节活动范围。疼痛程度:无疼痛记0分;患肢出现收缩记1分;患肢收缩同时伴有轻度全身反应记2分;患肢聚类收缩,伴有全身颤抖甚至挣扎记3分。步态:大鼠正常行走记0分;轻度跛行,触地有力记1分;患肢参与行走,但跛行明显记2分;患肢不能参与行走记3分。关节肿胀程度:无肿胀记0分;轻度肿胀,骨性标记线变浅记1分;重度肿胀,骨性标记线消失记2分。关节活动范围:90°以上且无明显疼痛反应记0分;45°~90°且无明显疼痛反应记1分;15°~45°且无明显疼痛反应记2分;<15°且无明显疼痛反应记3分。
1.4.2大鼠软骨组织中TNF-α和MMP-3含量实验结束时采用空气栓塞法将所有大鼠处死后固定于手术台,将右后肢伸直以固定膝关节,备皮后剥离皮肤及皮下组织,暴露膝关节后,使用眼科剪与小刀片切取膝关节面软骨约20 mg,生理盐水冲洗干净后分为2份,一份标本放置于4%的甲醛中固定进行HE染色切片;另一份放置于1.5 mL试管中加入5 mL生理盐水,离心取上层清液,按照TNF-α和MMP-3试剂盒说明书,采用放射免疫法检测TNF-α和MMP-3含量。

2 结 果
2.13组大鼠干预前后Lequesne MG评分比较干预前,模型组和针灸组Lequesne MG评分均显著高于正常组(P均<0.05)。干预结束后,模型组和针灸组评分均显著下降(P均<0.05),且针灸组评分明显低于模型组(P<0.05)。见表1。
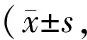
表1 3组大鼠干预前后Lequesne MG评分比较分)
注:①与正常组比较,P<0.05;②与干预前比较,P<0.05;③与模型组比较,P<0.05。
2.23组大鼠膝关节组织病理学表现 正常组大鼠膝关节组织未发现病理改变,关节软骨表面光滑完整,各层软骨细胞排列紧密有序,见图1;模型组大鼠膝关节面粗糙不平,部分地方出现病理性裂隙,中间可见坏死性软骨组织,周围可见增生细胞及炎症细胞,见图2;针灸组大鼠膝关节病变范围小于模型组,其水肿程度、炎症浸润及坏死程度均轻于模型组,少数坏死组织区内可见新生的软骨细胞和纤维组织,见图3。

图1 正常组大鼠膝关节组织镜下表现

图2 模型组大鼠膝关节组织镜下表现

图3 针灸组大鼠膝关节组织镜下表现
2.33组大鼠膝关节组织中TNF-α、MMP-3含量比较 模型组及针灸组大鼠膝关节组织中TNF-α、MMP-3含量均明显高于正常组(P均<0.05),但针灸组TNF-α、MMP-3含量均明显低于模型组(P均<0.05)。见表2。
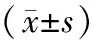
表2 3组大鼠膝关节组织中TNF-α、MMP-3含量比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
3 讨 论
目前膝骨关节炎的动物模型有很多,然而由于膝骨关节炎的发病机制十分复杂,多种因素均参与其中,故现有的动物模型均很难模拟膝骨关节炎的发病全过程,只是模拟了其中的一点或者一段过程[10]。木瓜蛋白酶可以使软骨基质中的多种蛋白进行分解,使蛋白多糖从软骨基质中丢失,激活骨关节的炎症反应,造成类骨关节炎的病理状态,故木瓜蛋白酶造模是目前常用的膝骨关节炎造模法之一,且成功率较高[11-12]。本研究也采用该法造模,结果均造模成功。
中医认为膝骨关节炎病因主要为肝肾不足,气血亏虚,适逢外感风寒或跌打损伤等,导致局部经络不通,不通则痛,故在治疗上宜滋补肝肾、温经通络[13]。《黄帝内经》中有云“腧穴所在,主治所及”,故本研究中取血海、阳陵泉、内膝眼三穴以疏通局部经络,恢复关节内环境平衡。血海为足太阴脾经之穴,具有滋补脾肾、益气活血之功效,为“治血要穴”,临床上常用来疏通局部经络,濡养关节,达到通则不痛、荣则不痛的目的;阳陵泉属于足少阳胆经,为八会穴之一的“筋会”,“膝为筋之府”,故选取此治筋穴以治骨病;内膝眼为治疗骨痹之经验用穴,常配合外膝眼进行透刺,但因大鼠膝关节较小难以操作,故单用此穴以促进膝关节周围气血的运行。《素问·痹论》中有“痛者,寒气多也”,提示疼痛的发生多与寒气侵蚀有关。而温针灸是一种将针刺和艾灸结合的治疗方法,具有温经散寒、通络止痛的双重作用,因此常被用来治疗膝骨关节炎[14-16]。本研究结果显示,干预结束后,模型组和针灸组Lequesne MG评分显著下降,且针灸组明显低于模型组。进一步病理观察发现,正常组大鼠膝关节组织未发现病理改变;模型组大鼠膝关节中可见广泛的病理性改变;针灸组大鼠膝关节病变范围少于模型组,且水肿程度、炎症浸润及坏死程度均轻于模型组,少数坏死组织区内可见新生的软骨细胞和纤维组织。上述结果提示温针灸不仅可改善膝骨关节炎的临床症状,而且可减轻骨关节病理改变,这与文献[17]报道相一致。
细胞因子在人体中是一种免疫调节因子,在人体各项功能中发挥着重要作用。在膝骨关节炎中,软骨细胞异常分泌了多种细胞炎症因子,这些因子被释放至细胞外基质,导致基质细胞内代谢平衡被打破,抑制软骨细胞生成的同时加速了软骨细胞的凋亡。本研究结果显示,模型组及针灸组软骨组织中TNF-α、MMP-3含量均明显高于正常组,但针灸组TNF-α、MMP-3含量均明显低于模型组。提示温针灸可能通过降低软骨细胞中TNF-α、MMP-3含量,从而起到治疗本病的作用。
综上所述,温针灸可以改善膝骨关节炎SD大鼠软骨形态,具有改善软骨退变和保护软骨的作用,可能是通过降低软骨细胞中炎症因子TNF-α、MMP-3含量来实现的。然而本次实验仅仅测定了实验结束后的TNF-α、MMP-3含量,未能对上述指标进行动态监测,温针灸治疗膝骨关节炎的作用机制有待进一步探讨。
[]
[1] 申延清,刘风霞,曹红,等. 膝骨关节炎患者的临床表现及相关影响因素[J]. 中国组织工程研究与临床康复,2011,15(9):1643-1646
[2] Johnson VL,Hunter DJ. The epidemiology of osteoarthritis[J]. Best Pract Res Clin Rheumatol,2014,28 (1):5-15
[3] 陈益丹,邱华平,金肖青,等. 针刺对膝骨关节炎模型兔血清白介素-1β、肿瘤坏死因子-α的影响[J]. 上海针灸杂志,2010,29(7):468-470
[4] 周景辉,李石胜,吴耀持,等. 长针透刺膝骨关节炎模型大鼠滑膜组织中基质金属蛋白酶3的变化[J]. 中国组织工程研究与临床康复,2011,15(50):9415-9418
[5] Spaans AJ,van Minnen LP,Kon M,et al. Conservative treatment of thumb base osteoarthritis: A systematic review[J]. J Hand Surg Am,2015,40(1):16-21
[6] 张军,杜海军,陈军,等. 玻璃酸钠注射治疗膝关节退行性骨关节病的疗效观察[J]. 吉林医学,2013,34(23):4734-4735
[7] 王丽红,何英. 中西医治疗骨关节炎的研究进展[J]. 中国老年学杂志,2011,31(10):1923-1926
[8] Kopp S,Mejersjo C,Clemenssson E. Induction of osteoarthritis in the guinea pig knee by papain[J]. Oral Surg Oral Med Oral Pathol,1983,55(3):259-266
[9] 李忠仁. 实验针灸学[M]. 北京:中国中医药出版社,2013:327
[10] 谢希,高洁生. 骨关节炎动物模型研究进展[J]. 医学综述,2005,11(1):67-69
[11] Havdrup T,Telhag H. Papain-induced changes in the knee joints of adult rabbits[J]. Acta Orthop Scand,1977,48(2):143-149
[12] 韩冠英,凌沛学,王凤山,等. 不同浓度木瓜蛋白酶建立兔膝骨关节炎模型的比较研究[J]. 中国骨伤,2012,25(5):424-429
[13] 王建国,何丽娟. 温针灸治疗膝骨关节炎疗效观察[J]. 中国针灸,2007,27(3):191-192
[14] 刘立安,马春燕,姜文. 温针灸治疗老年性膝骨关节病的临床观察[J]. 中国针灸,2003,23(10):579-580
[15] 李俐,洪昆达,吴明霞,等. 温针灸治疗阳虚寒凝型膝骨性关节炎40例[J]. 福建中医药,2010,41(5):36-37
[16] 丁明晖,张宏,李燕. 温针灸治疗膝关节骨性关节炎:随机对照研究[J]. 中国针灸,2009,29(8):603-607
[17] Nelson AE,Allen KD,Golightly YM,et al. A systematic review of recommendations and guidelines for the management of osteoarthritis:The chronic osteoarthritis management initiative of the U.S.bone and joint initiative[J]. Semin Arthritis Rheum,2014,43(6):701-712

