Rab11对膀胱癌细胞顺铂化疗耐药性的影响及机制
宫雪,于柳,刘嘉,刘屹立,王平(中国医科大学附属第四医院,沈阳003;中国医科大学)
膀胱癌是泌尿生殖系统中最常见的恶性肿瘤,其发病率逐年升高[1,2]。约25%的初诊患者被诊断为肌层浸润性膀胱癌,其中约30%的患者存在远处转移[3]。顺铂是一种细胞毒性化疗药物,为膀胱癌治疗的一线用药,但总体预后较差[4]。化疗药物的重复给药可能造成肿瘤细胞的获得性药物抵抗,临床上约有40%的膀胱癌患者在5年内由于化疗抵抗引起肿瘤的复发[5]。因此,增强膀胱癌细胞对顺铂的敏感性是提高顺铂疗效的重要手段。小鸟苷三磷酸(GTP)酶是Rab小分子GTP酶家族成员之一,在囊泡内吞再循环过程中发挥重要作用[6,7]。近年研究发现,Rab11参与了恶性肿瘤的多项生物学进程,与结直肠癌、胃癌、乳腺癌、胰腺癌、皮肤癌等恶性肿瘤的发生发展密切相关[8~13]。Rab11能够促进膀胱癌细胞的增殖和侵袭能力,但其在肿瘤细胞顺铂耐药中的作用尚不明确。2015年12月~2016年 1月,我们观察了双向调控Rab11对顺铂干预后膀胱癌细胞凋亡及对凋亡相关蛋白B淋巴细胞瘤-2(Bcl-2)蛋白的影响,探讨Rab11在膀胱癌细胞顺铂化疗耐药性中的作用机制。
1 材料与方法
1.1 材料 人膀胱癌细胞系T24、BIU-87细胞购于美国模式培养物保藏中心(ATCC,Manassas,USA);Rab11(Proteintech,USA);Bcl-2(Cell Signaling,USA);β-actin(Santa Cruz,USA);Rab11 ONTARGETplus siRNA、阴性对照NonTargeting siRNA(Dharmacon,USA);pCMV6-Rab11质粒、阴性对照pCMV6质粒(Origene,USA);RPMI-1640培养基(Gibco,USA);10%胎牛血清(Invitrogen,USA);DMSO(Sigma,USA);ECL试剂盒(Pierce,USA);PVDF膜(Millipore,USA);DNR 成像系统(Jerusalem,Israel)。
1.2 细胞培养、分组及顺铂干预方法 将T24、BIU-87细胞加入含10%胎牛血清的RPMI-1640培养基中,37 ℃、5% CO2饱和湿度培养箱中培养,隔天换液。 取对数生长期的T24、BIU-87细胞悬液,按1×106/孔分别接种于6孔板;将T24细胞分为观察1组、对照1组,将BIU-87细胞分为观察2组、对照2组,分别加入2 μmol/L顺铂诱导凋亡,24 h后进行转染。
1.3 转染方法 在T24细胞中转染Rab11特异性siRNA,在BIU-87细胞中转染Rab11过表达质粒,并设立阴性对照。转染步骤及剂量参照说明书。采用Western blotting法检测细胞Rab11蛋白的相对表达量,以T24细胞转染后Rab11表达量降低、BIU-87细胞转染后Rab11表达量升高为转染成功。观察1组细胞转染Rab11特异性siRNA,对照1组细胞转染Control siRNA,观察2组细胞转染Rab11过表达质粒,对照2组细胞转染pCMV6质粒。
1.4 细胞存活率测算 采用CCK-8法。转染48 h后收集各组细胞,将单个细胞悬液按1×103/孔接种于96孔培养板,每孔体积200 L。培养24 h后,每孔加入10 μL CCK-8继续培养4 h,吸去上清液,加入150 μL DMSO,振荡10 min,于490 nm波长处测定各孔吸光度值。以不含细胞的等体积培养基作为对照,绘制细胞生长曲线,计算细胞存活率。
1.5 细胞凋亡率测算 采用流式细胞术。转染48 h后收集各组细胞。取5×105~10×105重悬的细胞,离心5 min,弃上清,加入195 μL Annexin V-FITC结合液重悬细胞。加入5 μL Annexin V-FITC混匀,4 ℃避光孵育15 min。加入5 μL碘化丙啶(PI)染色液,轻轻混匀,4 ℃避光孵育5 min。随即进行流式细胞仪检测,Annexin V-FITC 为绿色荧光,对应BD 流式细胞仪FL1检测通道;碘化丙啶(PI)为红色荧光,对应BD 流式细胞仪FL2检测通道。计算细胞凋亡率。
1.6 细胞Bcl-2蛋白表达检测 采用Western blotting法。转染48 h后收集各组细胞,加入Pierce裂解缓冲液提取总蛋白,目标蛋白定量参照BCA方法,上样量为20 g,电泳,转膜,孵育一抗Bcl-2(1∶1 000),4 ℃过夜,二抗37 ℃孵育2 h,ECL发光。通过凝胶分析系统扫描目的条带和内参的灰度比,作为Bcl-2蛋白的相对表达量。
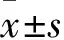
2 结果
2.1 各组细胞存活率比较 观察1组细胞存活率低于对照1组,观察2组细胞存活率高于对照2组(P均<0.05)。见表1。
2.2 各组细胞凋亡率比较 观察1组细胞凋亡率高于对照1组,观察2组细胞凋亡率低于对照2组(P均<0.05)。见表1。
2.3 各组细胞Bcl-2蛋白表达比较 观察1组细胞Bcl-2蛋白表达低于对照1组,观察2组细胞Bcl-2蛋白表达高于对照2组(P均<0.05)。见表1。
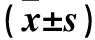
表1 各组细胞存活率、凋亡率及Bcl-2蛋白表达比较
注:与对照组1比较,*P<0.05;与对照组2比较,﹟P<0.05。
3 讨论
膀胱尿路上皮癌是膀胱癌最常见的类型,其发病率逐年升高,是泌尿生殖系统中致死性最强的恶性肿瘤。顺铂是一种细胞毒性化疗药物,其抗肿瘤机制主要是引起肿瘤细胞DNA损伤,进而促进肿瘤细胞凋亡[14~16]。以顺铂为基础的化疗方案对晚期膀胱癌患者具有十分重要的治疗作用,但其总体预后较差,顺铂耐药是其中最重要的原因。因此,探讨增强膀胱癌细胞对顺铂的敏感性、逆转耐药性方法,对晚期膀胱癌的治疗具有非常重要的临床意义。
Rab蛋白是囊泡内吞过程中的一个重要因素。 Rab11蛋白是小GTP酶,并调节蛋白质运输,囊泡运输,参与细胞迁移和肿瘤形成等生物学行为,Rab11的高表达能促进多种肿瘤细胞的增殖、侵袭和迁移。Chung等[8]研究发现,Rab11的高表达可通过增加E-钙黏蛋白的表达量来促进集合细胞的迁移,并与结直肠癌的不良预后有关。Rab11相互作用蛋白2在结直肠癌组织中表达上调,可调节基质金属蛋白酶7的表达,促进结直肠癌细胞的侵袭和迁移[9]。Rab11相互作用蛋白2的高表达与胃癌组织中的淋巴结转移相关[10]。Rab11相互作用蛋白3与再循环内体有关,并通过调节肌动蛋白细胞骨架来调节乳腺癌细胞运动[11]。Rab11相互作用蛋白4的高表达可以预测胰腺癌患者的不良预后,并与肿瘤进展有关[12]。这些研究表明,Rab11可能是人类肿瘤中潜在的癌蛋白,参与肿瘤形成、肿瘤进展。本课题组前期研究发现,Rab11在膀胱癌组织中高表达,其机制为通过NF-κB信号通路促进膀胱癌细胞的增殖和侵袭。本研究进一步探讨Rab11在膀胱癌细胞顺铂化疗耐药性中的作用和机制。本研究发现,观察1组细胞存活率低于对照1组,观察2组细胞存活率高于对照2组;提示抑制Rab11表达可以减少膀胱癌细胞的存活率,而过表达Rab11可以增加膀胱癌细胞的存活率;观察1组细胞凋亡率高于对照1组。观察2组细胞凋亡率低于对照2组;提示抑制Rab11表达可以增加膀胱癌细胞的凋亡率,过表达Rab11可以降低膀胱癌细胞的凋亡率。本研究结果表明,Rab11能明显减少顺铂诱导的膀胱癌细胞凋亡、增加肿瘤细胞存活率,增强膀胱癌细胞对化疗药物顺铂的耐药性。
Bcl-2基因是重要的凋亡抑制基因,可以抑制内膜钙离子的释放;具有抗氧化的作用或抑制氧自由基的产生;阻止胞内细胞色素C的释放;通过抑制白介素-1β转化酶(ICE)的自身催化而抑制凋亡。Bcl-2和NF-κB的表达有相关性,Bcl-2大多数与NF-κB同时表达。NF-κB通过上调Bcl-2基因表达,抑制肿瘤细胞凋亡。Tamatani等[17]发现,在神经元低氧/氧再灌注处理中,NF-κB的活化诱导Bcl-2过度表达,阻止低氧/氧再灌注后凋亡细胞增多。本研究发现,观察1组细胞Bcl-2蛋白表达低于对照1组,观察2组细胞Bcl-2蛋白表达高于对照2组,提示抑制Rab11可显著减少凋亡抑制因子Bcl-2的表达,而过表达Rab11可明显增加Bcl-2蛋白的表达,表明Rab11能够通过调节凋亡相关蛋白Bcl-2的表达来影响膀胱癌细胞的凋亡。
综上所述,Rab11过表达能明显减少顺铂诱导的膀胱癌细胞凋亡率、增加细胞存活率,表明Rab11可增强膀胱癌细胞对化疗药物顺铂的耐药性。本研究为膀胱癌的靶向治疗提供了实验基础。
:
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[2] Liang PY, Li HY, Zhou ZY, et al. Overexpression of immunoglobulin G prompts cell proliferation and inhibits cell apoptosis in human urothelial carcinoma[J]. Tumor Biol, 2013, 34(3):1783-1791.
[3] Kamat AM, Hahn NM, Efstathiou JA, et al. Bladder cancer[J]. Lancet, 2016, 388(10061):2796-2810.
[4] Vaishampayan U. Systemic therapy of advanced urothelial cancer[J]. Curr Treat Options Oncol, 2009, 10(3-4):256-266.
[5] Sun Y, Guan Z, XuY, et al. HIF-1α/MDR1 pathsway confers chemoresistance to cisplatin in bladder cancer[J]. Oncol Rep, 2016, 35(3):1549-1556.
[6] Kim CM, Choi JY, Yoon JH, et al. Purification, crystallization and X-ray crystallographic analysis of human RAB11 (S20V), a constitutively active GTP-binding form[J]. Acta Crystallogr F Struct Biol Commun, 2015, 71(10):1247-1250.
[7] Fujita A, Koinuma S, Yasuda S, et al. GTP hydrolysis of TC10 promotes neurite outgrowth through exocytic fusion of Rab11- and L1-containing vesicles by releasing exocyst component Exo70[J]. PLoS One, 2013, 8(11):e79689.
[8] Chung YC, Wei WC, Hung CN, et al. Rab11 collaborates E-cadherin to promote collective cell migration and indicates a poor prognosis in colorectal carcinoma[J]. Eur J Clin Invest, 2016, 46(12):1002-1011.
[9] Xu CL, Wang JZ, Xia XP, et al. Rab11-FIP2 promotes colorectal cancer migration and invasion by regulating PI3K/AKT/MMP7 signaling pathway[J]. Biochem Biophys Res Commun, 2016, 470(2):397-404.
[10] Dong W, Qin G, Shen R. Rab11-FIP2 promotes the metastasis of gastric cancer cells[J]. Int J Cancer, 2016, 138(7):1680-1688.
[11] Jing J, Tarbutton E, Wilson G, et al. Rab11-FIP3 is a Rab11-binding protein that regulates breast cancer cell motility by modulating the actin cytoskeleton[J]. Eur J Cell Biol, 2009, 88(6):325-341.
[12] He Y, Ye M, Zhou L, et al. High Rab11-FIP4 expression predicts poor prognosis and exhibits tumor promotion in pancreatic cancer[J]. Int J Oncol, 2017, 50(2):396-404.
[13] Gebhardt C, Breitenbach U, Richter KH, et al. c-Fos-dependent induction of the small ras-related GTPase Rab11a in skin carcinogenesis[J]. Am J Pathol, 2005, 167(1):243-253.
[14] Vitale I, Galluzzi L, Castedo M, et al. Mitotic catastrophe: a mechanism for avoiding genomic instability[J]. Nat Rev Mol Cell Biol, 2011,12(6):385-392.
[15] Galluzzi L, Vitale I, Abrams JM, et al. Molecular definitions of cell death subroutines: recommendations of the Nomenclature Committee on Cell Death 2012[J]. Cell Death Differ, 2012, 19(1):107-120.
[16] Vandenabeele P, Galluzzi L, Vanden BT, et al. Molecular mechanisms of necroptosis: an ordered cellular explosion[J]. Nat Rev Mol Cell Biol, 2010,11(10):700-714.
[17] Tamatani M, Mitsuda N, Matsuzaki H, et al. A pathway of neuronal apoptosis induced by hypoxia/reoxygenation: roles of nuclear factor-kappaB and Bcl-2[J]. J Neurochem, 2000,75(2):683-693.

