沉默ADAM17蛋白对人结肠癌HT29细胞增殖能力的影响及机制探讨
张琪,杨光华,刘少鹏,丁家杉,韩学超,张国志,王长友
(1华北理工大学附属医院,河北唐山063000;2华北理工大学临床医学院;3华北理工大学医学实验中心)
结肠癌是以腺癌为主的常见消化道恶性肿瘤,在世界范围内其发病率逐年上升[1],2015年在我国的肿瘤新发病例中排第5位[2]。恶性肿瘤的发生与细胞周期调控失常导致细胞异常增生有关,细胞周期蛋白D1(cyclin D1)、p21是重要的细胞周期调节蛋白。解整合素样金属蛋白酶17(ADAM17)又称肿瘤坏死因子α转化酶(TACE),主要参与肿瘤的发生发展、增殖、迁移、侵袭及远处转移[3, 4]。2017年1~6月,我们通过体外培养人结肠癌细胞HT29,构建ADAM17干扰逆转录病毒,观察ADAM17低表达后对HT29结肠癌细胞增殖能力的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料 人结肠癌细胞株HT29购自中国科学院干细胞库;DMEM培养基、胎牛血清、胰酶(美国Gibco公司)。TRIzol、Go ScriptTM逆转录试剂盒、real-time PCR试剂盒(美国Invitrogen公司);CCK-8试剂盒(上海贝博生物有限公司);ADAM17抗体(美国Abcam公司),β-actin、cyclin D1、p21抗体(美国Cell Signaling Technology公司);Annexin-V FITC/PI染料试剂盒(美国Sigma公司);HR标记山羊抗兔IgG二抗、DAB显影液、BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF、SDS-PAGE凝胶配制试剂盒(北京索莱宝科技有限公司);酶标仪(上海BIO-RAD公司);流式细胞仪(FACS Calibuar,美国BD 公司);垂直电泳系统、湿转系统(北京六一仪器厂)。
1.2 细胞培养与分组转染 HT29细胞用含10% FBS的DMEM培养基,在5% CO2、37 ℃孵育箱中培养。ADAM17小干扰RNA(ADAM17-shRNA)及对照序列(nonsense shRNA)由上海吉玛公司合成,其序列分别为5′-GCATCATGTATCTGAACAACG-3′、5′-TTCTCCGAACGTGTCACGT-3′。将细胞分为3组,沉默组和阴性对照组分别转染ADAM17-shRNA、nonsense shRNA,空白对照组加入等量PBS,转染后48 h荧光显微镜下观察转染效率。确定MOI值为100时,细胞转染率可达90%以上。
1.3 细胞ADAM17 mRNA检测 采用real-time PCR法。收集各组细胞,TRIzol法提取RNA。通过Go ScriptTM逆转录试剂盒将RNA反转为cDNA,然后进行qRT-PCR。ADAM17引物序列上游为5′-ATCAAACCTTTCCTGCG-3′、下游为5′-CAAACCCATCCTCGTCCA-3′,GAPDH引物序列上游为5′-GAAGGTGAAGGTCGGAGTC-3′、下游为5′-GAAGATGGTGATGGGATTTC-3′。反应条件:95 ℃变性2 min,95 ℃ 30 s,60 ℃ 30 s;总共40个循环。以GAPDH为内参,采用2-ΔΔCT法计算ADAM17 mRNA相对表达量。每组设2个复孔,平行实验3次。
1.4 细胞增殖能力观察 采用CCK-8 法。取各组对数生长期细胞,制成单细胞悬液;以1×104/孔接种于96孔板中(每组设9个复孔),培养24 h后弃去培养基,加入完全培养基100 μL/孔。每孔加入CCK-8工作液10 μL后置于培养箱内继续孵育2 h,酶标仪测定在450 nm处的光密度(OD值)。同时设置空白孔、对照孔、实验孔,实验重复3次。细胞增殖率=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
1.5 细胞周期观察 取各组对数生长期细胞,接种于6孔板;细胞同步化后胰酶消化,离心收集细胞;PBS清洗1次,然后用含75%乙醇的PBS在4 ℃固定过夜。分析前用PBS 离心洗涤细胞,加入10 mg/L 的RNase A 1 μL,37 ℃ 孵育 30 min;PI(终浓度为50 μg/mL)浸染15 min后,300目滤网过滤细胞悬液,上流式细胞仪检测。以上实验重复3次。
1.6 细胞ADAM17、cyclin D1、p21蛋白检测 采用Western blotting法。取各组细胞,RIPA裂解液4 ℃裂解30 min,离心收集蛋白。BCA法定量总蛋白,加入等体积2×蛋白上样缓冲液后100 ℃变性5 min,-80 ℃保存备用。进行SDS-PAGE蛋白电泳(120 V,60 min),转膜(90 V,45 min),10%脱脂奶封闭,一抗摇床孵育过夜(1∶1 000) ,二抗(1∶1 000)37 ℃ 孵育2 h,荧光显色。Image J软件分析灰度值。相关蛋白表达量以所测蛋白灰度值与内参灰度值比值表示。
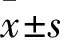
2 结果
2.1 各组细胞ADAM17 mRNA及蛋白表达比较 见表1。
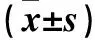
表1 各组细胞ADAM17 mRNA及蛋白表达比较
注:与空白对照组比较,*P<0.01;与阴性对照组比较,#P<0.01。
2.2 各组细胞增殖情况比较 沉默组、阴性对照组和空白对照组细胞增殖率分别为64.71%±5.14%、99.04%±2.88%、100%,沉默组细胞增殖率低于其他两组(P均<0.01),阴性对照组和空白对照组细胞增殖率比较差异无统计学意义。
2.3 各组细胞周期比较 见表2。

表2 各组细胞周期比较
注:与空白对照组比较,*P<0.01;与阴性对照组比较,#P<0.01。
2.4 各组细胞cyclin D1、p21蛋白表达比较 见表3。
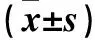
表3 各组细胞cyclin D1、p21蛋白表达比较
注:与空白对照组比较,*P<0.01;与阴性对照组比较,#P<0.01。
3 讨论
结肠癌的发生是遗传、饮食、环境、生活习惯及肠道微生态等多因素共同作用的结果,在我国发病率呈逐年上升且年轻化趋势[5]。由于相关预防保健知识的缺乏,在我国及其他发展中国家,大多数结肠癌患者在发现时已处于疾病中晚期,丧失手术机会。因此,分子靶向治疗在晚期肿瘤治疗中的运用,已经成为治疗的新关注点[6]。
近年来,ADAM17在肿瘤中的作用越来越受到关注[7]。研究[8, 9]发现,有着水解剪切酶类功能的ADAM17蛋白,在胃癌、乳腺癌等肿瘤组织中呈明显高表达状态,并可以通过MEK/ERK、PI3K/AKT等信号通路调节肿瘤细胞增殖、迁移和侵袭,在肿瘤的发生发展中起着重要作用。在结肠癌中,也有相关报道指出高表达的ADAM17与结肠癌的转移及预后密切相关[10]。因此,ADAM17作为一个靶向蛋白,在结肠癌的治疗中极具潜力。
无限增殖以及不受调控的细胞周期是肿瘤恶性病因之一,故肿瘤也被认为是一种细胞周期性疾病,这也是目前大多数化疗药物以及分子靶向药物研究的重点[11]。细胞周期蛋白是调节G1期与S期间调控点的关键蛋白,与细胞周期蛋白依赖性激酶(CDK)和细胞周期蛋白依赖性激酶抑制因子(CKI)共同调控细胞周期[12,13]。p21可以通过与CDK蛋白竞争性结合cyclin D1,导致cyclin D1/CDK激酶失活,从而产生细胞G0/G1期阻滞[14]。本研究结果显示,沉默ADAM17蛋白后,结肠癌细胞出现明显的G0/G1期阻滞,细胞周期关键蛋白cyclin D1表达显著降低,而p21的表达则明显升高。这与Lv等[15]的研究结果相符。因此,沉默ADAM17可能通过下调p21影响cyclin D1,产生对结肠癌细胞周期的抑制作用,从而阻断细胞从G1期向S期进展,造成G1期细胞堆积[16]。
综上所述,沉默ADAM17 蛋白能够抑制细胞的增殖,同时产生HT29细胞G0/G1期阻滞作用。其机制可能是通过影响细胞周期蛋白p21、cyclin D1实现对结肠癌HT29细胞周期的调控作用,但这可能并不是ADAM17调控细胞周期的惟一作用位点,其上游信号通路将在后续实验中验证。
:
[1] Szkandera J, Pichler M, Absenger G, et al. A functional germline variant in GLI1 implicates hedgehog signaling in clinical outcome of stage Ⅱand Ⅲcolon carcinoma patients[J]. Clin Cancer Res, 2014,20(6):1687-1697.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[3] 吴衡.ADAM17在胰腺癌细胞中的表达及其对细胞增殖迁移的影响[J].江苏大学学报(医学版),2015,25(4):299-303.
[4] Zhang TC, Zhu WG, Huang MD, et al. Prognostic value of ADAM17 in human gastric cancer[J]. Med Oncol, 2012,29(4):2684-2690.
[5] Espejo-Herrera N, Gracia-Lavedan E, Boldo E, et al. Colorectal cancer risk and nitrate exposure through drinking water and diet[J]. Int J Cancer, 2016,139(2):334-346.
[6] Lei J, Yan L. Outcome comparisons among the Hangzhou, Chengdu, and UCSF criteria for hepatocellular carcinoma liver transplantation after successful downstaging therapies[J]. J Gastrointest Surg, 2013,17(6):1116-1122.
[7] Zheng X, Jiang F, Katakowski M, et al. ADAM17 promotes glioma cell malignant phenotype[J]. Mol Carcinog, 2012,51(2):150-164.
[8] Xiao LJ, Lin P, Lin F, et al. ADAM17 targets MMP-2 and MMP-9 via EGFR-MEK-ERK pathway activation to promote prostate cancer cell invasion[J]. Int J Oncol, 2012,40(5):1714-1724.
[9] Meng X, Hu B, Hossain MM, et al. ADAM17-siRNA inhibits MCF-7 breast cancer through EGFR-PI3K-AKT activation[J]. Int J Oncol, 2016,49(2):682-690.
[10] Xu Q, Ying M, Chen G, et al. ADAM17 is associated with EMMPRIN and predicts poor prognosis in patients with uterine cervical carcinoma[J]. Tumour Biol, 2014,35(8):7575-7586.
[11] Jimenez J, Bru S, Ribeiro MP, et al. Phosphate: from stardust to eukaryotic cell cycle control[J]. Int Microbiol, 2016,19(3):133-141.
[12] Tajitsu Y, Ikeda R, Nishizawa Y, et al. Molecular basis for the expression of major vault protein induced by hyperosmotic stress in SW620 human colon cancer cells[J]. Int J Mol Med, 2013,32(3):703-708.
[13] Bertoli C, Skotheim JM, de Bruin RA. Control of cell cycle transcription during G1and S phases[J]. Nat Rev Mol Cell Biol, 2013,14(8):518-528.
[14] Karimian A, Ahmadi Y, Yousefi B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J]. DNA Repair (Amst), 2016,42:63-71.
[15] Lv X, Li Y, Qian M, et al. ADAM17 silencing suppresses the migration and invasion of non-small cell lung cancer[J]. Mol Med Rep, 2014,9(5):1935-1940.
[16] 林锋,林平,刘鑫,等.靶向ADAM17基因siRNA对前列腺癌PC-3细胞增殖能力的影响[J].中华男科学杂志,2012,18(8):687-691.

