不同CRRT治疗剂量对感染性休克患者临床疗效、应激反应及细胞免疫功能的影响
王磊
(皖北煤电集团总医院,安徽宿州234000)
感染性休克是ICU最常见的危重症之一,应激反应、免疫功能在疾病发展及转归方面具有重要作用。随着连续肾脏替代疗法(CRRT)的成熟与普及,其在诸多危重症中的应用越来越广泛。在感染性休克中的应用研究已发现,CRRT对减少并发症、降低病死率、改善患者预后有益[1],被认为是必要的救治措施。但是,目前对CRRT的治疗剂量选择存在诸多疑问[2]。因此,本研究对比观察了不同CRRT治疗剂量对感染性休克患者临床疗效、应激反应、免疫功能的影响,为临床应用提供参考。现报告如下。
1 资料与方法
1.1 临床资料 收集2012年8月~2017年7月皖北煤电集团总医院ICU收治的感染性休克患者,均符合感染性休克诊断标准[3]。排除及剔除标准:①原发重要脏器、血液、内分泌系统严重疾病及肿瘤患者;②年龄﹤18周岁;③发病前24 h内行急诊手术,或确诊后24 h内死亡者;④临床资料不全及放弃治疗者;⑤法定代理人未签署知情同意书者。共126例纳入研究,按数字列表法分为3组各42例。A组男24例、女18例,年龄(46.74±7.25)岁,BMI(24.80±2.61)kg/m2,感染部位位于泌尿系统11例、胆囊8例、肺部18例、腹膜5例,APACHEⅡ评分(19.10±1.44)分,休克指数1.26±0.14;B组男22例、女20例,年龄(45.91±6.84)岁,BMI(24.96±2.32)kg/m2,感染部位位于泌尿系统10例、胆囊10例、肺部19例、腹膜3例,APACHEⅡ评分(19.30±1.37)分,休克指数1.22±0.12;C组男25例、女17例,年龄(46.28±7.73)岁,BMI(25.07±2.47)kg/m2,感染部位位于泌尿系统12例、胆囊9例、肺部18例、腹膜3例,APACHEⅡ评分(19.23±1.51)分,休克指数1.24±0.15;三组临床资料具有可比性。本研究获医院医学伦理委员会批准。
1.2 治疗方法 患者均参考“拯救全身性感染运动(SSC)”所制定的感染性休克治疗指南(2008年)救治,包括广谱抗菌素控制感染、充分液体复苏、血管活性药物保护血管舒缩功能、营养支持治疗及维持水、电解质酸碱平衡等,连接生命监护仪器,积极干预并使血糖、血压、血氧饱和度等维持稳定。A、B、C组给予CRRT治疗,剂量分别为25、35、45 mL/(kg·h);采用德国贝朗Diapact血液滤过机及德国费森尤斯AV600S滤过器,常规12 h更换管路1次,如有阻塞及时更换。
1.3 应激反应及细胞免疫指标观察 治疗72 h后取外周血,检测应激反应指标[髓过氧化物酶(MPO)、丙二醛(MDA)及C反应蛋白(CRP)]、细胞免疫功能指标。MPO、MDA分别采用ELISA法、硫代巴比妥酸法,试剂盒购自南京建成生物工程研究所;CRP采用酶联免疫法,试剂盒购自上海岚派生物科技有限公司。采用FACS CantoⅡ流式细胞仪(美国Becton Dickinson公司)检测外周血中CD3+、CD4+、CD8+T淋巴细胞比例,并计算CD4+/CD8+。
1.4 临床疗效观察 观察治疗72 h内死亡及多脏器功能不全(MODS)发生情况,记录ICU住院时间。
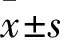
2 结果
2.1 各组外周血应激反应指标比较 治疗前,各组外周血MPO、MDA、CRP水平差异无统计学意义。治疗72 h后,各组外周血MPO、MDA、CRP水平均较治疗前下降(P均<0.05),且A组﹥B组﹥C组(P均<0.05)。见表1。
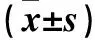
表1 各组外周血MPO、MDA、CRP水平比较
注:与同组治疗前比较,aP﹤0.05;与A组治疗72 h比较,bP﹤0.05;与B组治疗72 h比较,cP﹤0.05。
2.2 各组外周血细胞免疫功能指标比较 治疗前,各组外周血免疫功能指标水平差异无统计学意义。治疗72 h后,各组CD3+、CD4+T淋巴细胞比例及CD4+/CD8+较本组治疗前上升(P均<0.05),且CD3+T淋巴细胞比例及CD4+/CD8+A组﹤B组﹤C组(P均<0.05),CD4+T淋巴细胞比例A组低于C组(P均<0.05)。见表2。
2.3 各组病死率、MODS发生率、ICU住院时间比较 A、B、C组病死率分别为21.42%、16.67%、11.90%,组间病死率比较P均﹥0.05;MODS发生率分别为64.29%、50.00%、33.33%,A组与C组比较P<0.05;ICU住院时间分别为(14.60±5.43)、(12.82±4.87)、(10.43±4.29)d,A组﹤B组﹤C组(P均<0.05)。
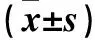
表2 各组外周血细胞免疫功能指标比较
注:与同组治疗前比较,aP﹤0.05;与A组治疗72 h比较,bP﹤0.05;与B组治疗72 h比较,cP﹤0.05。
3 讨论
感染性休克是以病原体及其毒素、胞壁产物侵入血液循环为起始,经过复杂的病理生理变化引起有效循环血量减少、灌注不足,组织缺血、缺氧,进而导致多脏器功能障碍的一种急性危重症综合征[4]。目前,已经公认应激反应、炎症反应失控和免疫功能、血管舒缩功能障碍是该病发生、进展的重要参与因素[5,6],并且这些因素之间也存在复杂的联系。例如:氧自由基等应激反应相关细胞因子常促进炎症细胞合成、释放CRP、TNF-α、IL-6等促炎性细胞因子[7],而CRP、TNF-α等通过损伤血管内皮功能、激活血小板等诱发应激反应加剧[8]。故它们互为因果而促发机体“炎症瀑布”的发生,进而引起肺、肾、肝、心等多脏器损伤。过度活化的应激和炎性因子能直接抑制机体免疫功能[9],缺血、缺氧以及代谢废物的蓄积也会抑制免疫功能;这严重影响免疫机制对入侵病原体的清除,继续刺激机体而使应激反应和炎症反应扩大[10]。因此,抑制应激反应、调节免疫功能恢复被认为是抑制病情进展[11]、为抢救争取时间的关键环节之一,而CRRT具备这一能力。CRRT在感染性休克中的应用,最初主要是为了防治常见并发症急性肾损伤。但临床实践发现,其在调节机体血容量、保护肾脏、清除代谢产物、维持内环境稳定的同时,可通过对流、滤过、吸附等方式清除血中氧自由基、TNF-α等炎症介质抑制应激反应和炎症反应[12,13],也有促进机体免疫应答恢复的效果。因此,无论是否已并发急性肾损伤,CRRT已是该病治疗中不可或缺的方法[14]。但是,目前针对CRRT的治疗剂量存在诸多问题。例如:①早在2000年,Ronco等[15]即提出增加CRRT治疗剂量可将降低感染性休克的病死率,其后有多项研究结果给予支持,但也有研究[16]持相反意见。②CRRT治疗剂量存在被高估的问题:一者,存在被所添加的溶质稀释的实际情况;二者,医疗行为及器械的维护,常会打断CRRT进程影响运行时间;再者,随着运行的延长,滤器凝血、极化以及被纤维蛋白黏附等,均可导致实际CRRT剂量下降。③高剂量CRRT影响不少对评估病情有重要价值因子的表达水平,可能影响医疗过程中对机体状态的判断,有可能延误病情。分析可见:上述问题“②”为难以避免的因素,但可以通过监控溶质稀释的程度、尽量保证运行时间以及及时更换滤器等加以控制,这些因素在任何剂量时均有存在,并不妨碍初始给予剂量对机体作用的差异。上述问题“③”为医疗行为中必须面对的因素,固然能导致血乳酸等下降而影响这些因子评估病情的价值,但本质上不能因噎废食放弃使机体获益更大的方案,解决这种困扰需要提高医者的自身业务素质,也需要发掘其他受CRRT剂量影响较小的评估指标。上述问题“①”方为当前急需解决的问题,即高剂量是否真的有效。
本研究结果显示,A、B、C组随着CRRT治疗剂量的增加,应激反应指标MPO、MDA、CRP以及细胞免疫功能指标CD3+、CD4+T淋巴细胞比例及CD4+/CD8+改善的程度也呈递增趋势,提示高剂量有利于抑制应激反应和恢复免疫功能;各组MODS发生率、ICU住院时间也随着CRRT治疗剂量增加而降低,也提示高剂量有利于病情恢复,患者能更多获益。至于病死率方面无明显差异,主要与样本量偏小有关。
综上所述,笔者认为CRRT治疗剂量的不同明显影响感染性休克患者的临床疗效及应激反应、细胞免疫功能,临床应考虑较大剂量治疗。当然,该领域仍有继续深入研究的必要:需要在大剂量应用时确定最佳剂量;需要纳入更多的指标综合评估;需要大样本、多中心的研究。
:
[1] Honore PM, Jacobs R, Joannes-Boyau O, et al. Newly designed CRRT membranes for sepsis and SIRS-a pragmatic approach for bedside intensivists summarizing the more recent advances: a systematic structured review[J]. ASAIO J, 2013,59(2):99-106.
[2] Ulldemolins M, Vaquer S, Llauradó-Serra M, et al. Beta-lactam dosing in critically ill patients with septic shock and continuous renal replacement therapy[J]. Crit Care, 2014,18(3):227.
[3] Dellingcrp RP, Canlet JM, Masur H, et al. Surviving sepsis campaign guidelines managetment of severe sepsis and septic shock[J]. Intensitve Care Med, 2004,30(6):536-555.
[4] Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013,39(2):165-228.
[5] Holst LB, Haase N, Wetterslev J, et al. Lower versus higher hemoglobin threshold for transfusion in septic shock[J]. N Eng J Med, 2014,371(15):1381-1391.
[6] Costa NA, Gut AL, de Souza Dorna M, et al. Serum thiamine concentration and oxidative stress as predictors of mortality in patients with septic shock[J]. J Crit Care, 2014,29(2):249-252.
[7] Aliomrani M, Sepand MR, Mirzaei HR, et al. Effects of phloretin on oxidative and inflammatory reaction in rat model of cecal ligation and puncture induced sepsis[J]. Daru, 2016,24(1):15.
[8] Andreis DT, Singer M. Catecholamines for inflammatory shock: a Jekyll-and-Hyde conundrum[J]. Intensive Care Med, 2016,42(9):1387-1397.
[9] Coletta C, Módis K, Oláh G, et al. Endothelial dysfunction is a potential contributor to multiple organ failure and mortality in aged mice subjected to septic shock: preclinical studies in a murine model of cecal ligation and puncture[J]. Crit Care, 2014,18(5):511.
[10] Hauer D, Kaufmann I, Strewe C, et al. The role of glucocorticoids, catecholamines and endocannabinoids in the development of traumatic memories and posttraumatic stress symptoms in survivors of critical illness[J]. Neurobiol Learn Mem, 2014,112:68-74.
[11] Wong HR, Cvijanovich NZ, Anas N, et al. Developing a clinically feasible personalized medicine approach to pediatric septic shock[J]. Am J Respir Crit Care Med, 2015,191(3):309-315.
[12] Ferguson LM, Dreisbach AW, Fulop T, et al. Recurring extracorporeal circuit clotting during continuous renal replacement therapy in fungal sepsis: successful treatment with argatroban[J]. Am J Med Sci, 2013,345(3):256-258.
[13] Shum HP, Chan KC, Kwan MC, et al. Timing for initiation of continuous renal replacement therapy in patients with septic shock and acute kidney injury[J]. Ther Apher Dial, 2013,17(3):305-310.
[14] Dabrowski W, Kotlinska-Hasiec E, Schneditz D, et al. Continuous veno-venous hemofiltration to adjust fluid volume excess in septic shock patients reduces intra-abdominal pressure[J]. Clin Nephrol, 2014,82(1):41-50.
[15] Ronco C, Bellomo R, Homel P, et al. Effects of different doses incontinuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial[J]. Lancet, 2000,356(9223):26-30.
[16] Vesconi S, Cruz DN, Fumagalli R, et al.Delivered dose of renal replacement therapy and mortality in critically ill patients with acute kidney injury[J]. Crit Care, 2009,13(2):57.

