子宫内膜癌组织中HIF-1α、BRCA1表达变化及其与临床病理特征、预后的关系
赵宁,雷勇
(哈励逊国际和平医院,河北衡水053000)
子宫内膜癌发病率占女性生殖道恶性肿瘤的20%~30%,且发病年龄呈低龄化趋势。目前,随着分子检测手段不断进步,肿瘤相关基因成为癌症领域研究的热点。缺氧诱导因子1(HIF-1)是肿瘤细胞适应缺氧微环境而表达的一种核转录调控因子,其在许多恶性肿瘤癌变前均存在过度表达现象,且在肿瘤细胞新陈代谢、增殖转移及血管形成等方面具有重要作用[1]。乳腺癌易感基因1(BRCA1)作为一种抑癌基因,其结构和功能异常与性激素相关乳腺癌及卵巢癌发生具有密切联系。子宫内膜与乳腺组织相似,均为性激素作用器官,故BRCA1基因可能参与子宫内膜癌发生及发展过程[2]。目前,同时检测HIF-1α及BRCA1表达对子宫内膜癌发生、发展、浸润及转移影响的研究报道鲜见。本研究通过观察HIF-1α及BRCA1在不同子宫内膜组织中的表达水平,分析两者在子宫内膜癌发生、发展中的作用及二者的相关性,为临床诊治子宫内膜癌提供依据。现报告如下。
1 资料与方法
1.1 临床资料 收集2009年6月~2011年5月哈励逊国际和平医院收治的子宫内膜癌45例(癌症组),均术后经病理证实。患者年龄(53.21±6.53)岁,均为初诊病例,术前均未接受过放化疗及激素治疗。FIGO分期:Ⅰ期25例,Ⅱ期12例,Ⅲ期5例,Ⅳ期3例;病理组织分化:高分化(G1)21例,中分化(G2)14例,低分化(G3)10例;子宫肌层浸润深度≥1/2 26例,<1/2 19例;淋巴结转移33例,无淋巴结转移12例;绝经22例,未绝经23例;术后随访6~72个月,存活35例。选取同期因子宫内膜异位症、子宫腺肌病、子宫肌瘤行子宫切除术并经病理诊断为增生子宫内膜者35例(增生组),年龄(46.81±4.38)岁;行子宫脱垂手术并经病理诊断为正常子宫内膜者41例(正常组),年龄(47.52±5.23)岁。三组均排除其他恶性肿瘤及心血管、血液系统等全身性疾病,其年龄具有可比性,收集其子宫内膜组织标本。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 子宫内膜组织HIF-1α和BRCA1检测方法 采用免疫组化法。标本用10%中性多聚甲醛固定,4 μm切片;温水展片并贴于载玻片上,60 ℃烤片2 h;分别用二甲苯Ⅰ、Ⅱ进行脱蜡,各浸泡20 min;依次采用95%、85%、75%无水乙醇浸泡5 min,共水化2次,蒸馏水冲洗5 min;PBS浸泡5 min后,室温下用3% H2O2孵育20 min,PBS湿盒中浸泡3次×3 min;放入含柠檬酸钠溶液中,在95 ℃恒温水箱中修复20 min;自然冷却后PBS湿盒中浸泡3次×3 min,10%山羊血清封闭10 min;滴加稀释的HIF-1α和BRCA1一抗(工作浓度1∶100),于4 ℃冰箱保存;弃一抗,PBS湿盒中浸泡3次×3 min,然后滴加含生物素标记的二抗;室温孵育1 h,PBS湿盒中浸泡3次×3 min;滴加辣根酶标记链霉卵白素工作液,于37 ℃恒温箱中孵育30 min;PBS湿盒中浸泡3次×3 min,进行DAB显色3~5 min;自来水冲洗后进行苏木素复染,冲洗后用0.1%盐酸乙醇分化;返蓝后依次用75%、85%、95%和100%无水乙醇脱水,二甲苯透明后晾干;用中性树胶封片,镜下观察并获得图像。阳性细胞为细胞质或细胞核内出现棕黄色或棕褐色颗粒,HIF-1α蛋白主要位于细胞核中,而BRCA1蛋白主要定位于细胞质或细胞核中。阳性细胞数<10%计0分、10%~50%计2分、51%~80%计3分、>80%计4分,细胞不着色计0分、呈浅黄色计1分、呈棕黄色计2分、呈棕褐色计3分,两项得分相加≥1分为阳性表达。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料比较采用χ2检验或Fisher检验,HIF-1α和BRCA1的相关性采用Spearmen分析,并用Kaplan-Meier进行HIF-1α和BRCA1阳性表达者生存率分析,组间比较采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组HIF-1α、BRCA1表达比较 HIF-1α阳性表达率在正常组、增生组、癌症组分别为9.76%(4/41)、40.00%(14/35)、73.33%(33/45),BRCA1阳性表达率分别为95.12%(39/41)、65.71%(23/35)、31.11%(14/45),三组间HIF-1α、BRCA1阳性表达率两两比较差异有统计学意义(P均<0.05)。
2.2 HIF-1α、BRCA1表达与子宫内膜癌临床病理参数的关系 与FIGO分期低、肌层浸润深度<1/2、无淋巴结转移者相比,FIGO分期高、肌层浸润≥1/2、淋巴结转移者HIF-1α阳性表达率升高、而BRCA1阳性表达率降低(P均<0.05)。见表1。
2.3 子宫内膜癌组织中HIF-1α与BRCA1表达的关系 Spearman相关分析结果显示,在子宫内膜癌组织中HIF-1α与BRCA1表达呈负相关(r=-1.012,P<0.05)。
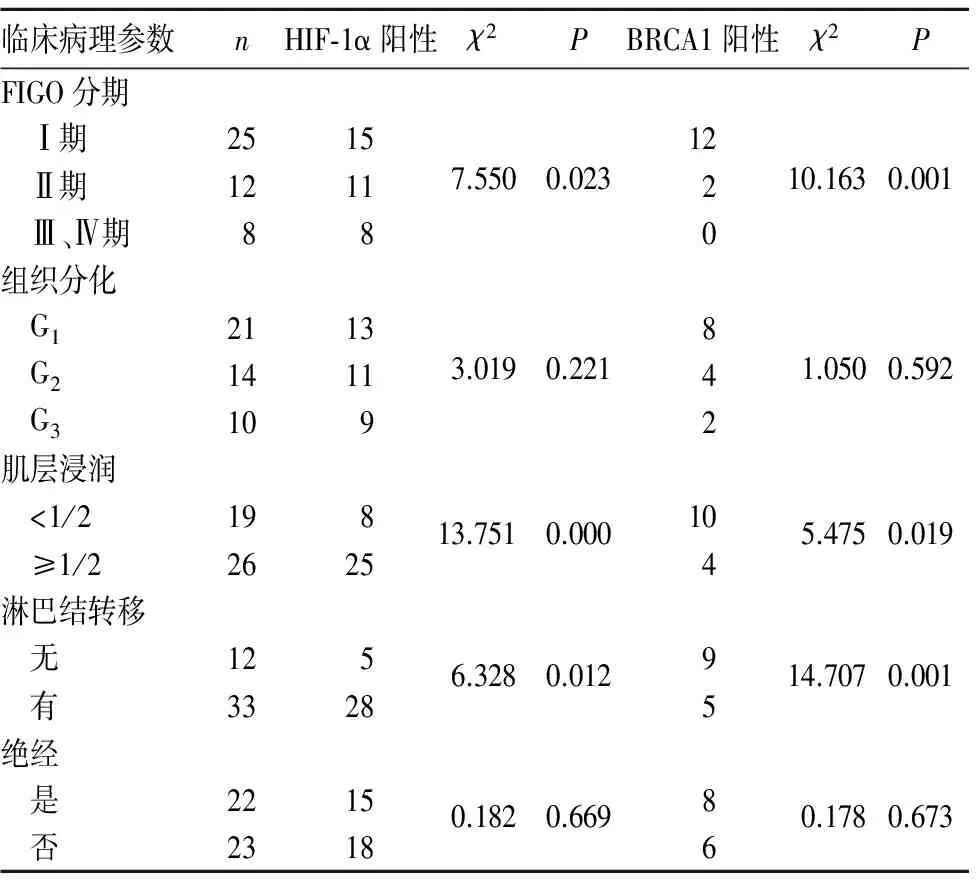
表1 HIF-1α、BRCA1表达与子宫内膜癌临床病理参数的关系(例)
2.4 HIF-1α、BRCA1表达与子宫内膜癌患者预后的关系 子宫内膜癌组织中,HIF-1α阳性表达者5年生存率(72.73%)低于阴性表达者(91.67%),差异有统计学意义(P<0.05);BRCA1阳性表达者5年生存率(92.86%)高于BRCA1阴性表达者(70.97%),但差异无统计学意义(P>0.05)。
3 讨论
子宫内膜癌是一种实体恶性肿瘤,而肿瘤新生血管生成与肿瘤细胞对缺氧微环境适应是维持实体瘤细胞增殖、浸润生长的两个主要因素[3]。HIF-1由α和β亚基组成,其中α亚基主要是氧调节亚基和功能亚基,能够介导糖代谢、细胞增殖、新生血管形成等靶基因的转录表达。因此,HIF-1α蛋白在维持肿瘤细胞的能量代谢、促进新生血管形成及肿瘤细胞增殖和转移中起重要作用[4]。恶性肿瘤在快速生长过程中,其内部缺氧可促进肿瘤细胞过表达HIF-1α,最终引起一系列细胞对缺氧的适应性反应[5,6]。子宫内膜癌与其他恶性肿瘤生长类似,肿瘤细胞在快速增殖过程中,易导致子宫内膜癌组织内缺氧,进而诱导HIF-1α表达[7]。高杰等[8]研究显示,子宫内膜癌和增生子宫内膜组织中HIF-1α阳性表达率高于正常子宫内膜组织,在HIF-1α对靶基因的转录调控下,能够促进子宫内膜癌细胞的增殖、浸润生长及转移。本研究结果显示,正常子宫内膜、不典型增生内膜组织和子宫内膜癌组织中HIF-1α阳性表达率逐渐增高。其原因可能为子宫内膜癌组织在缺氧条件下,促进机体内HIF-1α表达;HIF-1α在维持子宫内膜癌细胞的能量代谢、肿瘤血管生成、细胞增殖等过程起重要作用,促进了子宫内膜癌组织的生长。同时,分析HIF-1α表达与子宫内膜癌临床病理参数,发现随着患者肿瘤FIGO分期增高、肌层浸润加深、淋巴结转移,HIF-1α阳性表达率逐渐增高。这表明随着肿瘤的发展,组织中HIF-1α表达逐渐增高,因此HIF-α可作为判断子宫内膜癌进展及预后的一个重要指标。梁少强等[9]研究发现,宫颈炎组织和非典型增生组织HIF-1α阳性表达率低于宫颈癌组织,且与宫颈癌临床分期、远处转移、术后生存率相关,说明HIF-1α对于宫颈癌的诊断及预后具有重要临床指导意义。
BRCA1是遗传性乳腺癌、卵巢癌易感基因,其在DNA双链断裂修复中起重要作用,能够参与DNA合成及蛋白表达、细胞增殖、细胞程序性凋亡及维持基因组稳定性等过程。BRCA1基因突变常会导致细胞基因不稳定,同时对环境变化敏感性增加;BRCA1基因突变或缺失,会使机体DNA损伤监测受到干扰,细胞内DNA损伤修复障碍,最终导致基因表达产物变化。例如,蛋白缺陷或不能产生蛋白产物,可使抑制肿瘤作用降低或丧失,导致肿瘤发生[10]。大量研究报道[11,12]表明,BRCA1在正常组织中高表达,而在癌前病变组织及癌组织中低表达。近年来国内外学者认为,乳腺癌、卵巢癌与子宫内膜癌均属于性激素相关肿瘤,特别是与雌激素表达异常有关;BRCA1可能参与雌激素相关基因的表达,从而介导子宫内膜癌的发生发展[13]。范余娟等[14]研究发现,BRCA1基因突变与BRCA1蛋白表达下降呈明显相关性,且BRCA1蛋白表达降低与子宫内膜癌的发生、发展具有重要联系。Segev等[15]研究认为,BRCA1基因表达异常或突变者,会增加其罹患子宫内膜癌的风险。本研究中,正常子宫内膜组织、不典型增生内膜组织和子宫内膜癌组织中BRCA1阳性表达率逐渐降低,与多数学者的观点一致[16]。分析BRCA1表达与子宫内膜癌临床病理学参数的关系显示,随着患者肿瘤FIGO分期增高、肌层浸润加深、淋巴结转移,BRCA1阳性表达率逐渐降低。这表明BRCA1表达缺失可能与子宫内膜癌发生、发展过程密切相关,BRCA1的缺失能够反映子宫内膜癌的恶性程度。本研究相关性分析结果显示,HIF-1α与BRCA1表达在子宫内膜癌中呈负相关性,即随着子宫内膜癌恶性程度增加,HIF-1α蛋白表达逐渐增加,而BRCA1蛋白表达逐渐降低。这表明HIF-1α与BRCA1在子宫内膜癌进展过程中可能存在相互作用,其具体机制还需要进一步研究。而生存分析显示,HIF-1α阳性表达者5年生存率低于阴性表达者,而BRCA1阳性表达者5年生存率虽高于BRCA1阴性表达者,但差异不具有统计学意义。说明两者均可作为子宫内膜癌预后判断的指标,以HIF-1α更显著。
综上所述,在子宫内膜癌组织中HIF-1α高表达而BRCA1低表达,两者表达呈负相关,并且与FIGO分期增高、肌层浸润、淋巴结转移有关。通过检测HIF-1α、BRCA1表达,对子宫内膜癌的靶向治疗、预后判断具有临床指导作用。
:
[1] 朱慧敏,常彬,赵霞.缺氧诱导因子-1在卵巢癌中的研究进展[J].临床与实验病理学杂志,2012,28(1):67-69.
[2] 高润芳.乳腺癌易感基因突变相关性乳腺癌的治疗及预后[J].中国药物与临床,2013,13(1):65-68.
[3] 张伟杰,徐桂芳,周志华,等.缺氧与肿瘤干细胞“干性”的关系研究进展[J].山东医药,2013,53(15):85-87.
[4] 赵航,刘东屏.HIF-1α与实体性肿瘤发生及临床关系的研究进展[J].现代肿瘤医学,2013,21(9):2134-2137.
[5] 时沛.胃腺癌组织中HIF-1α和EGFR蛋白的表达与预后的关系[J].中国肿瘤生物治疗杂志,2016,23(1):89-94.
[6] 孙玉满,刘宏侠,杨俊泉,等.非小细胞肺癌中HIF-1α、MMP-2的表达及其相互关系探讨[J].临床肺科杂志,2013,18(10):1910-1911.
[7] 李仲均,黄文,黄素然,等.缺氧诱导因子-1α在子宫内膜非典型增生和子宫内膜癌中的表达及意义[J].广东医学,2014,35(3):387-390.
[8] 高杰,艾桂娟,韩萍,等.缺氧诱导因子-1α、表皮生长因子受体的表达与子宫内膜癌的相关性研究[J].中国妇幼保健, 2016, 31(13):2741-2743.
[9] 梁少强,涂青松,黄荣,等.HIF-1α在宫颈癌组织中的表达与临床特征的关系[J].中国医药科学,2012,2(6):29-30.
[10] 赵锡鹏,张凤梅,凤志慧.乳腺癌易感基因1在DNA损伤修复中作用的研究进展[J].中国药理学与毒理学杂志,2014,28(4):606-611.
[11] Zhang Q, Zhang Q, Cong H, et al. The ectopic expression of BRCA1 is associated with genesis, progression, and prognosis of breast cancer in young patients[J]. Diagn Pathol, 2012,7(1):1-7.
[12] 史斌浩,任敏.乳腺癌遗传易感基因的研究进展[J].中国肿瘤外科杂志,2015,7(2):120-123.
[13] Huszno J, Budryk M, Kolosza Z, et al. The influence of BRCA1/BRCA2 mutations on toxicity related to chemotherapy and radiotherapy in early breast cancer patients[J]. Oncology, 2013,85(5):278.
[14] 范余娟,孙丹,徐红,等.子宫内膜癌组织BRCA1单核苷酸多态性与临床病理因素相关性分析[J].中华肿瘤防治杂志,2015,22(16):1283-1286.
[15] Segev Y, Iqbal J, Lubinski J, et al. The incidence of endometrial cancer in women with BRCA1 and BRCA2 mutations: an international prospective cohort study[J]. Gynecol Oncol, 2013,130(1):127-131.
[16] 于江燕,张一琼.HER2和BRCA1在子宫内膜癌中的表达及其与预后的关系[J].实用肿瘤杂志,2016,31(2):145-149.

