外源自诱导物对厌氧氨氧化的影响
张向晖,彭永臻,贾方旭,韩金浩,马 斌,何 洋
外源自诱导物对厌氧氨氧化的影响
张向晖,彭永臻*,贾方旭,韩金浩,马 斌,何 洋
(北京工业大学,国家工程实验室,北京市污水脱氮除磷处理与过程控制工程技术研究中心,北京 100124)
厌氧氨氧化作为污水生物脱氮新工艺,存在着菌群倍增时间长,一旦随水流失,脱氮性能会急剧下降的问题.N-酰基高丝氨酸内酯(AHLs)作为一类典型的诱发群体感应效应的自诱导物,可能会激活部分基因的表达.有研究表明两种常见的AHLs:C6-HSL和C8-HSL对厌氧氨氧化菌群的成膜机制有促进作用.本试验通过外添加C6-HSL和C8-HSL两种自诱导物,深入探究其对厌氧氨氧化菌群的影响.结果表明浓度为0.5g/L的AHLs会抑制厌氧氨氧化菌群的生长,但能提高其脱氮性能,并显著促进联氨合成酶(hydrazine synthase subunit A,)基因的表达,但两种AHLs的促进作用有所差别,相同浓度的C8-HSL较C6-HSL对基因表达的促进作用更为明显.
厌氧氨氧化;群体感应;N-酰基高丝氨酸内酯;联氨合成酶
厌氧氨氧化(Anammox)是指厌氧氨氧化菌(AnAOB)在缺氧条件下以亚硝酸盐作为电子受体,将氨氮转化为氮气的过程[1-3].与传统脱氮工艺相比,Anammox工艺不需外加有机碳源且无需曝气,大大节省了能耗并降低了处理成本[4].但因AnAOB倍增时间长(约10~14d[5]),少许的污泥流失就会引起Anammox工艺的脱氮性能减弱.
群体感应(QS)是一种微生物中普遍存在的通讯机制[6],微生物通过分泌自诱导物(AI)来感知周围的细胞密度[7],从而调控基因表达[8],如生物膜的形成[9-10]、毒力因子的表达[11]、生物发光[12]等.AnAOB为革兰氏阴性菌,具有能分泌N-酰基-高丝氨酸内酯(AHLs)自诱导物的群体感应系统[13],有研究表明Anammox混合液的上清液和泥相中都能提取出C6-HSL和C8-HSL两种AHLs,并推测这两种自诱导物对AnAOB的生长速率和活性都存在积极的影响[14],但至今鲜有文章报道AHLs对AnAOB脱氮性能以及与Anammox反应相关的基因表达的影响,因此本试验选取C6-HSL和C8-HSL两种信号分子,通过外添加的方式考察其对AnAOB生长速率、活性以及功能基因表达的影响.
1 材料与方法
1.1 污泥来源与培养基
试验所用污泥取自稳定运行的厌氧氨氧化UASB反应器,通过菌体对数生长期的转接,对AnAOB进行富集培养[15],连续转接7次后, AnAOB含量占总菌含量的73%.在进行实验前,对Anammox污泥进行低强度的超声(30s, 250W),使菌群分布均匀.
基础培养液(g/L):NaNO20.4,NH4Cl 0.33, NaCl 1.0,MgCl2·6H2O 0.5,KH2PO40.2,KCl 0.3, CaCl2·2H2O 0.015,TES 2.292,Na2S·9H2O 0.012, NaHCO32.52,微量元素溶液1:1000(g/L):HCl 10mL/L, FeCl2·4H2O 1.5, CoCl2·6H2O 0.19, MnCl2·4H2O 0.1, ZnCl20.07,H3BO30.006, Na2MoO4·2H2O 0.036, NiCl2·6H2O 0.024, CuCl2·2H2O 0.002;pH= 7.0~7.3.通过曝氮气以及添加Na2S×H2O去除培养基中的溶解氧.外添加自诱导物培养基(g/L): C6-HSL 0.5或C8-HSL 0.5,其他成分与基础培养基相同.C6-HSL和C8-HSL均购置自Sigma公司.
1.2 外添加自诱导物实验
实验分3组进行:空白对照组、C6-HSL组(AHLs-Ⅰ)、C8-HSL(AHLs-Ⅱ)组,每组均做2组平行实验.实验反应体系为60mL的血清瓶,有效反应体积为40mL.在60mL的血清瓶中加入36mL的培养基,并加入4mL经过转接富集培养OD600=0.25的Anammox污泥,向血清瓶中曝氮气去除其中的溶解氧,后密封压盖,保证血清瓶中的厌氧环境.血清瓶置于35℃、140r/min恒温摇床中培养.每间隔1d取一次样品,测定其中NH4+- N、NO2--N 和NO3--N的浓度变化, AnAOB的含量变化,以及联氨合成酶基因的表达情况.
1.3 检测指标及分析方法
水质检测指标包括NH4+-N、NO2--N 和NO-3-N,采用DIONEX IC S-2000离子色谱仪进行测定,柱子型号为:Dionex IonPac AS18- 4µm,pH值采用探头测定,探头型号为德国WTWMulti340i.
1.4 DNA、RNA的提取和RT-PCR、qPCR
本实验提取样品中的mRNA和DNA,对DNA进行16S rRNA定量PCR的测定,随后对提取出的样品mRNA进行RT-PCR,得到相应的cDNA.本试验选取Anammox反应过程中最具有特异性的联氨合成酶基因()来表征Anammox反应的进行情况[16].对cDNA中的联氨合成酶基因进行定量PCR测定,最后用测定拷贝数与16S rRNA拷贝数的比值来表示单位AnAOB中联氨合成酶基因的表达量.

表1 real-time qPCR所用引物及其核苷酸序列
DNA、RNA分别从0.5mL的样品中获得,DNA的提取方法参照QIAGEN公司DNeasy Blood&Tissue试剂盒.提取RNA的样品在用RNase-free处理过的离心管中进行离心(20000g, 15min,4℃).离心后的生物相溶于150μL的TRIzol®(Life Technologies, Grand Island, NY, USA)并储存于-80℃[17].RNA提取使用RNeasy kit(QIAGEN GmbH, Hilden, Germany).反转录选用two-step RT-PCR Sensiscript kit(QIAGEN, GmbH, Hilden, Germany),取12μL的提取好的RNA于20μL的反转录混合体系中,于37℃3h后合成cDNAs,并储存于-20℃.选用荧光素酶RNA(Luciferase control RNA)作为内标物[18], rpoB和16S rRNA作为管家基因(回收率详见表4).本实验中所进行的qPCR扩增效率达93%~ 96%,2>0.9,qPCR体系为10μL:无菌水3.135μL, buffer 5μL,BAS(20mg/mL) 0.065μL,前引物0.4μL,后引物0.4μL,DNA 1μL. qPCR反应条件为:93℃预变性3min,96℃变性30s,55℃退火30s,72℃延伸30s,进行40个循环,72℃延伸5min(qPCR使用的引物详见表1).
2 结果与讨论
2.1 自诱导物C6-HSL和C8-HSL对Anammox脱氮性能的影响
探究外添加自诱导物对Anammox脱氮性能的影响发现,从实验的第1d开始,外添加的自诱导物就对Anammox的氨氮降解能力有显著的影响(氨氮浓度变化详见图1(a)),在24h内C6-HSL组和C8-HSL组的氨氮降解速率分别达到了0.282和0.455mmol/(L·d),而空白组仅为0.084mmol/(L·d).在之后的6d内,随着反应的进行,C6-HSL组和C8-HSL组的氨氮降解速率不断升高(氨氮、亚硝酸盐氮的降解速率详见表2),但升高的幅度有所降低,这可能是因为自诱导物的降解[14],导致对Anammox的脱氮促进作用的减弱[14].在实验的6d内,C6-HSL组、C8-HSL组平均氨氮降解速率分别达到0.357、0.511mmol/ (L·d),而空白组的平均氨氮降解速率仅为0.162mmol/(L·d),实验组的氨氮降解速率明显高于空白组,此外,对比C6-HSL组和C8-HSL组,可以发现C8- HSL组的氨氮降解速率更快,但总体的趋势与C6-HSL组相同,可见C8-HSL自诱导物对Anammox降解氨氮的促进作用更显著.
Anammox对亚硝酸盐氮的转化趋势与氨氮降解趋势基本相同(亚硝酸盐氮浓度详见图1(b)).但实验的前2d,出现了亚硝酸盐氮和氨氮去除量的比值明显高于理论值1.32的现象(亚硝酸盐氮和氨氮去除量比值变化详见图2(a)),硝酸盐的生成与氨氮的降解比值也低于理论值0.26(硝酸盐生成与氨氮降解比值变化详见图2(b)).猜测由于反应体系中的反硝化菌的增长,导致亚硝酸盐氮的去除量高于理论值,而生成的硝酸盐因反硝化作用快速降解,导致亚硝酸盐氮与氨氮的去除量比值高于1.32,而硝酸盐生成量与氨氮降解量比值低于0.26.

在进行本实验之前,为减小各个血清瓶中的Anammox污泥的差异性,对Anammox菌群进行了低强度的超声,打散聚集的菌群,后将絮体菌群等体积加入各个血清瓶中.Yu等[23]发现经过超声处理,污泥中的部分细胞将破碎,胞内可溶性的有机物将破胞而出,成为反硝化菌的有机底物.因此在反应开始阶段,反硝化菌以可溶性有机物作为碳源,亚硝酸盐、硝酸盐作为氮源进行反硝化反应.随着碳源被消耗尽,反硝化反应中失去了电子供体,反硝化菌无法降解亚硝酸盐氮和硝酸盐,血清瓶内AnAOB占主导,降解亚硝酸盐氮和降解氨氮的比值也逐渐趋于理论比值1.32.生成硝酸盐和降解氨氮的比值也趋于理论值0.26. C6-HSL组和C8-HSL组对亚硝盐氮的降解速率要明显高于空白组,C6-HSL组亚硝酸盐氮的降解速率从第1d的0.172mmol/(L·d) 上升到第6d的0.667mmol/ (L·d),C8-HSL组亚硝酸盐氮的降解率从第1d的0.200mmol/(L·d)上升到第6d的1.204mmol/(L·d),而空白组仅从第1d的0.011mmol/(L·d)上升到第6d的0.319mmol/(L·d).第6d,C6-HSL组的氨氮和亚硝酸盐氮降解速率达到空白组的2倍,C8-HSL组达到空白组的3倍.本实验的结果与Tang等的结果接近,C6-HSL与C8-HSL都对Anammox菌的脱氮性能有一定的促进作用[14].


表2 氨氮与亚硝酸盐氮降解速率
2.2 外添加C6-HSL、C8-HSL对厌氧氨氧化菌生长情况的影响
为探究外添加自诱导物对AnAOB生长情况的影响,对AnAOB中的联氨合成酶基因丰度进行检测,用联氨合成酶基因丰度的变化来表征AnAOB的生长情况. 3组实验表明;AnAOB的增长率基本呈现逐渐上升趋势,但增长速度有明显的差别(联氨合成酶基因丰度变化详见图3).研究中发现与空白组相比较,C6-HSL组和C8-HSL组AnAOB菌群的生长更缓慢.C6-HSL组中AnAOB的DNA含量从反应开始阶段的7×104copies/mL增长到第6d的9.8×104copies/ mL,C8-HSL组第6d时增长到11.8×104copies/ mL,而空白组第6d时已增长到15×104copies/mL.在反应的开始的24h内,3组的增长率都<5%,到了第6d C6-HSL组、C8-HSL组和空白组的增长率分别达到7.6%、16.9%和17.8%,6d内增长率均值分别为5.6%、8.1%和13%(AnAOB增长率变化详见表3).空白组的AnAOB的生长情况从含量和增长速率都要明显高于外添加自诱导物组,可见实验选取的2种自诱导物对AnAOB的生长并没有促进作用,反而有抑制作用,这与多数报道的研究结果相反,De等[24]认为AHLs能加大AnAOB的生长,Tang等[14]则指出C6-HSL、C8-HSL这两种AHLs能加快AnAOB的生长速率[14].而在有关AHLs对菌群生长速率影响的探究中,Hu等[25]表明不同浓度的AHLs对菌群生长速率的影响有很大的差别,对比外添加5, 50, 500nmol/L的AHLs,只有外添加5nM自诱导物组的生物量生长速度大于空白组,外添加自诱导物50nM和500nmol/L组的生物量生长速度都小于空白组[25].本实验选取了0.5g/L的自诱导物浓度,约为2mmol/L,高于抑制生物量生长的浓度.因此可能出现添加自诱导物组生物量生长速度不如空白组的现象.Hu等还指出,高浓度(500nmol/L)的AHLs能够刺激胞外聚合物的生成,而本试验中选取的AHLs浓度高于500nmol/L,能刺激胞外聚合物的生成.Chen等[27]在实验中证明,胞外聚合物的合成需要先消耗细胞内的部分能量,剩余的能量再用于生物量的增长.因此本实验中两组实验组可能因自诱导物(C6-HSL、C8-HSL)刺激胞外聚合物的生成,先消耗了细胞内的部分能量,使细胞的生长增值滞后,而出现了生物量的增长不如空白组的现象.

表3 AnAOB增长速率变化
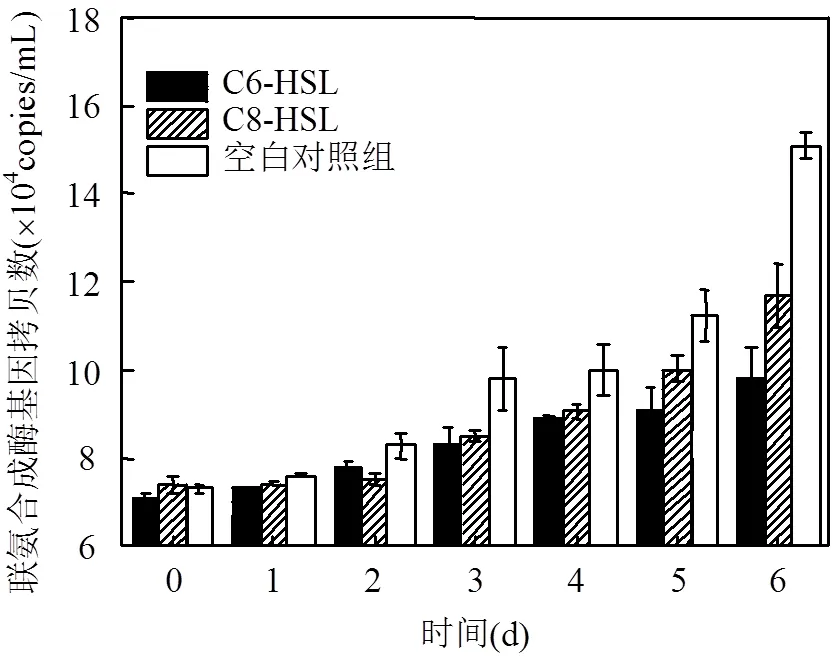
图3 联氨合成酶基因丰度变化
2.3 C6-HSL、C8-HSL对hzsA基因表达的影响
研究发现,随着Anammox反应的进行,单位AnAOB的联氨合成酶基因的表达也逐渐加强,但在第1d,各组联氨合成酶基因的表达情况相较起始都有一个明显的下降,外添加C6-HSL组、C8-HSL组和空白组分别从第0时刻的24.5、30.8和19.5降低到第1d的12.6、20.6和12.7,这与脱氮性能探究中的氮元素的变化趋势一致,认为是反硝化菌增长,与AnAOB竞争氮素底物亚硝酸盐,导致AnAOB的生长受到抑制,与Anammox活性相关的联氨合成酶基因的表达也受到抑制.从实验的第2d起,除个别样品点,如空白组的第1d~第3d有所起伏,其余总体呈现联氨合成酶基因表达逐渐加强的趋势.有所起伏的点推测可能是因为在mRNA提取和RT-PCR的过程中误差偏大造成的,从回收率表可以看到如空白组第2d、C6-HSL组第0d以及C8-HSL组第3d的回收率低于0.5.比较添加外源自诱导物C6-HSL组、C8-HSL组和空白组的联氨合成酶基因表达情况,可见添加外源自诱导物C6-HSL组和C8-HSL组的联氨合成酶基因表达明显强于空白组.外添加C6-HSL组、C8-HSL组和空白组分别从0时刻的24.5、30.8 和12.7增长到第6d的1588.7、2387.7和131(联氨合成酶基因的表达丰度变化详见图4),C6-HSL组、C8-HSL组的基因表达丰度分别为空白组的12倍、18倍.因此,虽然高浓度的AHLs对AnAOB的生长有一定的抑制[25],但并没有抑制Anammox相关基因联氨合成酶基因的表达.

表4 RT-PCR回收率

图4 mRNA水平上联氨合成酶基因丰度的变化
这也就能解释为什么外添加AHLs的两组AnAOB的生长情况不如空白组,但脱氮性能却高于空白组,其内在原因是添加的外源自诱导物C6-HSL和C8-HSL促进了联氨合成酶基因的表达,因此脱氮性能也更好.
2.4 自诱导物AHLs诱导AnAOB基因表达的机理模型
根据实验结论模拟自诱导物AHLs诱导AnAOB基因表达的模型(模型详见图5).模型工作原理为:AnAOB分泌的AHLs与细胞内的结合蛋白相结合,形成AHLs—结合蛋白复合物并激活Anammox相关基因.只有AHLs—结合蛋白复合物能激活基因,未相互结合的AHLs和结合蛋白并不能单独作用激活基因.当Anammox相关基因被激活并开始表达后,AnAOB便具有了活性.此外,不同的AHLs诱导基因表达的能力也有所差别,如相同浓度下的C8-HSL较C6-HSL对Anammox 脱氮基因的激活能力更强,C12-HSL对Anammox的生长率促进作用较明显[26].

图5 高丝氨酸内酯诱导AnAOB基因表达模型
AHLs:高丝氨酸内酯; AmxR:AHLs结合蛋白;AmxR-AHLs complex:高丝氨酸内酯-结合蛋白复合物;AmxA gene: AMX基因; Amx I:AMX活性蛋白
3 结论
3.1 C6-HSL、C8-HSL两种自诱导物能提高Anammox的脱氮效率,且C8-HSL比C6-HSL对脱氮性能的影响更大.本试验中C6-HSL组的氨氮和亚硝态氮降解速率最高能达到空白组的2倍,C8-HSL组最高能达到空白组的3倍.因此认为添加C6-HSL和C8-HSL可提高氮的去除率.
3.2 本实验选取的0.5g/L的C6-HSL、C8-HSL两种自诱导物会抑制Anammox菌群的生长,且C6-HSL的抑制作用更为明显.
3.3 C6-HSL、C8-HSL两种自诱导物能够促进AnAOB功能基因联氨合成酶基因的表达,且C8-HSL的促进作用更明显,本试验中C6-HSL组、C8-HSL组的基因表达丰度最高能达到空白组的12倍、18倍.
[1] 贾方旭,彭永臻,杨 庆.厌氧氨氧化菌与其他细菌之间的协同竞争关系[J]. 环境科学学报, 2014,34(6):1351-1361.
[2] Van De Graaf A A, De Bruijn P, Robertson L A, et al. Metabolic pathway of anaerobic ammonium oxidation on the basis of 15N studies in a fluidized bed reactor [J]. Microbiology, 1997,143(7): 2415-2421.
[3] Mosquera-Corral A, Gonzalez F, Campos J L, et al. Partial nitrification in a SHARON reactor in the presence of salts and organic carbon compounds [J]. Process Biochemistry, 2005,40(9): 3109-3118.
[4] 贾方旭,彭永臻,王衫允,等.厌氧氨氧化菌细胞的超微结构及功能[J]. 应用与环境生物学报, 2014,20(5):944-954.
[5] Kartal B, Kuenen J G, Van Loosdrecht M C M. Sewage treatment with anammox [J]. Science, 2010,328(5979):702-703.
[6] Eberhard A, Burlingame A L, Eberhard C, et al. Structural identification of autoinducer of Photobacterium fischeri luciferase [J]. Biochemistry, 1981,20(9):2444-2449.
[7] Swift S, Throup J P, Williams P, et al. Quorum sensing: a population-density component in the determination of bacterial phenotype [J]. Trends in biochemical sciences, 1996,21(6):214- 219.
[8] Miller M B, Bassler B L. Quorum sensing in bacteria [J]. Annual Reviews in Microbiology, 2001,55(1):165-199.
[9] Jia F, Yang Q, Han J, et al. Modeling optimization and evaluation of tightly bound extracellular polymeric substances extraction by sonication [J]. Applied Microbiology & Biotechnology, 2016, 100(19):1-10.
[10] Jia F, Yang Q, Liu X, et al. Stratification of extracellular polymeric substances (EPS) for aggregated anammox microorganisms [J]. Environmental Science & Technology, 2017, 51(6):3260-3268.
[11] Galloway W R J D, Hodgkinson J T, Bowden S D, et al. Quorum sensing in Gram-negative bacteria: small-molecule modulation of AHL and AI-2quorum sensing pathways [J]. Chemical reviews, 2010,111(1):28-67.
[12] Fuqua C, Winans S C, Greenberg E P. Census and consensus in bacterial ecosystems: the LuxR-LuxI family of quorum-sensing transcriptional regulators [J]. Annual Reviews in Microbiology, 1996,50(1):727-751.
[13] Bassler B L. How bacteria talk to each other: regulation of gene expression by quorum sensing [J]. Current opinion in microbiology, 1999,2(6):582-587.
[14] Tang X, Liu S, Zhang Z, et al. Identification of the release and effects of AHLs in anammox culture for bacteria communication [J]. Chemical Engineering Journal, 2015,273:184-191.
[15] Suneethi S, Joseph K. Batch culture enrichment of ANAMMOX populations from anaerobic and aerobic seed cultures [J]. Bioresource Technology, 2011,102(2):585-591.
[16] Kartal B, Maalcke W J, de Almeida N M, et al. Molecular mechanism of anaerobic ammonium oxidation [J]. Nature, 2011, 479(7371):127-130.
[17] Meng L, Feldman L. A rapid TRIzol-based two-step method for DNA-free RNA extraction from Arabidopsis siliques and dry seeds [J]. Biotechnology Journal, 2010,5(2):183-186.
[18] Behre G, Smith L T, Tenen D G. Use of a promoterless Renilla luciferase vector as an internal control plasmid for transient co- transfection assays of Ras-mediated transcription activation [J]. Biotechniques, 1999,26(1):24-26.
[19] Marchesi J R, Sato T, Weightman A J, et al. Design and evaluation of useful bacterium-specific PCR primers that, amplify genes coding for bacterial 16S rRNA [J]. Applied & Environmental Microbiology, 1998,64(2):795-799.
[20] Vossenberg J V D, Woebken D, Maalcke W J, et al. The metagenome of the marine anammox bacterium ‘Candidatus Scalindua profunda’ illustrates the versatility of this globally important nitrogen cycle bacterium [J]. Environmental Microbiology, 2013,15(5):1275-1289.
[21] Schmid M, Walsh K, Webb R, et al.Candidatus "Scalindua brodae", sp nov. Candidatus "Scalindua wagneri", sp nov. two new species of anaerobic ammonium oxidizing bacteria [J]. Systematic & Applied Microbiology, 2003,26(4):529-538.
[22] Schmid M, Twachtmann U, Klein M, et al. Molecular evidence for genus level diversity of bacteria capable ofcatalyzing anaerobic ammonium oxidation [J]. Systematic & Applied Microbiology, 2000,23(1):93-106.
[23] Yu G H, He P J, Shao L M, et al. Extracellular proteins, polysaccharides and enzymes impact on sludge aerobic digestion after ultrasonic pretreatment [J]. Water Research, 2008,42(8): 1925-1934.
[24] De C H, Defoirdt T, Vanhaecke L, et al. Long-chain acylhomoserine lactones increase the anoxic ammonium oxidation rate in an OLAND biofilm [J]. Applied Microbiology & Biotechnology, 2011,90(4):1511-1519.
[25] Hu H, He J, Liu J, et al. Biofilm activity and sludge characteristics affected by exogenous N-acyl homoserine lactones in biofilm reactors [J]. Bioresource Technology, 2016,211: 339-347.
[26] Gao F, Zhang H, Yang F, et al. The effects of zero-valent iron (ZVI) and ferroferric oxide (Fe3O4) on anammox activity and granulation in anaerobic continuously stirred tank reactors (CSTR) [J]. Process Biochemistry, 2014,49(11):1970-1978.
[27] Chen T T, Zheng P, Shen L D. Growth and metabolism characteristics of anaerobic ammonium-oxidizing bacteria aggregates [J]. Applied Microbiology & Biotechnology, 2013, 97(12):5575-5583.
Effect of the exogenous autoinducers on the anaerobic ammonium oxidation (anammox).
ZHANG Xiang-hui, PENG Yong-zhen*, JIA Fang-xu, HAN Jin-hao, MA Bin, HE Yang
(Engineering Research Center of Beijing, National Engineering Laboratory for Advanced Municipal Wastewater Treatment and Reuse Technology, Beijing University of Technology, Beijing 100124, China)., 2018,38(5):1727~1733
Nowadays, the anaerobic ammonium oxidation (anammox) process becomes a promising new way of removing nitrogen from wastewater. However, the performance of nitrogen removal is easy to be affected bysludge washout due to the extremely long doubling time of anammox bacteria (AnAOB).As a representative autoinducer of quorum sensing (QS) system, N-acyl-homoserine lactones (AHLs) may regulate the expression of certain genes involved in anammox reaction. Previous researches have indicated that C6-HSL and C8-HSL (two types of AHLs) could stimulate biofilm formation. Therefore, this study mainly focuses on the effect of the exogenous autoinducers (C6-HSL and C8-HSL) on anammox performance. The results showed that the growth of AnAOB was inhibited at AHLs concentration of 0.5g/L, however, the nitrogen removal rate could be enhanced by inducinggene expression in the presence of both C6-HSL and C8-HSL. Moreover, higher expression level ofgene in AnAOB was induced by the amendment of C8-HSL than C6-HSL at the same concentration level.
anammox;quorum sensing;N-acyl-homoserine lactones;
X703
A
1000-6923(2018)05-1727-07
2017-09-29
国家自然科学基金资助项目(51508008);北京市教委资助项目.
*责任作者, 教授, pyz@bjut.edu.cn
张向晖(1992-),女,浙江杭州人,北京工业大学硕士研究生,主要从事污水处理厌氧氨氧化工艺研究.发表论文1篇.

