利拉鲁肽联合枸橼酸氯米芬对多囊卵巢综合征伴胰岛素抵抗患者外周血T细胞亚群及氧化应激水平的影响*
冷少华 王延洲 赵小兰
(陆军军医大学附属西南医院,1.健康管理中心;2.妇产科,重庆 400038)
多囊卵巢综合征(PCOS)是育龄期妇女常见的一种代谢异常、神经内分泌紊乱的综合性疾病,其临床症状主要包括:月经稀发或闭经、多毛、肥胖、长期不排卵及高雄激素血症等[1-3]。胰岛素抵抗(IR)主要是指正常水平的胰岛素促进葡萄糖利用能力和摄取能力下降,机体各器官、组织代偿性分泌胰岛素以维持机体血糖稳定的代谢状态[4]。近年来研究表明PCOS与IR关系紧密,且认为IR和高胰岛素血症是PCOS的决定性因素[5-6]。临床上积极寻求有效的治疗方法是近年来临床研究热点。本文研究旨在探讨利拉鲁肽联合枸橼酸氯米芬对多囊卵巢综合征伴胰岛素抵抗患者外周血T细胞亚群及氧化应激水平的影响。
1 资料与方法
1.1 一般资料 选自我院于2014年12月~2016年12月期间收治的PCOS伴IR患者92例。按照随机表法分为观察组46例与对照组46例。观察组46例中,年龄20~39岁、平均年龄(27.94±3.56)岁,平均体重指数(BMI)(22.64±1.87)kg/m2;对照组46例中,年龄21~40岁、平均年龄(27.56±3.71)岁,平均BMI(22.59±2.03)kg/m2。诊断标准:PCOS诊断依据《妇产科学》[7]标准:月经稀发或闭经及以下两个标准中的一条:B超卵巢呈多囊性改变,临床或者生化的高雄激素血症;IR诊断标准:按照空腹血糖(FPG)和胰岛素测定值,计算出稳态模型(HOMA)下的胰岛素抵抗指数HOMA-Ir=FPG×空腹胰岛素/22.5,按照国际通用标准HOMA-IR≥2.77为胰岛素抵抗。入组标准及排除标准: 入组标准:①符合PCOS和IR诊断标准者。②经医院伦理委员会许可。③签订知情同意书者。排除标准:①由高泌乳素血症、下丘脑性闭经或垂体、先天性肾上腺皮质增生、甲状腺功能等造成排卵障碍者。②合并肺、肾、肝等功能严重异常者。③精神疾病者。两组一般资料具有可比性。
1.2 治疗方法
1.2.1 对照组 口服枸橼酸氯米芬胶囊(生产厂家:上海衡山药业有限公司;批准文号:国药准字H31021107)50 mg/次,每日1次,连续应用5 d;观察组:在对照组基础上皮下注射利拉鲁肽(生产厂家:诺和诺德中国制药有限公司;批准文号:注册证号S20110046)0.6 mg/次,每日1次,连续应用5 d。两组疗程均为3个月经周期。
1.2.2 疗效评价标准 ①显效:患者症状、体征消失或者明显改善,以及患者血清激素水平恢复正常或者基本正常。②有效:患者症状、体征改善,以及患者血清激素水平改善。③无效:患者症状、体征及血清激素水平无改善。总有效率=(显效例数+有效例数)/总例数×100%。
1.2.3 观察指标 月经干净后第三天 ①观察两组治疗前和治疗后BMI和卵巢体积变化。②观察两组治疗前和治疗后FINS和HOMA-IR变化。③观察两组治疗前和治疗后激素水平变化,分别于治疗前后抽取3 mL外周静脉血,以离心半径15 cm,转速为每分钟3000转,离心10~12 min,分离血清,于-20℃下保存待测。④观察两组治疗前和治疗后外周血T淋巴细胞亚群水平变化,分别于治疗前后采集3 mL外周静脉血,将其放置于EDTA抗凝管中,且依次加入10 μL CD3+、CD4+、CD8+抗体,放置于室温条件下避光孵育30 min,然后加入溶血素200 μL于每管中,于室温条件下避光放置15 min,裂解红细胞。观察溶液澄清透明后,加入1 mL的预冷PBS溶液中,再放置于室温条件下以离心半径15 cm、3000 r/min、离心12 min,分离血清,然后再滴加100 μL的1%多聚甲醛溶液中固定,测定外周血T淋巴细胞亚群,应用美国BD公司的流式细胞仪及配套试剂。⑤观察两组治疗前和治疗后氧化应激指标水平变化,分别于治疗前后抽取3 mL外周静脉血,以离心半径15 cm,转速为每分钟3000转,离心10~12 min,分离血浆,于-20℃下保存待测。
1.3 统计学分析 采用SPSS19.0软件分析,针对本研究数据中计量资料以t检验,计数资料以2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效比较 观察组治疗总有效率(82.61%)高于对照组(60.87%)(P<0.05),见表1。

表1 两组患者疗效比较[n,(×10-2)]Table 1 The curative effect
2.2 两组患者治疗前后BMI和卵巢体积变化比较 两组治疗前BMI和卵巢体积比较无统计学差异(P>0.05);两组治疗后BMI和卵巢体积降低(观察组:t=12.7845、21.4211,对照组:t=6.8848、9.7507,P<0.05);观察组治疗后BMI和卵巢体积低于对照组(t=6.5840、11.5294,P<0.05),见表2。
2.3 两组患者治疗前后血清激素水平变化比较 两组治疗前LH、FSH和T水平比较无统计学差异(t=0.3174、0.5466、0.4095,P>0.05);两组治疗后LH、FSH和T水平降低(观察组:t=12.0924、21.4211、12.4576,对照组:t=6.2643、3.6756、5.8940,P<0.05);观察组治疗后LH、FSH和T水平低于对照组(t=5.8437、7.0905、7.0161,P<0.05),见表3。
Table2ComparisonofBMIandovarianvolumechangesbeforeandaftertreatment

组别nBMI(kg/m2)卵巢体积(mm3)观察组46 治疗前22.64±1.879.56±0.87 治疗后18.56±1.09①②6.13±0.65①②对照组46 治疗前22.59±2.039.48±0.86 治疗后20.17±1.25①7.83±0.76①
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。

Table3Comparisonofserumhormonelevelsbeforeandaftertreatment
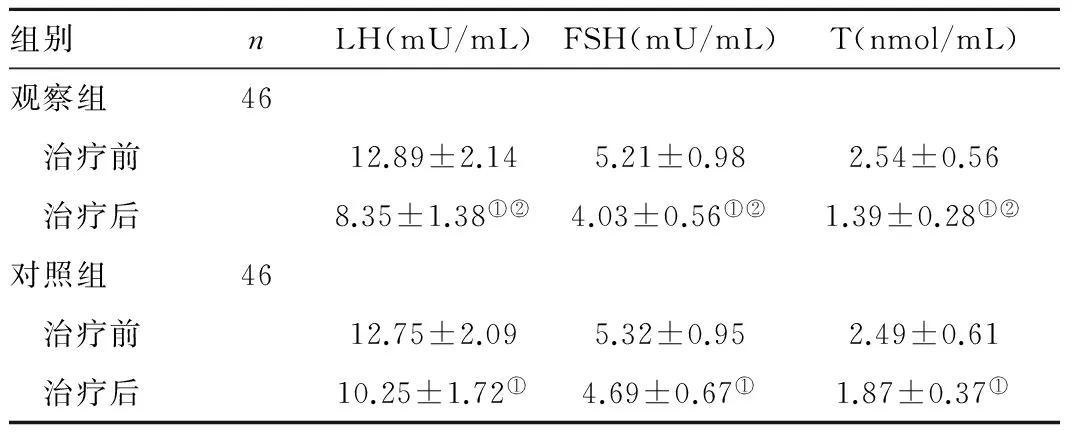
组别nLH(mU/mL)FSH(mU/mL)T(nmol/mL)观察组46 治疗前12.89±2.145.21±0.982.54±0.56 治疗后8.35±1.38①②4.03±0.56①②1.39±0.28①②对照组46 治疗前12.75±2.095.32±0.952.49±0.61 治疗后10.25±1.72①4.69±0.67①1.87±0.37①
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
2.4 两组患者治疗前后FINS和HOMA-IR变化比较 两组治疗前FINS和HOMA-IR比较无统计学差异(t=0.4052、0.1843,P>0.05)。两组治疗后FINS和HOMA-IR降低(观察组:t=19.0150、13.0330,对照组:t=11.2612、6.1503,P<0.05);观察组治疗后FINS和HOMA-IR低于对照组(t=7.6955、7.8588,P<0.05),见表4。

Table4ComparisonofFINSandHOMA-IRbeforeandaftertreatment

组别nFINS(μIU/L)HOMA-IR观察组46 治疗前15.73±1.093.69±0.54 治疗后11.82±0.87①②2.41±0.39①②对照组46 治疗前15.64±1.043.71±0.50 治疗后13.29±0.96①3.10±0.45①
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
2.5 两组患者治疗前后外周血T淋巴细胞亚群变化比较 两组治疗前CD3+、CD4+和CD4+/CD8+比较无统计学差异(t=1.9718、0.2118、0.4081,P>0.05);两组治疗后CD3+和CD4+/CD8+降低(观察组:t=15.2924、8.0866,对照组:t=7.5792、4.5340,P<0.05);观察组治疗后CD3+和CD4+/CD8+低于对照组(t=7.7320、5.9132,P<0.05),见表5。
Table5ChangesofTlymphocytesubsetsinperipheralbloodbeforeandaftertreatment
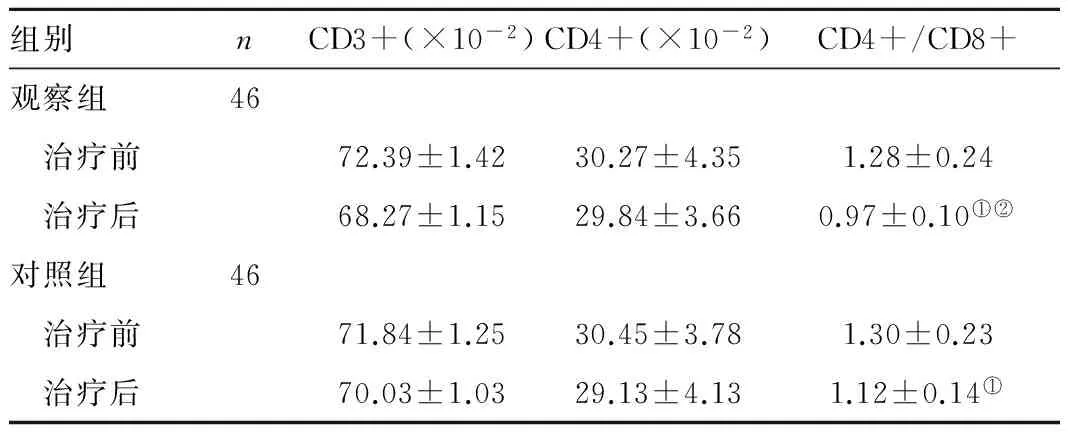
组别nCD3+(×10-2)CD4+(×10-2)CD4+/CD8+观察组46 治疗前72.39±1.4230.27±4.351.28±0.24 治疗后68.27±1.1529.84±3.660.97±0.10①②对照组46 治疗前71.84±1.2530.45±3.781.30±0.23 治疗后70.03±1.0329.13±4.131.12±0.14①
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较②P<0.05。
2.6 两组患者治疗前后氧化应激指标变化比较 两组治疗前MDA和SOD水平比较无统计学差异(P>0.05);两组治疗后MDA降低而SOD增加(观察组:t=16.9844、12.0362,对照组:t=7.8818、5.4794,P<0.05);观察组治疗后MDA低于对照组而SOD高于对照组(t=9.3624、6.6042,P<0.05),见表6。
2.7 两组不良反应比较 观察组治疗期间出现8例不良反应,发生率为17.39%,其中包括胃肠道反应3例、皮疹3例、2例头痛;对照组治疗期间出现5例不良反应,发生率为10.87%,其中包括胃肠道反应3例、2例头痛。两组不良反应发生率比较无统计学差异(X2=0.8062,P>0.05)。
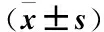
Table6Comparisonofoxidativestressbeforeandaftertreatment

组别nMDA(U/L)SOD(μg/mL)观察组46 治疗前22.69±2.3710.45±2.17 治疗后15.13±1.87①②17.94±3.62①②对照组46 治疗前22.54±2.3410.71±2.31 治疗后18.94±2.03①13.56±2.67①
注:与本组治疗前比较,①P<0.05;与对照组治疗后比较,②P<0.05。
3 讨论
枸橼酸氯米芬是常用于治疗PCOS的一种药物,主要通过提高黄体功能促进排卵,纠正PCOS患者内分泌功能障碍,研究报道表明,部分PCOS患者对克罗米芬促排卵效果不佳,认为其原因可能为存在胰岛素抵抗[8-9]。利拉鲁肽是新一类降糖药物胰高血糖素样肽-1类似物,近年来已成为2型糖尿病患者调整血脂、血压和血糖相关研究的一个新焦点[10]。药理研究表明,利拉鲁肽可通过促进胰岛β细胞的新生和分泌,且能够延缓胰岛β细胞凋亡的速度,改善胰岛素抵抗,且能够延缓胃排空,抑制胰高血糖的分泌,减少进食,已广泛应用于临床[11-12]。本研究结果表明,观察组治疗总有效率高于对照组,说明利拉鲁肽联合枸橼酸氯米芬可提高疗效;观察组治疗后LH、FSH和T水平低于对照组,说明利拉鲁肽联合枸橼酸氯米芬可可降低激素水平;观察组治疗后FINS和HOMA-IR低于对照组,说明利拉鲁肽联合枸橼酸氯米芬可改善患者胰岛功能;两组不良反应发生率比较无统计学差异,说明利拉鲁肽联合枸橼酸氯米芬用药安全性良好。
正常免疫应答过程主要依赖于各种免疫细胞,尤其是各T淋巴细胞亚群间的相互制约与相互协调。T淋巴细胞辅助受体CD4、CD8不能同时表达成熟的T淋巴细胞表面,因此,应用CD4单克隆抗体与CD8单克隆抗体可将外周血中或者外周淋巴器官中的T淋巴细胞分为2个主要亚群CD4+和CD8+[14-15]。成熟的T淋巴细胞表面均可表达CD3分子。外周血T淋巴细胞亚群在数量上的协调比例,尤其是CD4+/CD8+的比值是反映细胞免疫平衡的重要敏感指标,从而有利于反映机体免疫反映的调节能力。近年来研究表明,PCOS伴IR患者体内免疫活跃,认为可能与自身免疫相关,且其体内存在免疫异常,表现为细胞免疫增强[16]。本研究结果表明,观察组治疗后CD3+和CD4+/CD8+低于对照组,说明利拉鲁肽联合枸橼酸氯米芬可改善患者细胞免疫功能。
氧化应激反应增强时PCOS重要的一个病理过程,其中血中大量氧化应激物质能够加重卵巢功能损伤,从而致使PCOS体内激素水平紊乱加重。PCOS患者体内氧化应激反应程度增加会使得卵泡细胞中钙离子负荷促进细胞凋亡的加重。近年来研究认为PCOS氧化应激状态可能与IR密切相关[17]。本研究结果表明,观察组治疗后MDA低于对照组而SOD高于对照组,说明利拉鲁肽联合枸橼酸氯米芬可改善患者氧化应激反应。
4 结论
利拉鲁肽联合枸橼酸氯米芬对多囊卵巢综合征伴胰岛素抵抗患者疗效明显,可显著改善患者外周血T淋巴细胞亚群和氧化应激,具有重要的临床应用价值。
【参考文献】
[1]Kort D H, Kostolias A, Sullivan C,etal. Chemerin as a marker of body fat and insulin resistance in women with polycystic ovary syndrome[J]. Gynecological Endocrinology the Official Journal of the International Society of Gynecological Endocrinology, 2015, 31(2):152-5.
[2]Ac S D S, Soares N P, Costa E C,etal. The impact of body mass on inflammatory markers and insulin resistance in polycystic ovary syndrome[J]. Gynecological Endocrinology the Official Journal of the International Society of Gynecological Endocrinology, 2015, 31(3):225-8.
[3]Zhang D, Zhang L, Yue F,etal. Serum zonulin is elevated in women with polycystic ovary syndrome and correlates with insulin resistance and severity of anovulation[J]. European Journal of Endocrinology, 2015, 172(1):29-36.
[4]Cassar S, Misso M L, Hopkins W G,etal. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic-hyperinsulinaemic clamp studies[J]. Human Reproduction, 2016, 31(11):2619-2631.
[5]Polak K, Czyzyk A, Simoncini T,etal. New markers of insulin resistance in polycystic ovary syndrome[J]. Journal of Endocrinological Investigation, 2016, 40(1):1-8.
[6]余作为, 林冰. 来曲唑与枸橼酸氯米芬治疗多囊卵巢综合征的疗效对比研究[J]. 北方药学, 2016, 13(11):70-71.
[7]乐杰. 妇产科学[M]. 第7版. 北京:人民卫生出版社, 2006:201-202.
[8]刘淑娟. 二甲双胍联合枸橼酸氯米芬治疗多囊卵巢综合征的疗效评价[J]. 吉林医学, 2016, 37(9):2268-2269.
[9]刘海英, 李金霞, 韩鹏. 二甲双胍联合枸橼酸氯米芬治疗多囊卵巢综合征患者疗效观察[J]. 中国生化药物杂志, 2015, 35(3):147-149.
[10] 许海, 马丹凤, 赵井苓, 等. 艾塞那肽联合枸橼酸氯米芬治疗多囊卵巢综合征伴胰岛素抵抗的临床观察[J]. 中国药房, 2017, 28(12):1606-1609.
[11] 高丽华, 张彩兰, 刘旭阳, 等. 利拉鲁肽治疗多囊卵巢综合征合并2型糖尿病患者的初步临床研究[J]. 临床荟萃, 2016, 31(5):539-542.
[12] 高峰. 利拉鲁肽在胰岛素抵抗的2型糖尿病患者应用的临床观察[J]. 医学理论与实践, 2015, 28(16):2133-2134.
[13] 马存花, 王小春, 艾比拜,等. 利拉鲁肽对2型糖尿病患者胰岛素抵抗的影响[J]. 国际检验医学杂志, 2016, 37(17):2398-2400.
[14] Polak K, Czyzyk A, Simoncini T,etal. New markers of insulin resistance in polycystic ovary syndrome[J]. Journal of Endocrinological Investigation, 2017, 40(1):1-8.
[15] Barber T M, Dimitriadis G K, Avgi A,etal. Polycystic ovary syndrome: insight into pathogenesis and a common association with insulin resistance[J]. Clinical Medicine, 2015, 6(6):72-76.
[16] Victor V M, Rovira-Llopis S, Ba uls C,etal. Effects of metformin on mitochondrial function of leukocytes from polycystic ovary syndrome patients with insulin resistance[J]. European Journal of Endocrinology, 2015, 173(5):683.
[17] 孙林, 王海燕, 邵小光. 卵泡液氧化应激指标对PCOS患者IVF结局的影响[J]. 黑龙江医药, 2016, 29(1):49-52.

