注射性壳聚糖β-甘油磷酸钠凝胶负载富血小板血浆和骨髓基质干细胞促进牙周再生的研究*
邓蔡 张丽 冷卫东 历丹 桂婷
(湖北医药学院附属太和医院口腔医学中心牙周科,湖北 十堰 442000)
牙周组织的再生一直以来都是口腔医学领域研究的热点,在再生过程中生长因子发挥了巨大的作用[1,2]。但由于生长因子易失活、易流失的特点,其应用长期以来都受到了限制。近年来,随着组织工程技术的飞速发展,不少理想的生物相容性的支架材料在临床上得到了应用[3-4]。注射性壳聚糖β-甘油磷酸钠(chitosan/β-glycerol phosphate disodium salt,C/GP)是一种生理中性、在37℃时可形成凝胶的物质,对大分子药物具有缓释性,能够作为细胞的载体并维持细胞活性[5,6]。富血小板血浆(platelet-rich plasma,PRP)富含生长因子,能够从自体外周血中提取,故不存在免疫排斥反应,在牙周组织再生中能够发挥巨大作用[4]。骨髓基质干细胞((bone marrow mesenchymal stem cells,BMSCs)是一种理想的种子细胞,具有取材容易、增殖性强、易于成活等多种优势[7,8]。本研究将分析可注射性壳聚糖β-甘油磷酸钠凝胶负载富血小板血浆和骨髓基质干细胞促进牙周再生的效果。
1 材料与方法
1.1 材料来源 取3只健康雄性杂种犬,年龄1~2岁,体重15~20kg。 试剂:医用级壳聚糖(青岛博益特生物材料有限公司提供,脱乙酰度91%),β-甘油磷酸二钠、牛凝血酶、胰蛋白酶(上海研生生化试剂有限公司),优纯级乙酸(国药集团),胎牛血清(西安热默尔生物科技有限公司),DMEM培养液(美国Gibco),人淋巴细胞分离液(深圳市伟通生物科技有限公司)。仪器:CO2培养箱(美国SHELLAB公司),倒置显微镜(上海蔡康光学仪器厂)。
1.2 研究方法
1.2.1 C/GP溶液制备方法 于8ml 0.1mol/L的乙醇溶液中置入壳聚糖0.2g,使用搅拌器搅拌约2h。把0.56gβ-甘油磷酸钠置于2ml双蒸水中搅匀并振荡5min。将上述两种溶液进行20min冰浴,而后把β-甘油磷酸钠逐滴加入壳聚糖溶液并混匀搅拌10min。所得C/GP溶液的β-甘油磷酸钠质量浓度为5.6%,壳聚糖质量浓度为2.0%。
1.2.2 PRP的制备 采集犬静脉血10ml加入装有1ml 10%枸橼酸钠抗凝剂的试管中,立刻采用二次离心法进行PRP的制备,可获得1ml PRP,置于-70℃冰箱中贮存。
1.2.3 BMSCs培养及诱导分化 采集犬髂后上棘骨髓进行BMSCs的原代培养,并对第三代BMSCs进行诱导分化。
1.2.4 根分叉缺损模型的制备 将每只犬的上、下颌的第二、第三前磨牙与第一磨牙共10颗牙作为本次研究的实验牙,对3只犬分别注射0.1ml陆眠宁进行麻醉。依据既往文献[9,10]方法进行前磨牙区Ⅱ度根分叉缺损制备,制备完毕后通过垂直褥式法对牙龈瓣进行缝合。依据随机分组结果对各组模型进行相应处置:A组仅在缺损处注射C/GP;B组在缺损处注射C/GP+PRP(C/GP:PRP=1:2);C组在缺损处注射C/GP+106/m BMSCs;D组在缺损处注射C/GP+PRP+106/m BMSCs;对照组在缺损处不注射任何物质。术后连续3天对犬进行青霉素静注以防感染,1周内食用流质食物,此后转为半流质食物。
1.2.5 标本处理与组织学观察 术后8周将实验犬处死,采集样本用40g/L甲醛固定3天,常规脱钙处理,制作5μm厚切片,每个组织随机选取10个切片进行观察测量。在光学显微镜下对新生牙周组织部位的再生情况进行观察,并用微尺对新生牙骨质、新生牙周膜组织、新生牙槽骨的新生情况进行测定。同时,对各组牙周缺损再生情况进行X线观察。

2 结果
2.1 实验结果 所有实验犬在术后均未发生异常症状,处死时均健康状况良好。实验牙周边未见牙石,牙龈部位愈合理想,深度约为1.2~1.7mm。
2.2 牙周缺损X线片观察结果 观察X线片可知,B、C、D组的牙周缺损部位均有明显的牙槽再生现象,且骨密度均显著高于A组与对照组。见图1。
2.3 组织学观察与测量结果 B组、C组及D组观察镜下均可见新生牙槽骨、新生牙骨质和新生牙周膜纤维生长,D组牙周组织再生最为明显,新生的牙槽骨几乎充满根分叉区。而A组与对照组的新生牙组织则较少,根分叉区存在大量上皮组织(见图2)。结果显示,B、C、D组的新生牙槽骨、新生牙骨质和新生牙周膜纤维测量值均显著高于A组和对照组(P<0.05);D组各指标值显著高于B和C组(P<0.05),差异均有统计学意义;A组和对照组仅有少量的牙周组织再生,两组差异不显著(P>0.05),见表1。

Table1Measurementsofalveolarbone,newcementumandperiodontalligamentfiberineachgroup

组别新生牙槽骨新生牙骨质新生牙周膜纤维A组1.80±0.251.78±0.351.69±0.21B组4.22±0.29①4.16±0.30a①4.14±0.23①C组4.17±0.31①4.14±0.19①4.03±0.29①D组4.91±0.39①②4.79±0.26①②4.72±0.31①②对照组1.87±0.231.76±0.241.74±0.30
注:与A组、对照组相比,①P<0.05;与B组、C组相比,②P<0.05
3 讨论
注射性壳聚糖β-甘油磷酸钠(C/GP)作为新型的可注射性温敏凝胶,生物相容性良好,目前已经被作为种子细胞和生长因子载体在组织工程中被广泛利用。有研究曾将C/GP作为支架材料,并负载髓核细胞进行培养,结果显示髓核细胞能够正常增殖,且其中Ⅱ型胶原表达较高[11,12]。PRP是一种包含有多种生长因子的全血提取物,具有制备简易、自体无毒等特点,是理想的生长因子来源。BMSCs则是一种未分化的原始祖细胞,有研究证明BMSCs能够有效修复根分叉缺损,在牙骨质、牙槽骨等组织的修复中起到重要作用[13,14]。
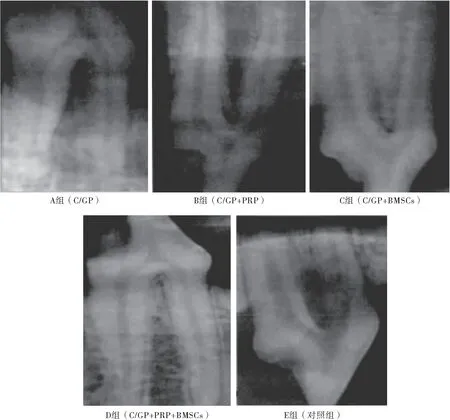
图1各组术后8周牙周缺损X线片图
Figure1X-rayfilmofperiodontaldefectat8weeksafteroperation

图2 术后8周各组牙周缺损处牙周组织再生情况Figure 2 Periodontal tissue regeneration in periodontal defect at 8 weeks after operation注:A.对照组;B.C/GP;C.C/GP+PRP;D.C/GP+BMSCs ;E、F.C/GP+PRP+BMSCs
由于牙周炎造成的牙周组织缺损往往极不规则,选择合适的支架材料与生长因子使缺损区得到充分的修复是当前急需解决的问题[15,16]。本研究中所使用的C/GP在常温下为溶液,可以向缺损区进行注射使之充满缺损部位,并通过原位凝固维持空间和释放生长因子。结果显示,A组与对照组牙槽虽出现了再生现象,但新生牙组织则较少,并且根分叉区存在大量上皮组织。这表明了C/GP能够较好的与组织相容,且不会造成根分叉缺损部位的不良反应,但同时C/GP也不会对牙周组织的再生起到促进作用。既往文献报道中,往往只研究了单一生长因子在牙周组织再生中发挥的作用,但单一生长因子由于不具有多生长因子联用发挥协同作用的优势,因此效果并不理想[17,18]。本研究分析了C/GP+PRP+BMSCs 对牙周组织再生中的应用效果,结果显示B组、C组及D组均有新生牙槽骨、新生牙骨质和新生牙周膜纤维生长,D组牙周组织再生最为明显,且各指标测量值均显著高于A组、对照组(P<0.05),D组各指标值显著高于B、C组(P<0.05)。这表明PRP的使用能够有效提高牙周组织的再生与愈合,PRP与C/GP由于在液态时复合,因此复合更为均匀,保证了材料内的PRP不会轻易经血液冲刷等流失,能够在缺损部位释放高浓度的生长因子。D组的牙周组织再生最为显著,这可能是由于C/GP在原位凝固后为BMSCs创造了一个立体增殖空间,再加之PRP中高浓度生长因子的释放,BMSCs在牙周组织中的分化与增殖更为迅速。有研究表明,1%的PRP即可使BMSCs增殖速度加快,二者联用能够发挥良好的骨修复效果[19,20]。
4 结论
本文资料显示,C/GP负载PRP和BMSCs有助于促进牙周组织的再生,值得在临床进一步深入研究与利用。
【参考文献】
[1]于新波. 牙龈间充质干细胞与牙周膜干细胞膜片牙周再生能力的实验研究[D]. 山东大学, 2014.
[2]巴格那. 可注射性纳米壳聚糖骨形成蛋白-2复合体用于大鼠实验性牙周炎的效果研究[D]. 兰州大学, 2015.
[3]Yu B, Zhang Y, Li X,etal. The use of injectable Chitosan/Nanohydroxyapatite/collagen composites with bone marrow mesenchymal stem cells to promote ectopic bone formation in vivo[J]. Journal of Nanomaterials, 2013, 2013(3):3805-3816.
[4]赵月亮. 自体富血小板纤维蛋白牙周再生治疗的护理配合[J]. 天津护理, 2015, 23(5):429-430.
[5]朱斌, 赵喜聪, 李楠,等. 组织特异性间充质干细胞的牙周再生对比[J]. 口腔生物医学, 2015, 6(3):150-154.
[6]Khojasteh A, Behnia H, Hosseini F S,etal. The effect of PCL-TCP scaffold loaded with mesenchymal stem cells on vertical bone augmentation in dog mandible: A preliminary report [J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2013, 101(5):848-854.
[7]徐景. 早期拔牙窝愈合组织对牙周组织再生的动物实验研究[D]. 山东大学, 2015.
[8]马君义, 陈香玲, 盛爱霞,等. 载高乌甲素可注射壳聚糖/β-甘油磷酸钠温敏水凝胶的制备与性能研究[J]. 中国药学杂志, 2015, 50(19):1696-1703.
[9]Oliveira J M, Sousa R A, Kotobuki N,etal. The osteogenic differentiation of rat bone marrow stromal cells cultured with dexamethasone-loaded carboxymethylchitosan/poly(amidoamine) dendrimer nanoparticles.[J]. Biomaterials, 2009, 30(5):804-813.
[10] 王阿娴, 唐丽, 梁源,等. 人骨髓来源细胞外基质对人牙周膜干细胞增殖的影响[J]. 中国组织工程研究, 2014, 18(6):938-943.
[11] 王敬, 徐燕, 杨洋,等. 生长因子在牙周炎位点保存中促进骨组织再生的观察[J]. 安徽医科大学学报, 2016, 51(9):1329-1333.
[12] Kusumastuti Y, Shibasaki Y, Hirohara S,etal. Encapsulation of rat bone marrow stromal cells using a poly-ion complex gel of chitosan and succinylated poly(Pro-Hyp-Gly)[J]. Journal of Tissue Engineering & Regenerative Medicine, 2015, 215(11):249-262.
[13] 高莹. 自体浓缩生长因子(CGF)在犬牙周组织缺损再生中的研究[D]. 山东大学, 2015.
[14] 李树臣, 尚绪山, 李东,等. PRP联合盐酸川芎嗪对BMSCs体外增殖及向成骨细胞分化的影响[J]. 生物骨科材料与临床研究, 2015, 12(5):1-4.
[15] Wang N, Yang Z, Zang M,etal. Carbon nanotubes functionalized with fibroblast growth factor accelerate proliferation of bone marrow-derived stromal cells and bone formation[J]. Nanotechnology, 2013, 24(43):435101-435101.
[16] Gnecchi M, Melo L G. Bone marrow-derived mesenchymal stem cells: isolation, expansion, characterization, viral transduction, and production of conditioned medium[J]. Methods in Molecular Biology, 2009, 482(2):281.
[17] 许春姣, 郭峰, 高清平,等. 骨髓基质干细胞与黄芪-壳聚糖/聚乳酸支架对犬牙周骨缺损再生的影响[J]. 中南大学学报(医学版), 2006, 31(4):512-517.
[18] 陈玉阳. 可注射纳米壳聚糖/骨形成蛋白复合物修复大鼠颌骨缺损的实验研究[D]. 兰州大学, 2014.
[19] 赵清桐, 赖仁发, 汪距,等. 壳聚糖/β-磷酸三钙/重组人骨形态发生蛋白2可注射性复合体修复兔下颌骨缺损[J]. 中国组织工程研究, 2009, 13(51):10065-10068.
[20] 谢富强, 鱼灵会, 王新,等. 骨形态发生蛋白氰基丙烯酸复合修复大鼠下颌骨骨缺损的实验研究[C]// 全国口腔颌面外科修复重建学术会议暨国际研讨会. 2013.

