庆大霉素通过调节大鼠慢性炎症控制高脂饮食对高血压的影响*
欧阳辉 刘涛 朱兴春
(1.西南医科大学临床医学院,四川 泸州 646000;2.南充市中心医院心内科,四川 南充 637000;3.川北医学院基础医学院病原生物学与免疫学实验教学中心,四川 南充 637000;4.南充市中心医院·川北医学院第二临床医学院组织工程与干细胞研究所,四川 南充 637000)
高血压是全球最常见的心血管系统疾病之一[1]。早期国外研究报道:高脂饮食与高血压发生密切相关,但未阐明其具体机制[2]。研究证实:庆大霉素灌胃干预能降低血中内毒素水平[3],而高脂喂食则认为是内毒素升高的启动因素之一,内毒素可引起机体低度炎症[4-5],而炎症系统在高血压发生发展的病理机制中扮演着重要的角色[6-7]。故本研究模拟机体通过高脂饮食导致血压升高的病理环境、以及硫酸庆大霉素灌胃干预后血压水平的变化、探索内毒素和炎症因子在其中的作用,旨在寻找高脂喂食所致血压升高的可能机制。
1 材料与方法
1.1 实验设备 多通道鼠尾动脉无创血压仪BP6A;酶标仪;离心机;恒温水浴箱实验试剂IL-1βELISA试剂盒购自南京凯基生物科技发展有限公司,胰岛素ELISA试剂盒购自美国CLOUD-CLONE CORP公司;内毒素检测试剂盒购自厦门鲎试剂实验厂有限公司;硫酸庆大霉素购自四川省长征药业有限公司。
1.2 方法
1.2.1 实验动物与分组 清洁级健康雄性SD大鼠37只,8周龄,体质量160~200g,来自川北医学院实验动物中心(动物合格证号:SYXK(川)2013-076)。大鼠每3只或4只一笼,饲养于川北医学院实验动物中心,室内昼夜温度(26±2℃)湿度50%左右,自由进食饮水,12h明暗周期。适应性喂养1周后随机分为三组,对照组(11只)、高脂组(13只)、庆大霉素组(13只)。给予对照组标准饲料喂食;给予高脂组及庆大霉素组高脂饲料喂食,各饲料成分和能量供给(见表1)。第5周开始每周采用无创尾动脉测血压法监测大鼠血压,第9周开始庆大霉素组按照硫酸庆大霉素7.2mg/(kg d)[3]的标准给予灌胃干预,高脂组及对照组给予等体积生理盐水灌胃。第13周末处死大鼠,收集标本。
1.2.2 无创血压监测 实验大鼠适应性喂养1周后,测得的血压值作为基线水平。每周对大鼠进行束缚实验训练,减小后续血压监测实验中应激反应对血压的干扰。第5周开始,应用BP6A动脉无创血压仪尾套法测量尾动脉血压。将清醒大鼠放入配套的大鼠笼,每次将3只大鼠放入无创血压保温箱中,温度调至37℃底板开始加热,点击自检按钮,排除漏气后可使用。依次将阻断器、传感器套于大鼠距尾根部较近处,当电脑显示屏中基线出现稳定均匀的锯齿脉搏波时,说明此时探测到大鼠脉搏且大鼠处于安静状态,给大鼠尾部阻断气囊充气加压,当阻断器开始放气减压至脉搏波刚开始出现时记录为收缩压,继续减压会出现一个波峰,在波峰处则记录为舒张压,再继续减压随及可出现大鼠平均动脉压。记录血压的变化规律每只大鼠连续测定3~5次,取其大鼠安静状态下的血压值,每周测1次。

表1 大鼠饲料成份表Table 1 Feed ingredients in rats
1.2.3 标本收集 药物干预至第13周结束,2.5%戊巴比妥钠50mg/kg腹腔注射。大鼠固定、皮肤消毒完毕,依次剖开腹、胸腔,用去热源注射器右心室采血4ml注入去热源肝素采血管;同样方法采集4ml血至普通肝素采血管,30min内置于冰盒内,1000×g离心15min,取上清液置于﹣80℃保存。
1.2.4 血浆内毒素、IL-1β测定 血浆内毒素采用终点显色法测定;炎症因子IL-1β采用ELISA法检测,所有操作步骤均按说明书进行。
1.2.5 血糖、胰岛素及胰岛素抵抗检测 采用自动生化分析仪测定空腹血糖浓度;空腹胰岛素采用ELISA试剂盒测定。计算稳态模型评估胰岛素抵抗指数(homeostasis model assessment insulin resistenceindex,HOMA-IR),方法:HOMA-Ir=空腹血糖×空腹胰岛素/22.5 。

2 结果
2.1 大鼠一般情况、体质量变化及生存分析 对不同组大鼠各个时间点(各次重复测量)行体质量监测,重复测量方差分析结果示:Mauchly的球形对称检验结果认为数据不满足球对称条件(P<0.05),结果需校正,Greenhouse-Geisser主体内效应的检验,不同时间点大鼠体质量差异有统计学意义(F=263.28,P<0.05);时间与干预方法的交互作用差异有统计学意义(F=1.848,P<0.05);不同干预组间效应检验,F=2.668,P>0.05,差异无统计学意义,可以认为3组不同的干预方法对大鼠体质量影响无差异。体质量变化趋势(见图1)。高脂组大鼠行动迟缓,毛发无光泽,呼吸急促;庆大霉素组大鼠死亡3只,死亡后立即解剖大鼠可见肺部严重感染灶,切面可见大量脓性分泌物(见图2),大鼠可能死于严重感染。高脂喂食组由于灌胃时操作不当窒息死亡1只。共死亡4只大鼠,死亡率为10.8%。

图1 大鼠体质量变化趋势图Figure 1 Trend of body mass change in rats
注:三组不同的干预方法对大鼠体质量影响差异无统计学意义P>0.05

图2 庆大霉素组死亡大鼠尸体解剖均为肺部感染Figure 2 Abdominal infection of the deod rats in gentamicin group
2.2 大鼠血压变化 对三组大鼠每周行收缩压监测,重复测量方差分析结果示:Mauchly的球形对称检验满足对称条件(P=0.736>0.05);主体内效应的检验,F=6.223,P<0.05;时间与干预方法的交互作用F=13.738,P<0.05;不同干预组间效应检验F=189.61,P<0.05,可以认为3组不同的干预方法对收缩压影响有差异。第1周,3组大鼠收缩压的基线值水平一致(P>0.05)。第5周时,高脂组和庆大霉素组大鼠的收缩压显著高于基线水平且高于对照组(P<0.05),而对照组大鼠收缩压较基线水平变化不明显(P>0.05)。随着喂养时间延长,高脂组和庆大霉素组大鼠收缩压逐渐升高,而对照组大鼠收缩压无明显变化。第5~8周,高脂组和庆大霉素组收缩压均明显高于对照组(P<0.05),高脂组和庆大霉素组收缩压(P>0.05)。第9周灌胃干预后,庆大霉素组大鼠收缩压逐渐下降,从第11周至第13周结束,庆大霉素组的收缩压与对照组比较(P>0.05),但从第10周至第13周显著低于高脂组大鼠收缩压(P<0.05)。从实验初始至结束,对照组收缩压变化不明显。从第10周至第13周,将每周测得结果进行三组间比较,高脂组收缩压水平均显著高于对照组和庆大霉素(P<0.05)。大鼠收缩压变化趋势,见表2。

表2 三组大鼠收缩压水平Table 2 The level of systolic pressure in three groups of rats
注:第10~13周为灌胃干预期。与对照组比较①P<0.05,②P>0.05,与高脂组比较③P<0.05,④P>0.05。
2.3 大鼠血浆内毒素及IL-1β测定 硫酸庆大霉素组内毒素水平(0.009±0.002EU/ml)高于对照组(0.006±0.001EU/ml)(P<0.05)、低于高脂组(0.012±0.002EU/ml)(P<0.05);高脂组内毒素水平高于对照组(P<0.05)。对照组血浆IL-1β浓度(90.90±26.67ng/ml)和庆大霉素组血浆IL-1β浓度(106.6±34.84ng/ml)差异无统计学意义(P>0.05),但均低于高脂组(265.63±71.53ng/ml),且差异有统计学意义(P<0.05),见图3,图4。
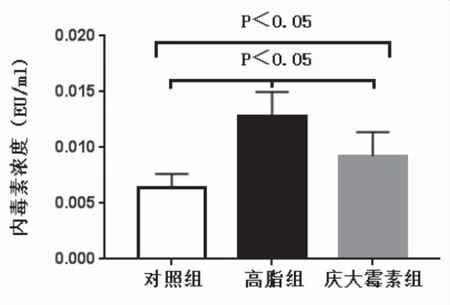
图3 三组大鼠内毒素浓度比较Figure 3 Comparison of endotoxin in the three groups
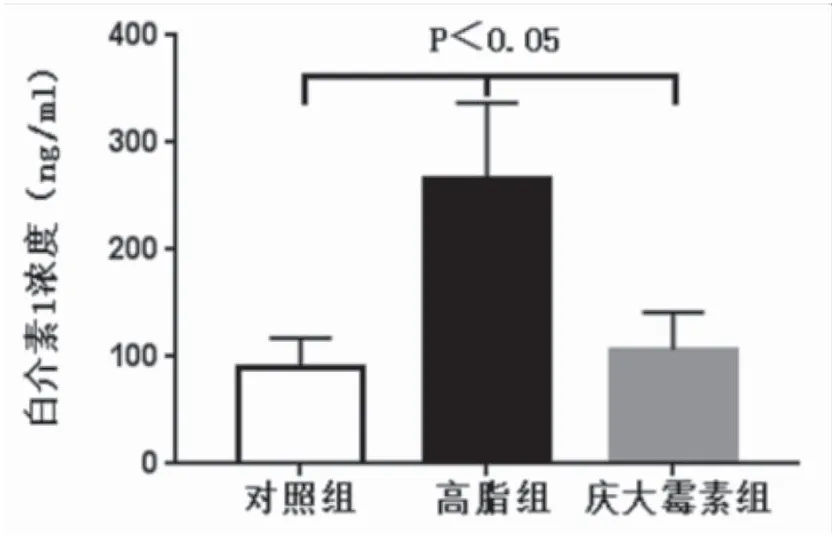
图4 三组大鼠IL-1β水平比较Figure 4 Comparison of IL-1β in three groups of rats
2.4 三组大鼠血浆生化指标的测定比较,见表3。
2.5 大鼠空腹血浆葡萄糖、胰岛素测定,稳态模型评估胰岛素抵抗指数 各项指标,见表4。

表3 三组大鼠生化指标比较Tabre 3 Comparison of biochemical indexes in three groups of rats
注:LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇。与对照组和高脂组比较①P<0.05;与对照组及庆大霉素组比较②P<0.05。

Table4Fastingplasmaglucose,insulinconcentrationandinsulinresistanceinrats

组别n空腹血糖(mmol/L)空腹胰岛素(Pg/ml)HOMA-IR对照组118.36±0.909.52±2.233.50±0.73高脂组127.07±1.0911.87±2.1①3.44±1.61庆大霉素组108.69±0.84②4.59±0.75②1.77±0.33②
注:HOMA-IR:稳态模型评估胰岛素抵抗指数。与对照组和庆大霉素组比较①P<0.05;与对照组和高脂组比较②<0.05。
3 讨论
研究发现,高脂喂食可致循环系统内毒素水平不断增加,内毒素是革兰阴性菌细胞壁的主要成分,可激活TOLL样受体4(TLR4)信号通路和促炎因子产生,导致低度炎症[8]。已有研究报道TNF-α、IL-6、IL-1β等炎症因子能通直接作用于血管内皮细胞、促进血管平滑肌增殖、血管阻力增加从而引起高血压[9-10],结合本实验发现:高脂喂食较普通喂食大鼠其血浆内毒素浓度、IL-1β显著升高,且从高脂喂食第5周至实验结束其收缩压一直显著高于对照组,证实了高脂喂食可通过升高血浆内毒素浓度而促进低度炎症引起大鼠收缩压升高。亦有研究发现,不仅激活的TLR4信号通路与胰岛素抵抗密切相关[11],而且TNF-α可与胰岛素受体结合使其失活,白细胞介素均可作为炎症因子与胰岛素抵抗密切相关,IL-18与IL-1β等炎症因子是导致胰岛素耐受性的主要原因,但具体的分子机制至今不清楚[12-15],同时大量证据提示高血压与胰岛素抵抗密切相关[16]。结合本实验发现:庆大霉素组大鼠较高脂组其血浆内毒素浓度、IL-1β显著降低,但反应急性炎症的C反应蛋白各组间差异无统计学意义,胰岛素抵抗明显下降,且从第10周至实验结束其收缩压较高脂组明显下降,最终趋于对照组水平,故在排除急性炎症反应对大鼠血压等指标干预的同时,有力的证实了庆大霉素灌胃干预可降低升高的血浆内毒素浓度而降低低度炎症及胰岛素抵抗,以致让高脂喂食所致血压升高得以控制。
研究证实,庆大霉素抗菌谱广且以革兰阴性菌为主能广泛抑制肠道菌群、代谢周期快且不被肠道吸收,能减少对机体的影响[17],研究证实[3]:庆大霉素灌胃可降低血浆内毒素浓度,和肠道细菌数量,在本实验中硫酸庆大霉素组内毒素水平高于对照组、低于高脂组,而庆大霉素组炎症因子水平与对照组一致且低于高脂组。既往研究发现细菌常在死亡、自溶、繁殖或者黏附在其他细胞时,才会释放内毒素从而表现出毒性[18]。结合本实验结果,可能是由于硫酸庆大霉素导致革兰阴性菌大量死亡,以至内毒素释放入血液,表现为该组内毒素水平高于对照组。虽然内毒素水平并未降低到和对照组水平一致,但该组血压却降低到了和对照组一致的水平,这说明机体内毒素浓度可能只有超过一定限度时才能引起机体炎症因子升高从而引起血压升高,将内毒素浓度控制在一定范围,并不需要降低到正常值也能起到降压作用。
大量研究已经发现高脂喂食可使大鼠收缩压及舒张压显著升高,并提出可用高脂喂食建立大鼠非遗传性高血压模型的观点[19-21]。随着研究的深入,我们对高脂喂食和高血压、内毒素、低度炎症及胰岛素抵抗的关系有了更深的了解。但高血压与上述四者之间的关系极其复杂,如高脂喂食后机体发生了哪些具体的变化才会引起高内毒素血症,继而促发低度炎症反应引起血压升高,这些问题都有待进一步深入研究。
在本实验过程中不容忽视的是,硫酸庆大霉素组有3只大鼠死亡,尸体解剖均发现肺部有严重的化脓感染灶,虽然硫酸庆大霉素可通过抑制肠道革兰阴性菌从而减少内毒素,但长期使用亦可致二重感染。最新研究也发现抗生素不仅能损伤肠道菌群以削弱肠道的免疫功能,而且还能杀死肠道上皮细胞、对线粒体的功能造成显著改变[22]。所以通过进一步优化给药方式以期改善二重感染,或者利用其它手段减少机体内毒素含量有望成为干预高血压等代谢性疾病的新的重要靶点。另一方面,本实验没有设立对照+庆大霉素组以排除庆大霉素对正常个体的影响。血压监测方面:用大鼠无创动脉血压监测仪来测量大鼠的收缩压比较准确,但舒张压往往测量不准,与文献[6]血压结果一致。实验过程中大鼠心率是根据血压波动图相邻两波形之间的距离计算,但受到不同大鼠测得的波形大小不一,对心率的统计便会受到波形大小的影响,故大鼠心率测定不准确。体重测量方面:虽然实验[6,23]均用“高脂喂食”干预但两实验一个采用高甘油三脂干预,另一个采用高胆固醇饲料干预,而本实验饲料配方采用高甘油三脂,故能解释为何大鼠体重和文献[23]结果一致,与文献[6]研究结果差异较大,结合既往研究[23]和本实验研究结果可以得出:高脂饲料喂养法建立的动物模型适合应用于建立单纯性高胆固醇血症;高脂鼠和肥胖鼠在本质上还是有区别[23]。
4 结论
本研究结果提示,长期高脂喂食大鼠可诱发机体胆固醇升高[23]、慢性炎症[4-5]和慢性炎症所致的胰岛素抵抗[12-15]而机体慢性炎症和胰岛素抵抗可致大鼠血压升高[9-10,16]庆大霉素可通过降低机体慢性炎症[3]、胰岛素抵抗以控制高脂喂食所致的大鼠高血压。
【参考文献】
[1]ESH/ESC Task Force for the Management of Arterial Hypertension. 2013 Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the Management of Arterial Hypertension[J]. Blood Pressure, 2013, 31(10):1925-1938.
[2]Wilde D W, Massey K D, Walker G K,etal. High-fat diet elevates blood pressure and cerebrovascular muscle Ca2+ current[J]. Hypertension, 2000, 35(3):832-837.
[3]陈利江,权正学,谢春燕.庆大霉素对截瘫大鼠肠道细菌移位影响的实验研究[J].西部医学,2009,21(4):547-549.
[4]Blasco-Baque V, Serino M, Vergnes J N,etal. High-fat diet induces periodontitis in mice through lipopolysaccharides (LPS) receptor signaling: protective action of estrogens[J]. PLoS One, 2012, 7(11):48220
[5]G?bele E, Dostert K, Hofmann C,etal. DSS induced colitis increases portal LPS levels and enhances hepatic inflammation and fibrogenesis in experimental NASH[J]. Journal of Hepatology, 2011, 55(6):1391-9.
[6]阮承超,高平进.免疫与炎症参与高血压发生发展的机制探讨[J].中华高血压杂志,2017,25(4):319-321.
[7]刘时彦,黄为民,张润慧,等.盐敏感性高血压大鼠炎症因子和内皮损伤因子的表达[J].中国动脉粥样硬化杂志,2015,23(8):179-183.
[8]Bleau C, Karelis A D, St‐Pierre D H,etal. Crosstalk between intestinal microbiota, adipose tissue and skeletal muscle as an early event in systemic low‐grade inflammation and the development of obesity and diabetes[J]. Diabetes/metabolism Research & Reviews, 2015, 31(6):545-561.
[9]Zhang H, Park Y, Wu J,etal. Role of TNF-α in vascular dysfunction[J]. Clinical Science, 2009, 116(3):219-230.
[10] 薛冰,丁东新,顾平生,等.老年高血压患者血清 TNF-α,IL-6的变化及其临床意义[J].放射免疫学杂志,2004,17(4):270-271.
[11] Dasu M R, Jialal I. Free fatty acids in the presence of high glucose amplify monocyte inflammation via Toll-like receptors[J]. American Journal of Physiology Endocrinology & Metabolism, 2010, 300(1):145-154.
[12] Defronzo R A. Insulin resistance: a multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidaemia and atherosclerosis[J]. Netherlands Journal of Medicine, 1997, 50(5):191-197.
[13] 李金梁,杨兆颖,伍海安,等.长期服用比索洛尔对于原发性高血压患者糖脂代谢的影响[J].中国医药指南,2011,09(15):288-290.
[14] Ohshima K, Mogi M, Jing F,etal. Roles of interleukin 17 in angiotensin II type 1 receptor-mediated insulin resistance[J]. Hypertension, 2012, 59(2):493-499.
[15] Zhang Y, Li Q, Rao E,etal. Epidermal Fatty Acid binding protein promotes skin inflammation induced by high-fat diet[J]. Immunity, 2015, 42(5):953-964.
[16] 李凡,薛建红,英明中.高血压与胰岛素抵抗相关性机制的研究进展[J].中华老年心脑血管病杂志,2012,14(2):209-210.
[17] Skopnik H, Wallraf R, Nies B,etal. Pharmacokinetics and antibacterial activity of daily gentamicin[J]. Archives of Disease in Childhood, 1992, 67(1):57-61.
[18] 张虞婷,丁苏苏,李倚云,等.细菌内毒素的研究进展及其检查法的应用[C].中国药学大会暨中国药师周,2014,27(5):66-69.
[19] 黄辉,陈洁,王彤,等.20-HETE下调在高脂饮食所致高血压机制研究[J].中国临床实用医学,2008,2(5):1-3.
[20] 田亚强,白洁,邱娟,等.长期高脂饮食对SD大鼠收缩压的影响及机制[J].山东医药,2011,51(11):44-46.
[21] 王亚萍,宋艳,李昊,等.高脂喂食诱导的肥胖大鼠肾周脂肪与血压的关系及替米沙坦干预的影响[J].中华高血压杂志,2015(2).138-145.
[22] Morgun A, Dzutsev A, Dong X,etal. Uncovering effects of antibiotics on the host and microbiota using transkingdom gene networks.[J]. Gut, 2015, 64(11):1732-1743.
[23] 刘舰杭,欧阳军.高脂饲料对大鼠血脂、体重的影响[J].中国现代医生,2009, 47(14):23-24.

