430 nm和530 nm单色光对豚鼠眼球背侧及腹侧屈光发育的影响△
刘睿 邹蕾蕾 刘望原 钱一锋 戴锦晖
眼球在发育过程中屈光度和眼轴之间互相协调匹配,最终消除出生时的远视状态形成正视眼的动态过程称为眼球的正视化。众所周知,视觉信息在眼球的正视化过程中发挥重要作用,视觉信息的反馈机制调控眼球的生长发育[1-4]。色觉作为视觉信息的重要组成部分,在眼正视化过程中同样发挥重要作用。在单色光干预的豚鼠屈光发育模型中发现,蓝光引起正视化进程延缓,同时眼轴增长延缓;绿光引起正视化进程加速,同时伴有眼轴增长加速[5-6]。
对于单色光引起的屈光度及眼轴的改变原因主要有2方面解释:①纵向色相差导致的光学离焦。即蓝光波长较短,聚焦在视网膜之前导致近视性离焦;绿光波长较长,成像在视网膜之后导致远视性离焦。②不同类型视锥细胞信号输入的差异。这种信号输入的差异可能导致430 nm短波长光与530 nm中波长光形成的屈光度差异可达6.00 D,远远大于2种波长光之间的纵向色相差(约1.5 D)[7]。
豚鼠是一种二色视动物,在屈光发育过程中有着与人类相似的正视化进程。豚鼠视网膜上的S视锥细胞和M视锥细胞有着特征性的分布,即背侧以M视锥细胞为主,到腹侧逐渐减少;腹侧以S视锥细胞为主,到背侧逐渐减少,中间为2种视锥细胞的过渡区[8]。
我们在单色光干预的豚鼠屈光发育模型中,发现豚鼠不同视锥细胞密度也发生变化[9]。然而,不同单色光引起的豚鼠屈光变化是否受豚鼠视网膜上M和S视锥细胞特征性分布的影响,而导致背侧和腹侧屈光度发生不同程度改变,需进一步研究。在本研究中,我们观察在不同波长的单色光光照下,豚鼠眼球不同部位(背侧和腹侧)的屈光度和眼轴的改变,探讨2种视锥细胞分布与屈光发育之间的关系。
1 材料与方法
1.1 饲养笼具和照明设置 豚鼠饲养于暗室环境中,饲养房间透光处用遮光布遮光,室内环境保证适宜的温度及湿度。饲养笼具壁内面的四周、上方安置LED灯管,每面安装2~3支(图1)。将各组不同色光光照度设置为与光量子数一致。在笼具正中位置进行光量子数测量,并与笼内豚鼠眼球基本处于同一水平面。采用电子定时器统一控制各组光照时间,光照周期设置为灯光交替亮灭12 h(亮灯时间8:00~20:00)。其中短波长蓝光组所用LED波峰值为430 nm,半波宽为30 nm;绿光组LED波峰值为530 nm,半波宽为40 nm。对照白光组LED为色温5 000 K的广谱光。
1.2 验光 实验开始及开始后2周、4周、6周、8周及10周进行散瞳验光,检测均由同一位熟练的专业验光人员完成。在验光前进行睫状肌麻痹去除调节,结膜囊内每5 min滴睫状肌麻痹药(1%盐酸环戊通)1次,共5次。最后一次完成后等待1 h,在暗环境中进行带状光检影验光。验光前滴用人工泪液避免角膜干燥。每只豚鼠进行3个部位验光:正前方(眼球中央屈光度),上方30°(眼球背侧屈光度)和下方30°(眼球腹侧屈光度)。验光时以豚鼠眼球与验光技术人员眼之间的连线为基准(手臂长度),根据上、下方30°夹角计算出偏离基准线的垂直距离,并在该距离方向上进行验光。具体示意图如图2所示。保证每只豚鼠验光时检影镜在眼球前同样距离及同样角度。每只眼重复测量3次取平均值,采用等效球镜度(球镜+1/2柱镜)计入最终结果。

图1. 豚鼠饲养于不同光照笼具中,光照周期为12 h/12 h(光照时间8:00~20:00)

图2. 豚鼠腹侧及背侧屈光度测量示意图 S:上方,代表背测屈光度;I:下方,代表腹侧屈光度;T:颞侧;N:鼻侧
1.3 眼轴的测量
1.3.1 使用A超测量各组眼轴长度 测量前0.4%盐酸奥布卡因滴眼液滴眼行角膜表面麻醉。测量时一手固定动物,一手持探头。根据探头前部发出的激光光点找到角膜中心,垂直于角膜表面进行测量。调整波形,选择理想的数值记录。重复10次取平均值。眼轴长度定义为从角膜前表面顶点到视网膜前表面的距离,记录数据包括前房深度、晶状体厚度和眼轴长度。分别于光照干预前及干预后2周、4周、6周、8周及10周进行测量。由于豚鼠及背侧眼轴长度无法用A超探头准确定位,故改用冷冻切片的方式测量。
1.3.2 冷冻切片测量豚鼠背侧和腹侧眼轴长度 每组各取6只豚鼠过量乙醚肌内注射麻醉后颈椎脱臼法处死,立即小心摘出眼球, 磷酸盐缓冲液(phosphate-buffered saline, PBS)冲洗后置于冰上,显微剪剪除眼球周围结膜及其他结缔组织。根据眼球背部巩膜上的血管压迹(图3)确定眼球的钟点方向,在12:00和6:00位置用10-0缝线标记后放入盛满冷冻切片包埋剂(OCT)的自制容器中。

图3. 豚鼠眼球背面血管压迹 TR:颞侧视网膜;NR:鼻侧视网膜
将眼球调整好位置,小心放入-80 ℃冰箱中冷冻,隔天取出放入切片机进行切片。在切片机上摆好眼球位置,沿矢状面切开眼球,仔细找到缝线位置即为眼球正中。将该切面置于显微镜下拍照,得到眼球的矢状位切面照片。采用Image J作图,将晶状体赤道部中点作为眼球的节点位置,经过该节点及角膜顶点的连线为中央眼轴,同时取经过该点与中央眼轴夹角为30°的直线长度作为眼球腹侧与背侧的眼轴长度(图4)。

图4. 冷冻切片眼球切面
1.4 统计学处理 采用SPSS 13. 0 统计软件对数据进行统计分析,实验组及对照组数据结果以均数±标准差表示。2组数据的相关性检验采用Pearson相关分析,白光组与单色光组间差异分别做成组t检验,组间差异行完全随机单因素方差分析,有差异时组间两两比较采用Bonferroni法。当方差不齐时,改用Games-Howell 法,以P< 0. 05 为差异有统计学意义。
2 结果
2.1 眼轴A超与冷冻切片法 所测中央眼轴做相关性分析,结果显示2种检查结果相关 (R2=0.966,图5),2种眼轴测量方法所得结果差异无统计学意义(t=12.46,P>0.05)。
2.2 不同单色光对豚鼠视网膜不同部位屈光度及眼轴的影响 与白光组背侧、中央以及腹侧屈光度相比较,蓝光组相应部位屈光度向远视偏移,屈光度差异从第4周开始出现,到第6周时趋于稳定,第10周达到峰值。蓝光组背侧、中央、腹侧分别偏远视(1.75±0.21)D、(1.83±0.07)D和(2.68±0.13)D;到第10周时,冷冻切片显示:蓝光组眼轴较白光组短,背侧、中央以及腹侧眼轴差值分别为(0.020±0.002)mm、(0.080±0.008)mm和(0.160±0.001)mm。绿光组与白光组相比,第6周开始出现屈光度的差异;到第10周时,背侧、中央和腹侧分别为近视偏移(1.48±0.12)D、(1.23±0.02)D和(1.43±0.01)D,眼轴增长变快,差值分别为(0.090±0.005)mm、(0.050±0.005)mm和(0.020±0.003)mm。详见图6~9。
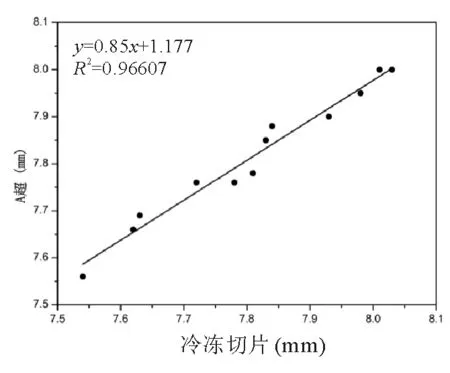
图5. A超与冷冻切片所测量中央眼轴的相关性分析

图6. 白光、蓝光及绿光组各时间点背侧屈光度变化
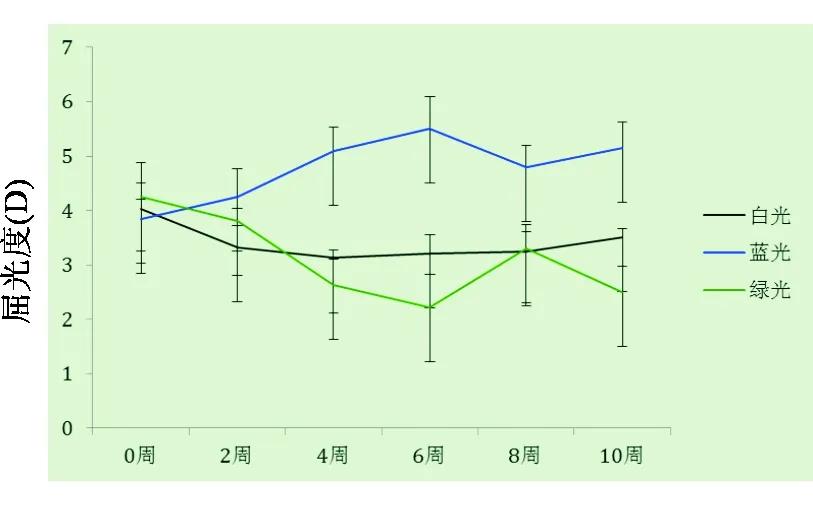
图7. 白光、蓝光及绿光组各时间点中央屈光度变化

图8. 白光、蓝光及绿光组各时间点腹侧屈光度变化

图9. 单色光照10周后豚鼠不同部位眼轴长度比较
3 讨论
本研究发现,不同波长的单色光干预后,豚鼠屈光度和眼轴有区域性改变,蓝光干预后豚鼠屈光状态在腹侧、中央及背侧均偏远视,在S视锥细胞分布比较密集的腹侧视网膜,豚鼠远视更加明显。同时冷冻切片结果提示背侧、中央、腹侧眼轴出现了相同的趋势变化,而腹侧视网膜方向眼轴增长延缓程度更加明显。绿光干预后豚鼠屈光状态在腹侧、中央及背侧均偏近视,相反,在M视锥细胞分布比较密集的背侧区域视网膜,豚鼠近视更加明显。同样,冷冻切片分析豚鼠眼轴改变趋势同屈光状态改变相同,背侧眼轴增长程度更显著。
已有文献[10-13]报道,小鸡、狐狸、蟾蜍、猪、鸽子等多种动物屈光度并不是单一不变的,即随着视网膜区域的不同会有不同的屈光度数。有学者[14]认为这种屈光差异的改变与动物视网膜检测位置有关,也有学者认为与调节功能有关,即动物看地面(对应背侧视网膜)与看天空(对应腹侧视网膜)使用的调节力不同。在豚鼠中同样出现了不同眼球部位屈光度与眼轴有差异的情况。豚鼠在37 d左右的正视化过程中,鼻侧屈光度相对颞侧偏近视约-1.70 D,背侧相对于腹侧偏近视约-5.20 D[15]。在本研究中发现,豚鼠腹侧和背侧的屈光度差异在出生后2周即存在,背侧相对腹侧近视约为-2.00 D。豚鼠在白光中经过10周的正视化过程后,视网膜腹侧和背侧的屈光度差异增加,约为3.00 D。在经过单色光干预10周后,豚鼠背腹侧视网膜屈光度发生了不同的变化。我们推测这种变化的发生与豚鼠视网膜上视锥细胞的特征性分布以及S与M视锥细胞感受不同波长光线的敏感度不同有关。光照10周时,与白光组相比,蓝光腹侧视网膜偏远视约为+2.68 D,眼轴长度延缓约0.16 mm,绿光组背侧视网膜偏近视约-1.48 D,眼轴增长约0.09 mm。
豚鼠在不同单色光干预下出现了屈光度的过补偿现象,这种现象的出现可能是由于S视锥细胞的过度调节以及M视锥细胞的调节不足引起[16]。本研究提示豚鼠屈光度与眼轴的变化与视锥细胞的特征性分布相一致,与视网膜不同部位的视锥细胞分布不同有关。M视锥细胞主要分布在背侧视网膜,对中波长绿光比较敏感;S视锥细胞主要分布在腹侧视网膜,对短波长绿光比较敏感。外界视觉环境会引起哺乳动物以及鱼类视锥细胞色素表达和密度的改变[17-18],我们既往研究也发现单色光照、形觉剥夺和光学离焦对豚鼠视锥细胞密度的影响[19-20]。豚鼠视网膜2种视锥细胞在单色光光照后,分布和数量均发生了相应的改变,M视蛋白在长波长光环境中表达增加而在短波长光环境中表达减少[9]。我们推测由于不同类型的视锥细胞对短波长和中波长单色光的敏感度不同,导致眼球背侧和腹侧屈光度和眼轴出现不同程度的变化趋势。
单色光可能改变了不同视锥细胞的信号对比强度,从而通过可能的以视锥细胞为主导的下游信号传导通路进一步影响屈光发育,最终导致巩膜和脉络膜厚度的变化,引起眼轴的改变。视锥细胞影响屈光发育的机制可能包括以下2种:一是单色光直接被不同波长敏感的视锥细胞感知,再经过光电转换将不同波长的单色光信号转化成电信号从而引起下游信号通路的改变;二是单色光刺激不同感光细胞数量和分布发生改变,不同的视锥细胞产生代谢产物的类型和数量可能有所不同,从而引起下游近视相关信号通路的改变。已有研究[21-22]证实,视锥细胞数量和分布的变化会直接导致视觉系统信号强度的相应变化。
综上所述,光照10周后,蓝光组豚鼠腹侧和背侧视网膜屈光度与白光组相比均偏远视,眼轴增长延缓,腹侧视网膜屈光度和眼轴的改变更加明显;绿光组腹侧和背侧视网膜屈光度均偏近视,眼轴增长加快,背侧改变更明显。这些提示豚鼠视锥细胞分布与屈光发育之间有着密切的关系,其具体信号通路有待进一步研究。
参考文献
[1] Norton TT. Animal Models of Myopia: Learning how vision controls the size of the eye[J]. ILAR J, 1999,40(2):59-77.
[2] Rabin J, van Sluyters RC, Malach R. Emmetropization: a vision-dependent phenomenon[J]. Invest Ophthalmol Vis Sci, 1981,20(4):561-564.
[3] Schaeffel F, Howland HC. Properties of the feedback loops controlling eye growth and refractive state in the chicken[J]. Vision Res, 1991,31(4):717-734.
[4] Wildsoet CF. Active emmetropization-evidence for its existence and ramifications for clinical practice[J]. Ophthalmic Physiol Optics,1997,17(4):279-290.
[5] Liu R, Qian YF, He JC, et al. Effects of different monochromatic lights on refractive development and eye growth in guinea pigs[J]. Exp Eye Res, 2011,92(6):447-453.
[6] Qian YF, Liu R, Dai JH, et al. Transfer from blue light or green light to white light partially reverses changes in ocular refraction and anatomy of developing guinea pigs[J].J Vis, 2013,13(11): 1-9.
[7] Ivanof A. Les aberations de chromatisme et de sphericitie de l′ceil[J]. Revue Opt Theor Instrum,1947,26:145-171.
[8] Rohlich P, van Veen T, Szel A. Two different visual pigments in one retinal cone cell[J]. Neuron, 1994,13(5):1159-1166.
[9] Hu M, Hu Z, Xue L, et al. Guinea pigs reared in a monochromatic environment exhibit changes in cone density and opsin expression. Exp Eye Res, 2011,93(6):804-9.
[10] Schaeffel F, Hagel G, EikermannJ,et al. Lower-field myopia and astigmatism in amphibians and chickens[J]. J Opt Soc Am A Opt Image Sci Vis, 1994,11(2):487-495.
[11] Catania AC. On the visual acuity of the pigeon[J]. J Exp Anal Behav,1964, 361-366.
[12] Henze MJ, Schaeffel F, Ott M. Variations in the off-axis refractive state in the eye of the Vietnamese leaf turtle (Geoemyda spengleri) [J]. J Comp Physiol A Neuroethol Sens Neural Behav Physiol, 2004,190(2):131-137.
[13] Nye PW. On the functional differences between frontal and lateral visual fields of the pigeon[J]. Vision Res, 1973,13(3):559-574.
[14] Hodos W, Erichsen JT. Lower-field myopia in birds: An adaptation that keeps the ground in focus[J]. Vision Res,1990,30(5):653-657.
[15] Zeng G, Bowrey HE, Fang J, et al. The development of eye shape and the origin of lower field myopia in the guinea pig eye[J]. Vision Res, 2013,76:77-88.
[16] 钱一峰. 单色光对豚鼠屈光发育及光学离焦性近视的作用及机制研究[D]. 上海:复旦大学,2013.
[17] Schweikert LE, Grace MS. Spectral sensitivity change may precede habitat shift in the developing retina of the Atlantic Tarpon (Megalopsatlanticus) [J]. Physiol Biochem Zool, 2017, 90(5): 553-563.
[18] Cheng CL, Novales FI. Opsin expression: new mechanism for modulating colour vision[J]. Nature, 2004, 428(6980): 279.
[19] 胡敏, 刘永松, 刘睿, 等. 长时间单色光照射对豚鼠视网膜视锥细胞及其视蛋白表达的影响[J]. 中华实验眼科杂志, 2011,29(3): 196-201.
[20] 胡敏, 刘睿, 刘永松, 等. 豚鼠形觉剥夺和光学离焦性近视眼模型视蛋白表达变化研究[J]. 中华眼科杂志, 2012,48(2): 148-152.
[21] He JC, Shevell SK. Variation in color matching and discrimination among deuteranomalous trichromats: the oretical implications of small differences in photopigments[J]. Vision Res, 1995,35(18):2579-2588.
[22] Sanocki E, Teller DY, Deeb SS. Rayleigh match ranges of red/green color-deficient observers: psychophysical and molecular studies[J]. Vision Res, 1997,37(14):1897-1907.

