视神经萎缩的诊疗思路与处理
田国红
视神经萎缩是来诊眼科患者常见的体征:利用眼底镜观察可见视盘颜色苍白,即通常所指的视神经萎缩。视神经萎缩并不是一个具体的临床诊断,可分为原发性与继发性:继发于视盘水肿后的各种急性视神经疾病或病程中无视盘水肿的筛板后部病变导致的视盘苍白、萎缩。明确造成视神经萎缩的具体病因是针对每位患者个体化诊疗的关键。下面我们从视神经萎缩的病理基础、采集病史的要点,以及各种导致视神经萎缩的病因进行分析。
1 临床表现
1.1 视神经萎缩的病理 视神经由来源于整个视网膜神经节细胞的约120万根神经轴突构成,双侧视神经纤维在眼眶内向后走行,蝶鞍处构成视交叉后组成视束;至外侧膝状体换元,节后纤维称为视放射投射至枕叶视皮质中枢[1]。视神经为第2对脑神经,眼内段无髓鞘及雪旺细胞覆盖。从筛板后开始,少突胶质细胞及星形胶质细胞形成髓鞘,包裹后段视神经,分为眶内段、管内段、颅内段。借助检眼镜我们仅能观察到视神经穿经筛板前的一小部分,称为视盘或视乳头(图1)。如果检眼镜下观察到视盘颜色较正常视盘浅淡、苍白,称为“视神经萎缩”。炎性脱髓鞘疾病如视神经炎、视神经脊髓炎等可导致视神经髓鞘及轴索的损害,故疾病晚期可表现视神经萎缩。外侧膝状体之后的视觉通路损害原则上不会出现跨神经节的视盘苍白萎缩,但先天性视皮质病变可表现视盘萎缩;长期脑梗死后也有跨节视神经萎缩的报道[2]。由于视神经为中枢神经,损坏后不可再生,因此“苍白萎缩”的视神经即使去除了损害因素也不可能恢复其正常颜色与功能。视神经萎缩的临床诊疗意义在于发现导致萎缩的病因,积极防控疾病进展。

图1. 视神经解剖示意图 A.检眼镜下观察视盘(视神经头部)、视网膜血管及黄斑结构;B.眼眶MRI轴位T2加权示各段视神经:眼内段、眶内段、管内段及颅内段;C.视网膜OCT扫描可见视网膜神经节细胞的轴突汇集为神经纤维层,进入视盘
1.2 病史 患者就诊时的主诉、疾病发展过程,以及全身疾病背景、用药史是明确视神经萎缩病因的重要依据!儿童患者常因入学体检被查出单/双眼视力差、视盘苍白来诊。部分家长发现患儿眼球偏斜或写字歪头来诊。采集病史时应注意询问是否存在早产、产后缺氧、窒息、发育迟缓、幼时眼部周围外伤(遗留瘢痕)、家族中眼遗传病史等。成人患者无意中或体检时发现视神经萎缩同样注意询问有无外伤史。既往如有视力下降、视神经炎、视乳头水肿的病史,则可考虑为上述疾病的后遗症。结核病患者服用乙胺丁醇等药物是导致视力下降、视神经萎缩的重要病因。有肿瘤背景的患者注意询问肿瘤性质、化疗药物种类、放疗剂量与时间,结合颅脑磁共振成像(magnetic resonance imaging,MRI)明确有无视神经转移病变。针对单眼静止性视神经萎缩,即虽然视盘苍白、萎缩,但视力长期维持不变的患者,需要考虑陈旧外伤、炎症、缺血、视神经发育异常等疾病。双眼静止性视神经萎缩除外上述病因,遗传代谢、营养中毒、系统性疾病等需要考虑。进展性视神经萎缩,不论单眼或双眼,均需要积极查找病因:球后、眼眶及鞍区的各种压迫性疾病包括青光眼、甲状腺相关眼病、颅高压等。双眼进行性视力下降、视野缺损伴视盘苍白患者,尤其是需要影像学检查排除鞍区垂体瘤、脑膜瘤等占位病变及颅高压的可能。
1.3 眼底 检眼镜下观察到的视盘形态是最客观与直接的体征。原发性视神经萎缩的视盘边界清晰、锐利,颜色苍白,容易与继发于急性期视盘水肿后的视盘苍白鉴别(图2)。回溯患者病史资料中发病急性期时的眼底像则能给诊断提供极大帮助。特别需注意疾病不同病程中,眼底表现呈现动态的变化:急性期多表现为视盘水肿而晚期则表现为视盘苍白(图3)。青光眼患者纵向扩大、凹陷的视杯及鼻侧保留的盘沿,结合视野及光学相干层析成像(optical coherence tomography,OCT)检查可以帮助确诊(图4)。视束病变患者眼底可表现特殊的“领结”样萎缩(bowtie atrophy),由于鼻侧视网膜神经纤维的交叉所致(图5)。视神经鞘膜瘤患者晚期眼底视神经萎缩可伴睫状引流血管(图6)。Leber遗传性视神经病变患者眼底除表现颞侧楔形苍白、萎缩外,常伴有眼底毛细血管扩张(图7)。前部缺血性视神经病变中晚期可见与视野相对应的“节段性视盘萎缩”(图8)。颅高压晚期患者首诊眼底视盘为继发性视神经萎缩,急性期视乳头水肿消退后呈现视盘边界不清、苍白及周边视网膜水肿痕迹。部分患者可见睫状引流血管(图9)。
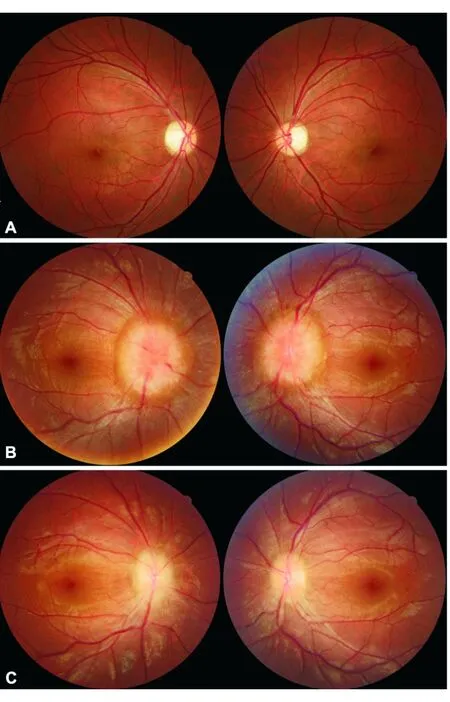
图2. 原发性视神经萎缩与继发性视神经萎缩眼底像 A.常染色体显性遗传性视神经病变患者眼底:双侧视盘边界清晰、颞侧楔形苍白,为原发性视神经萎缩;B.颅高压患者慢性期眼底像:双侧视乳头水肿、隆起;C.图B患者经过治疗后双侧视乳头水肿明显消退,但视盘边界不清、颜色苍白,为继发性视神经萎缩
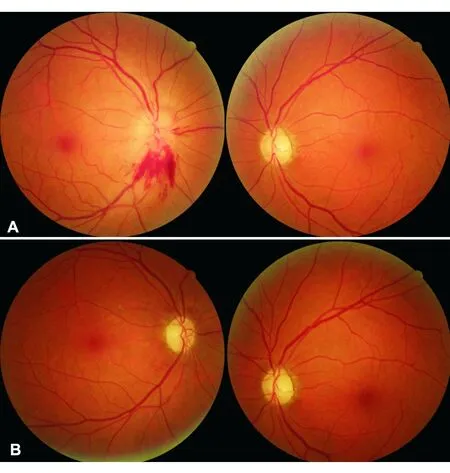
图3. 非动脉炎性前部缺血性视神经病变患者双眼先后发病不同时期眼底像 A.右眼急性无痛性视物遮挡,眼底右侧视盘节段性水肿:视盘上方缺血、颜色苍白;视盘下方水肿、出血;左眼陈旧性病变,视盘边界清,颜色苍白、萎缩。B.3个月后右眼视盘水肿消退,表现为双侧视盘苍白、萎缩
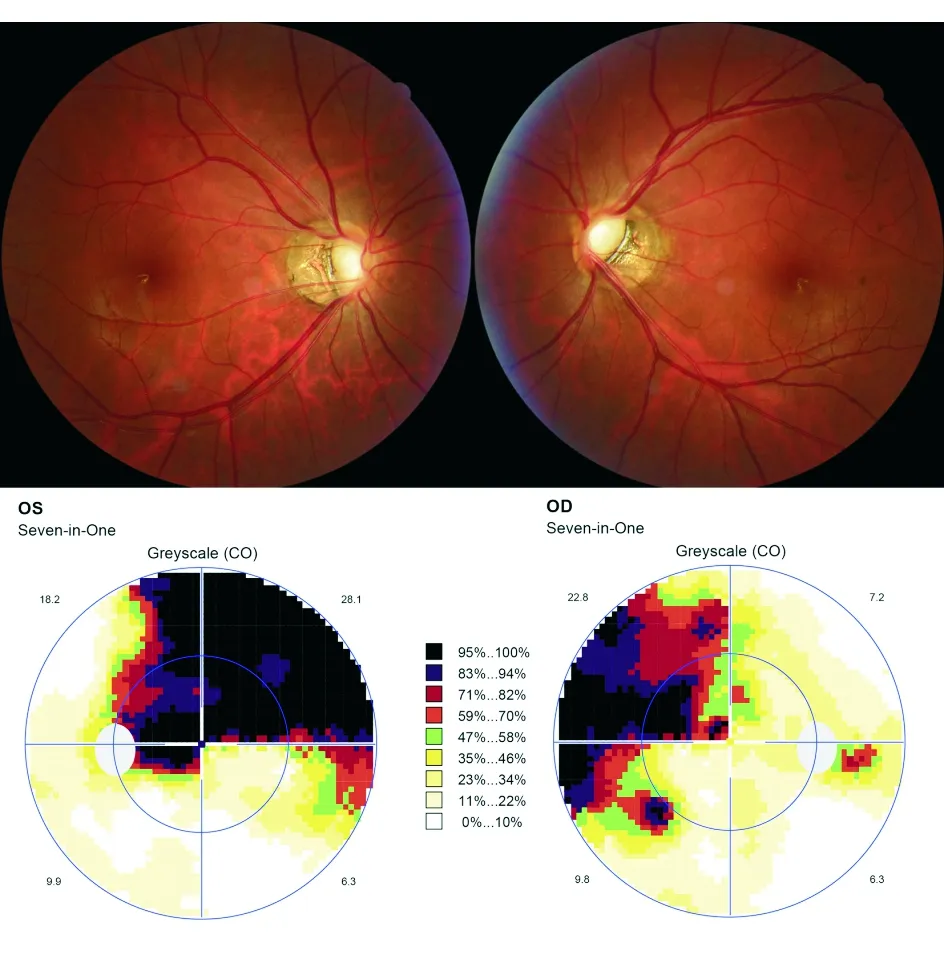
图4. 正常眼压青光眼患者眼底示双侧视盘竖椭圆形,略小,C/D双眼约0.8,颞下方神经纤维层变薄;Octopus视野示双眼鼻上方视野缺损

图5. 右侧视束病变患者眼底镜下观察:右眼颞侧视盘色淡、左眼鼻侧及颞侧视盘色淡(*),为“领结”样萎缩;患者Humphrey视野示左侧同向性偏盲,不跨越垂直中线;颅脑MRI显示右侧视束(细白箭头)出血性病变(粗白箭头),海绵状血管瘤可能性大

图6. 视神经鞘脑膜瘤患者眼底示右眼视盘边界欠清、颜色苍白,视盘表面有数条睫状引流血管(白箭头);A.眼眶MRI增强后,T1WI轴位右侧视神经鞘膜增粗、强化,呈“轨道征”(白箭头间);B.冠状位示右侧视神经仅鞘膜增粗、强化(白箭头),视神经信号正常
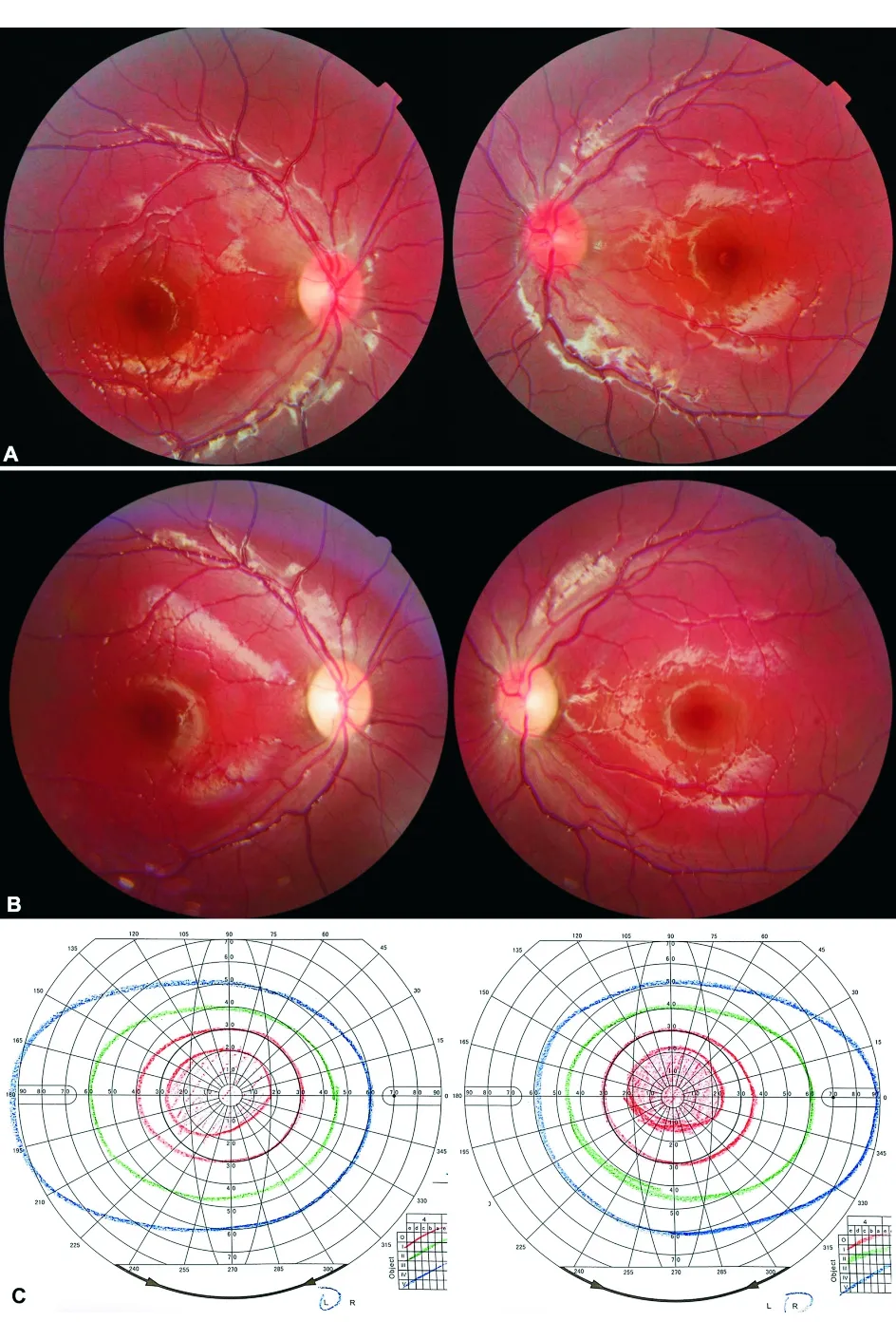
图7. Leberr遗传性视神经病变患者 A. 发病急性期眼底示双侧视盘充血、色红,右眼颞侧色淡;B. 6个月后双眼视盘充血消退,视盘边界欠清、颞侧明显苍白、乳斑束变薄;C. Goldmann视野示双眼中心暗点
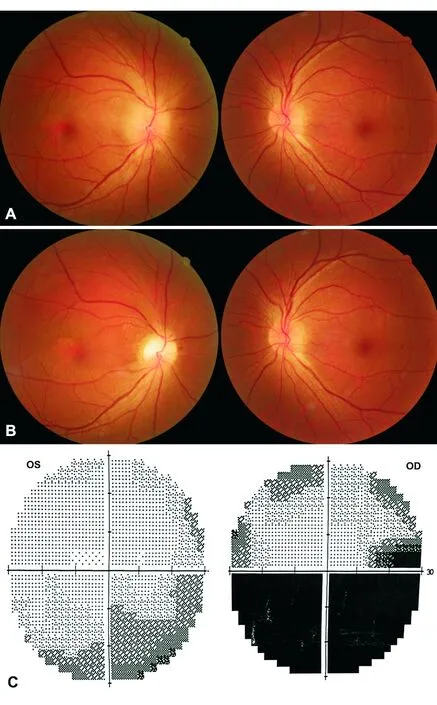
图8. 非动脉炎性前部缺血性视神经病变患者 A.右眼急性期视盘节段性水肿:视盘上方色淡,下方充血;B.慢性期右眼视盘呈节段性萎缩:视盘上方颜色苍白;C. Humphrey视野示右眼下方水平视野缺损

图9. 听神经瘤导致的颅高压晚期患者 A. 眼底示双侧视盘边界欠清、颜色苍白、视盘表面可见睫状引流血管;B. 颅脑MRI示左侧桥小脑角听神经瘤压迫脑干致中线移位,侧脑室扩大、空蝶鞍(黑箭头)
1.4 视野 视野对视神经萎缩疾病的定性及诊断具有非常重要的意义。遗传及代谢中毒性疾病导致的视神经萎缩表现为双眼对称性中心暗点;缺血性视神经病变为水平或弓形视野缺损;鞍区占位为极具特异性的双颞侧偏盲(遵从垂直中线)[3];颅高压早期视野正常或生理盲点扩大,中晚期则表现向心性缩小,直至残留极小的中心视野。注意回溯患者既往检查资料,动态观察视野的变化。
1.5 OCT 该技术已经广泛用于视神经疾病的诊疗。由于OCT检查可以更加精细、准确地测量视盘周围神经纤维层的厚度(retinal nerve fibre layer, RNFL)以及黄斑神经节细胞层(GCA)的厚度,对于检眼镜下可疑的视神经萎缩具有重要的诊断意义。OCT对视盘周围RNFL分象限的测量有助于帮助鉴别青光眼、遗传性视神经疾病,以及先天发育异常。由于视神经疾病导致视神经萎缩需要一定的时间,因此OCT可以用来随访疾病的进展。OCT尚可以帮助鉴别视网膜疾病导致的继发性视神经萎缩,如视网膜分支动脉阻塞及黄斑病变(图10)。
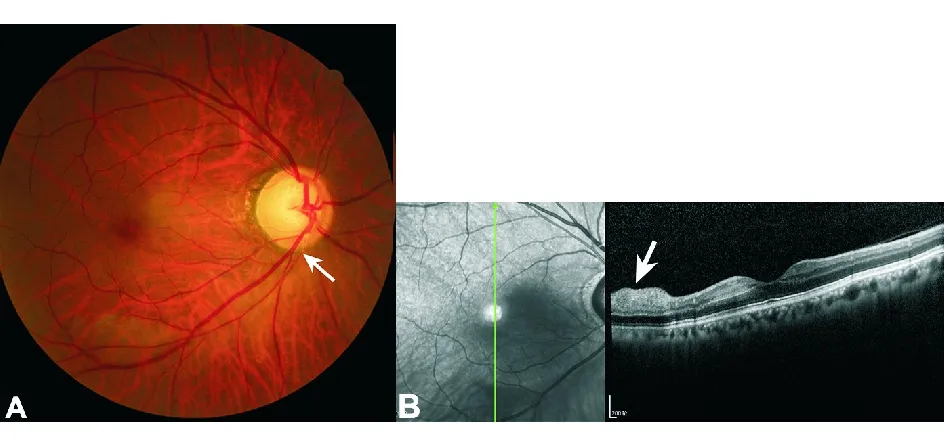
图10. 视网膜分支动脉阻塞患者 A.眼底示右眼视盘边界清,杯盘比约0.7,颞侧视盘颜色苍白;B.经黄斑OCT纵向扫描发现右眼下方视网膜神经纤维层肿胀,为缺血导致
1.6 电生理 视觉诱发电位(visual evoked potential, VEP)可用来评估视神经损害的程度。视神经萎缩患者P100波的波幅大多降低、潜伏期延迟。因此对于明确视神经萎缩患者定性帮助不大。其他视觉电生理检查包括视网膜电图(electroretinogram, ERG)及多焦视网膜电图(multifocal ERG, mfERG)可用来帮助鉴别视网膜疾病导致的视神经萎缩。
1.7 影像学 颅脑及眼眶CT/MRI是明确压迫性视神经病变不可缺少的辅助检查,尤其是高分辨率的眼眶MRI结合特殊序列可以清晰显示视神经球后段病变,甚至是细微结构的异常[4]。视神经炎性疾病在病程1个月内均可有病变部位的强化;视神经鞘膜瘤可见典型的“轨道征”(图6);眶尖及邻近鼻旁窦病变;鞍区各种占位;视束病变等。MR血管成像可以明确动脉瘤及静脉窦血栓导致的视神经压迫(图11)。特发性颅高压患者虽然MRI无占位发现,但空蝶鞍、视神经鞘膜下间隙增宽等均为颅高压的影像学间接征象(图9)。
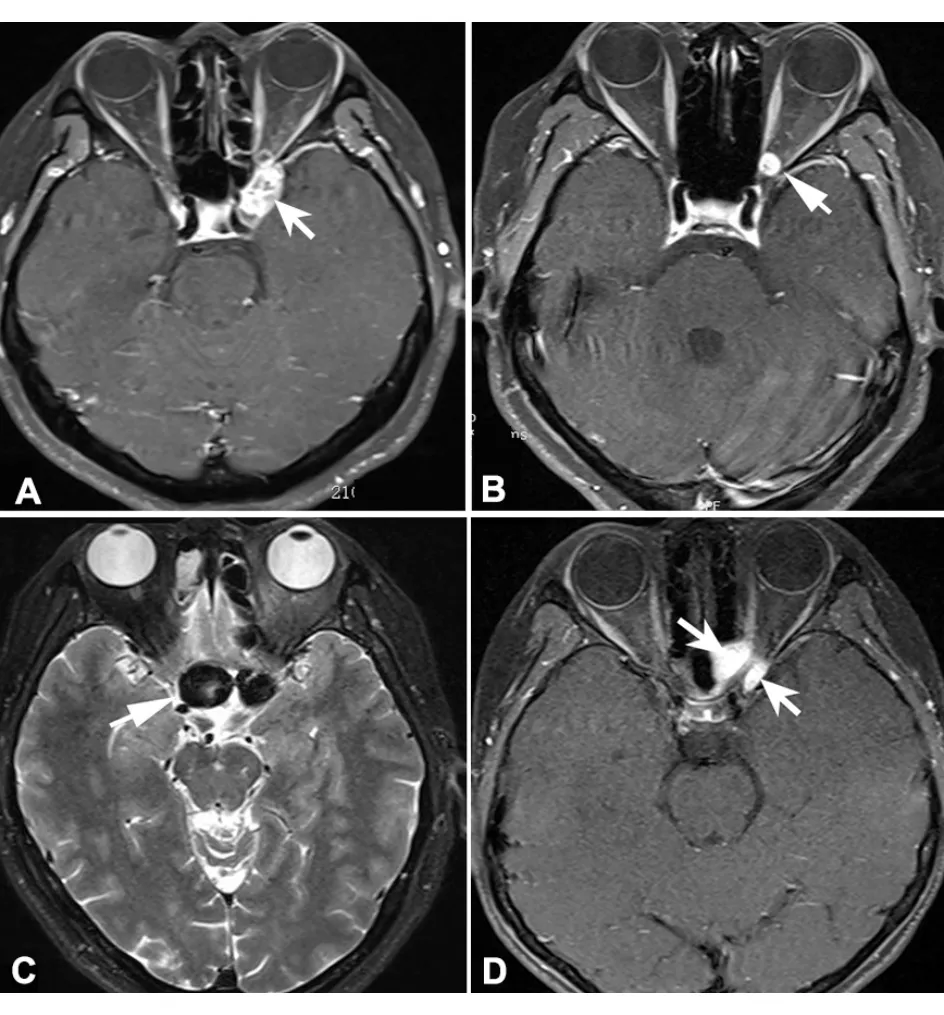
图11. 压迫性视神经病变 A.眶尖部位肿瘤占位,导致左眼视神经萎缩;B.左侧视神经管内微小海绵状血管瘤,压迫视神经;C.右侧颈内动脉海绵窦段动脉瘤膨隆压迫右侧视神经;D.左侧眶尖肌纤维瘤压迫左侧视神经(白箭头示病变)
2 各种病因
2.1 视神经炎/视神经脊髓炎(ON/NMO) 由于这2种疾病均破坏视神经髓鞘及轴索,后期为导致视神经萎缩的常见原因。部分急性期患者视盘可出现水肿(占1/3),也可检眼镜下观察视盘形态正常(球后视神经炎)。病程1个月后视盘OCT逐渐表现出RNFL变薄,通常在3个月左右稳定(图12)[5]。此时眼底像下观察患眼视盘颜色淡或苍白。NMO患者RNFL的萎缩程度较多发性硬化相关ON更加明显。由于ON有自愈的倾向,很多患者可无症状而痊愈,但遗留视神经萎缩。尤其是儿童期罹患ON患者,多年后查体时发现双侧视神经萎缩,给确诊带来极大困难。
2.2 缺血性视神经病变(AION) 中老年患者、单眼或双眼先后发病,既往有高血压、糖尿病等血管病风险因素。来诊的双眼视神经萎缩的患者,回溯既往病史资料可发现首次发病时视乳头水肿、健眼高危视盘;病程超过1个月后视盘水肿消退,残留视神经萎缩。患者急性期眼底“节段性水肿”与慢性期“节段性萎缩”是诊断的关键。AION患者治疗后视力无明显变化,视野具有特征性的水平或弓形缺损,与ON患者易鉴别。

图12. 视神经炎患者 A.发病后6个月眼底示右眼视盘边界清,C/D约0.7,视盘颞侧苍白;B.视盘OCT示右眼颞侧及上方RNFL变薄;C.黄斑GCA示右眼明显变薄
2.3 外伤性视神经病变 婴幼儿外伤后不易有视力下降的主诉,因此可在多年后入学体检时发现“视神经萎缩”。仔细检查患儿颜面部,尤其是眉弓附近皮肤有无瘢痕是外伤的间接证据。这类患儿需要行影像学检查排除占位性病变。有明确外伤病史的患者,发病急性期检眼镜下视盘形态、色泽可完全正常,但1个月后OCT可表现出RNFL变薄,视盘颜色逐渐苍白。
2.4 Leber遗传性视神经病变(LHON) 典型慢性期患者双眼对称性视盘苍白、萎缩,OCT见颞侧RNFL明显变薄。急性期来诊患者视盘假性水肿、鼻侧充血、颞侧苍白。LHON患者家族中母系遗传病史及视野检查发现中心视野缺损具有特异性。
2.5 压迫性视神经病变 该类导致视神经萎缩的病因是临床诊疗中最重要的方面。尽早去除占位压迫不仅是肿瘤治疗的重要部分,也是改善视功能的关键。眼科就诊患者中视觉通路常见压迫性病变为球后眼眶内和鞍区病变压迫视交叉。靠近筛板的压迫性病变早期常出现视盘水肿,后期表现继发性视盘苍白、萎缩。视神经鞘脑膜瘤除对视神经本身的压迫外,尚阻碍视网膜中央静脉的回流,造成视盘水肿;晚期出现视神经萎缩。距离筛板较远的视神经病变,早期视盘形态、颜色正常,但随着压迫的进展,神经轴索出现逆行性损害,逐渐反映到视盘苍白。眶尖部位极小的病变,由于空间有限,可造成严重的视力下降,但眼底视盘萎缩并不明显,易误诊为“不明原因”视力下降。针对性的影像学检查可以帮助确诊。鞍区病变依据占位的性质、大小可以表现为单眼/双眼视盘苍白、萎缩。病史中进行性加重的特征需要高度重视。视野检查的核心发现为双颞侧偏盲[6]。额叶底部或较大鞍区占位导致一侧视神经萎缩即另侧视乳头水肿,称为Foster-Kennedy综合征。视束及视束后病变视野特征为同向性偏盲。
2.6 中毒代谢性视神经病变 乙胺丁醇为国内最常见导致视力下降、视神经萎缩的药物。由于患者服药与发病具有数月的间隔,详细询问药物服用史是确诊的关键。慢性烟草及酒精也是造成双侧对称性视神经萎缩的重要原因。
2.7 梅毒感染 双眼/单眼不明原因视力下降、视神经萎缩的患者,临床诊断中注意排查血清梅毒抗体。该“万能模仿者”可以造成以血管炎为主的视神经、视网膜病变,最终导致视神经萎缩[7]。
3 鉴别诊断
3.1 先天性视盘发育异常 包括视神经发育不良、节段性视神经发育不良、视盘缺损、生理性大视杯、小凹等(图13)。先天性视盘异常患者通常在体检时被告知“视神经萎缩”及“杯盘比增大”,要求进一步检查。这类患者多为稳定性病程,除发生并发症需要处理外,定期随访即可[8]。

图13. 先天性视盘发育异常 A.视神经发育不良,视盘小、周围无神经纤维层、周围巩膜环、血管走行僵直;B.节段性视神经发育不良:血管从视盘鼻上方发出(白箭头),鼻上方神经纤维变薄;C.病理性近视患者后葡萄肿,视盘周围脉络膜色素脱失,使得视盘颜色变淡;D.视盘颞侧卵圆形小凹(黑箭头);E.视盘颞侧脉络膜缺损;F.有髓神经纤维:视盘鼻上方为主,白色羽状物
3.2 视盘缺损 视盘缺损可伴有周边脉络膜缺损,为视杯发育异常的一种类型。缺损的视盘呈现大的凹陷,视盘颜色苍白,相应的神经纤维缺失。
3.3 生理性大视杯 患者视功能正常,盘缘神经纤维层分布正常,血管从视盘中心发出,形态正常。
3.4 心因性视力下降 也称为非器质性视力下降,为心理精神疾病转换障碍的一种类型。患者眼底检查及电生理均无明显异常,仅主观视力检查无法矫正至正常。视野检查表现为周边视野缺损、向心性缩小而非中心视野缺损。随访OCT检查可以发现视盘RNFL及黄斑GCA均为正常。
4 处理
首先尽量明确造成视神经萎缩的病因,对于压迫性因素导致的病因应积极转诊或联合相关科室。如鞍区垂体瘤、脑积水、颅高压应尽早手术;对青光眼患者要积极控制眼压。中毒代谢尽早去除毒性物质对视神经的急性损害。缺血性及遗传性视神经病变虽然无特殊治疗,但应向患者解释预后,控制风险因素、优生优育。对视神经炎患者告知反复发作的风险及定期随访。
神经营养药物如甲钴胺、胞磷胆碱、辅酶Q10、艾地苯醌等由于副作用小已经广泛用于视神经萎缩患者的预防保护。注射用维生素B12也用于营养不良性视神经病变。维生素B1针对恶性贫血及Wernicke脑病可以使用[9]。
参考文献
[1] Kline LB,Foroozan R. Optic nerve disorders[M]. 2nd ed. The American academy of ophthalmology. London: Oxford University Press, 2007: 1-2.
[2] Hoyt WF, Rios-Montenegro EN, Behrens MM, et al. Homonymous hemioptic hypoplasia. Fundoscopic features in standard and red-free illumination in three patients with congenital hemiplegia[J]. Br J Ophthalmol, 1972 ,56(7):537-545.
[3] 田国红,朱文卿,孙兴怀.视交叉及视交叉后视觉通路损害的临床特征[J].中国眼耳鼻喉科杂志,2016,16(3):223-228.
[4] 田国红,万海林,沙炎.影像学技术在神经眼科疾病诊断中的应用[J].中国眼耳鼻喉科杂志,2017,17(5):309-317.
[5] Tian G, Li Z, Zhao G, et al. Evaluation of retinal nerve fiber layer and ganglion cell complex in patients with optic neuritis or neuromyelitis optica spectrum disorders using optical coherence tomography in a Chinese cohort[J]. J Ophthalmol, 2015,2015:832784.
[6] 田国红, 孙兴怀. 压迫性视神经病的诊断要点[J].中国眼耳鼻喉科杂志, 2015, 15(1):65-70.
[7] 田国红.梅毒感染的神经眼科表现[J].中国眼耳鼻喉科杂志,2017,17(4): 301-304.
[8] Golnik KC. Congenital optic nerve anomalies[J]. Curr Opin Ophthalmol, 1998,9(6):18-26.
[9] Grzybowski A, Zülsdorff M, Wilhelm H, et al. Toxic optic neuropathies: an updated review[J]. Acta Ophthalmol, 2015,93(5):402-410.

