2型糖尿病合并急性胰腺炎大鼠肠道微生物ERIC-PCR指纹图谱的分析
王永磊 ,苏 峰 ,张 静 ,杨彦文 ,张荣芳 ,倪 军
糖尿病是一种以慢性血糖升高为重要特征的代谢、免疫性疾病,其病因及发病机制复杂,并发症多。近年来随着人们生活水平的不断改善,DM的发病率也逐年升高,目前已成为与心脑血管病、肿瘤性疾病并称的人类健康威胁最严重的三类疾病。美国、英国、中国台湾等地的调查研究结果显示,2型糖尿病患者与非糖尿病患者相比,急性胰腺炎发生率高出1.95~2.83倍[1-3]。糖尿病合并急性胰腺炎病情复杂、治疗难度大,严重影响患者的身心健康,因此对糖尿病合并急性胰腺炎的研究具有重要的现实意义。Goto等[4]通过选择处于糖耐量上限的Wistar大鼠近亲繁育发现F13代时出现糖耐最受损,F30代时即存在稳定的糖尿病,即Goto-kakisaki自发性2型糖尿病大鼠(GK大鼠),这是一种自发性2型糖尿病模型。近年来,随着分子生物学技术的高速发展,不依赖传统微生物培养的基因指纹技术应运而生。肠杆菌基因间重复共有序列(enterobacteria repetitive intergenic consen sussequences,ERIC)是存在于多种细菌基因组中的串联重复序列,研究发现该片段仅存在于肠道细菌基因组间[5],在细菌噬菌体和质粒上尚未发现其存在。不同的细菌基因组上ERIC重复序列的数目及分布不同,利用ERIC核心序列设计反向引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,可得到一系列由大小不同片段组成的脱氧核糖核酸(deoxyribonucleic acid,DNA)指纹图谱,即DNA迁移带[6]。某种程度上,DNA迁移带的灰度值和条带数目代表着此重复序列间的距离和重复次数。因此,肠道菌群基因组DNA的差异可清晰显示在指纹图谱上,并可根据电泳条带来区分菌株(型)。每个条带可代表一种细菌类群,条带的亮度可间接反映菌类数量,从而通过获得的条带数目和亮度信息分析混合菌群的多样性[7,8]。本研究采用ERIC-PCR方法对Wistar大鼠及其急性胰腺炎造模组和GK大鼠及其急性胰腺炎造模组大鼠肠道微生物进行基因组DNA扩增,快速检测并获得菌群分布状况,并与传统细菌培养方法相结合,旨在得出更为准确的菌群定性结果,为糖尿病合并急性胰腺损伤相关基础及临床研究提供依据。
1 材料与方法
1.1主要实验仪器PCR扩增仪CFX96 (美国Bio-Rad公司)、电泳仪DYCP-31DN(北京六一仪器公司)、紫外可见分光光度计Bio Spec-nano(日本岛津公司)、酶标定量测定仪(德国Thermo公司)、制冰机XB70(美国GRANT公司)、Olympus BH2显微镜(上海兆仪光电科技有限公司)、EC3凝胶成像系统(美国UVP公司)。
1.2主要实验试剂 牛磺胆酸钠、戊巴比妥钠购于Sigma公司;粪便DNA提取试剂盒购置于北京天根生物科技有限公司;大鼠胰淀粉酶试剂盒购自于上海酶联生物科技有限公司。扩增引物由上海生工生物工程有限公司合成;柱式腐殖酸清除剂、PCR抑制物清除剂均购自于上海生工生物工程有限公司;PCR试剂盒、DNA Ladder(100~2 000 bp)、琼脂糖等均购于碧云天生物科技有限公司。所有试剂均在有效期内使用。
1.3实验动物及处理
1.3.1动物分组与造模 40只雄性10周龄大鼠(Wistar大鼠、GK大鼠各20只),无特定病原体级,购自于上海斯莱克实验动物中心[许可证号:SCXK(沪)2012-0002];饲养于新乡医学院生理实验室清洁动物房[温度(25±2)℃;湿度(50±10)%;12 h白昼/12 h黑夜轮换],普通大鼠饲料适应性喂养2周。20只Wistar大鼠中随机分为两组,每组10只,空白对照组(QB组),标记为A1~A10;单纯急性胰腺炎大鼠模型(AP组),标记为B1~B10。20只GK大鼠随机分为两组,每组10只,2型糖尿病组(DM组),分别标记为C1~C10;2型糖尿病合并急性胰腺炎动物模型(DAP组),分别标记为D1~D10。
术前禁食、水12 h;测体重,按比例0.15 ml/100 g给予3%戊巴比妥钠溶液腹膜下注射麻醉,固定于手术台上,备皮、消毒、铺巾。无菌操作下做腹正中切口,约2.5 cm,逐层打开腹腔,提起胃,可见十二指肠通向肝脏方向的透明腺管,即胆胰管,近肝脏处用微型血管夹夹闭,近十二指肠处5号丝线结扎,其中AP组、DAP组逆行胆管注射法按体重比例0.1 ml/100 g缓慢匀速注射3.5%牛磺胆酸钠溶液[9];QB组、DM组同样的方法按体重比例0.1 ml/100 g缓慢匀速注射0.9%氯化钠注射液。注射完毕8 min后,取下微型血管夹,解除丝线结扎,将胃、十二指肠复位后,5号丝线结扎逐层缝合关闭腹腔。
1.3.2糖尿病合并急性胰腺炎造模成功纳入与剔除标准纳入标准:(1)采用酶联免疫分析试剂盒检测大鼠血清胰淀粉酶活性较术前升高3倍以上;(2)光镜下采用改良Schmidt法对胰腺炎组织损伤进行定量评估达标[10]。剔除标准:(1)手术过程中死亡,或术后迅速死亡;(2)胰淀粉酶测试低于3倍;(3)病理切片评分未达标。
1.3.3实验动物取材(1)术后24 h乙醚麻醉下,眼眦静脉采血,1 000×g离心20 min,取上清液,冻存于-20 ℃冰箱。检测造模组24 h血清胰淀粉酶活性水平和24 h随机血糖,酶联免疫吸附法检测血清胰淀粉酶活性水平。(2)术后48 h处死大鼠,无菌操作下打开胸腔,暴露胰腺组织及胃肠,用生理盐水冲洗后立即用4%中性多聚甲醛固定,4 ℃冰箱过夜,次日置换缓冲液。取横切面的大鼠胰腺及部分结肠标本,经常规脱水、透明、浸蜡、石蜡包埋处理后制作病理切片。每张切片厚5 μm,每间隔8张取1张做苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光学显微镜下由来自新乡医学院第一附属医院及解放军371中心医院的两位病理学专家对胰腺及小肠组织分别进行双盲评分,胰腺组织损伤以改良Schmidt评价标准进行评分,用于验证造模是否成功;无菌镊取各组大鼠盲肠内新鲜粪便,用于基因组提取与细菌培养。
1.3.4粪便DNA基因组提取与处理 依据粪便基因组DNA提取试剂盒说明书(离心柱法)提取0.2 g粪便DNA基因组,并进行基因组扩增,将PCR产物点样于琼脂糖凝胶,制作目的ERIC-PCR指纹图谱。
1.3.5肠道微生物培养1.0 g新鲜粪便放入无菌培养管中,加入10 ml灭菌水,充分振荡混匀,用于细菌培养。无菌操作台上,取振荡好的粪便标本液1 ml加入装有9 ml灭菌水试管中,按1×10-1~1×10-7的梯度做倍比稀释,取稀释后的溶液500 μl分别均匀涂布于BBL琼脂培养基、MRS肉汤培养基,37 ℃厌氧培养48 h;SS琼脂培养基,MAC培养基37 ℃需氧培养24 h。形态学和生理生化特性鉴定:根据《柏杰氏细菌鉴定手册》对所得菌群进行形态和生理生化测定,并按可数性原则对培养平板进行菌落计数,记录每组选择性培养基平皿中的菌落数(cfu),计算每克新鲜粪便中的细菌数,并取对数转换(l g10 n/g)。
1.3.6制作ERIC-PCR指纹图谱 通过参考相关文献[11]及反复试验最终确定PCR初始反应体系,见表1;引物序列ERIC-1 5'-ATGTAAGCTCCTGGGGATTCAC-3';ERIC-2 5'-AAGTAAG TGACTGGGGTG AGCG-3'反应条件:(1)95 ℃预变性8 min;(2)95 ℃变性30 s,52 ℃退火1 min,65 ℃延伸8 min,32个循环;(3)65 ℃终延伸16 min。PCR结束后,8 h内取PCR产物5 μl点样于1.5%琼脂糖凝胶电泳,电泳电压5 V/cm,30 min;紫外凝胶成像仪检测并拍照。将采集的数据代入Shannon-Wiener(H)公式[12]H=-∑(ni / N)ln(ni / N)(其中ni是第i条Eric条带数目,N代表所产生的所有Eric条带的峰下面积[13])。
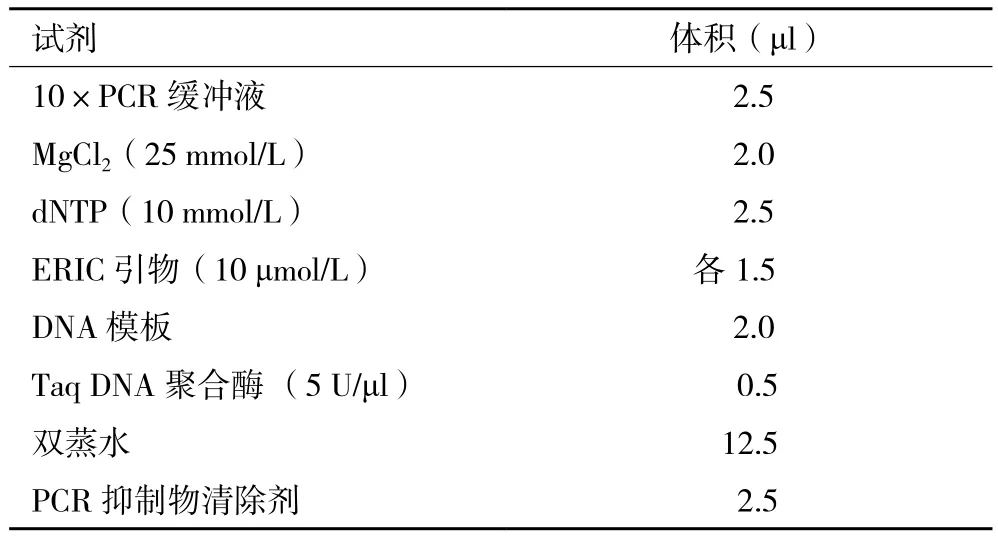
表1 PCR初始反应体系
1.4统计学处理 应用SPSS 20.0统计软件进行分析,计量资料以x±s表示,两组间比较采用独立样本t检验。多组间比较,当方差齐时,采用单因素方差分析,进一步两两比较采用LSD-t检验;当方差不齐时,组间比较采用Kruskal-Wallis H检验,进一步两两比较采用Nemenyi检验。以双侧P<0.05为差异具有统计学意义。
2 结 果
2.1大鼠一般情况 (1)实验期间,DAP组出现4只死亡,AP组2只死亡,死亡大鼠经解剖发现其中5只存在大量胸腔积液、胰腺组织严重坏死,1只死因不明;QB组、DM组大鼠均无死亡;(2)对4组大鼠摄食情况观察发现:AP组、DAP组大鼠几乎不进食,少量饮水;QB组、DM组术后少量进食水(约每只20 g/d标准饲料);(3)对各组大鼠活动能力及灵敏度观察:术后24 h,4组大鼠活动能力和反应灵敏度均不同程度减弱,其中DAP组活动能力及对疼痛刺激灵敏度最差,DM组和QB组差别不明显。术后48 h,AP组、DAP组大鼠活动能力和反应灵敏度进一步减弱,而QB组和DM组大鼠活动度和反应灵敏度较24 h明显加强;(4)DAP组、AP组大鼠出现不同程度的腹胀、便秘,而QB组、DM组未发现腹胀、腹泻症状。
2.2 4组大鼠病理评分 按大鼠炎性反应的严重程度,对4组大鼠病理切片按Schmidt胰腺组织评分标准评分发现,AP组和DAP组的病理学评分较QB组升高,而DAP组评分高于AP组。DAP组胰腺组织水肿和炎性细胞浸润程度较AP组加重并出现明显的胰腺组织溶解坏死;DM组呈现轻微炎性反应状态,评分较AP组、DAP组降低,而QB组大鼠胰腺组织无明显变化,见图1。
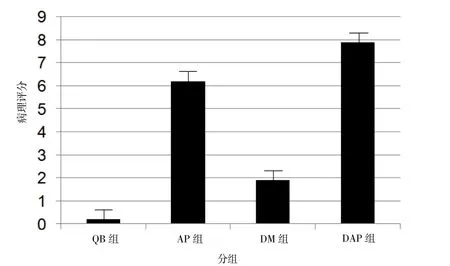
图1 4组大鼠Schmidt胰腺组织病理评分比较
2.3术后24 h血糖及血清淀粉酶 DAP组术后24 h血糖水平(19.4±2.5)mmol/L,较AP组的(17.7±2.0)mmol/L升高,差异具有统计学意义(t=2.24,P<0.05);DAP组术后24 h血淀粉酶水平(1786.7±108.8)U/L,较AP组的(1756.7±66.7) U/L无明显变化,差异无统计学意义(t=6.40,P=0.53)。
2.4 4组大鼠肠道菌群多样性指数 通过Gel-Pro Application软件,将4组大鼠ERIC-PCR图谱转变为波峰图,每1个波峰代表1条ERIC带,峰下面积代表条带亮度。4组大鼠肠道菌群多样性指数比较,AP组、DAP组较QB组多样性指数降低;与AP组相比较,DAP组肠道菌群多样性指数进一步降低,见图2。
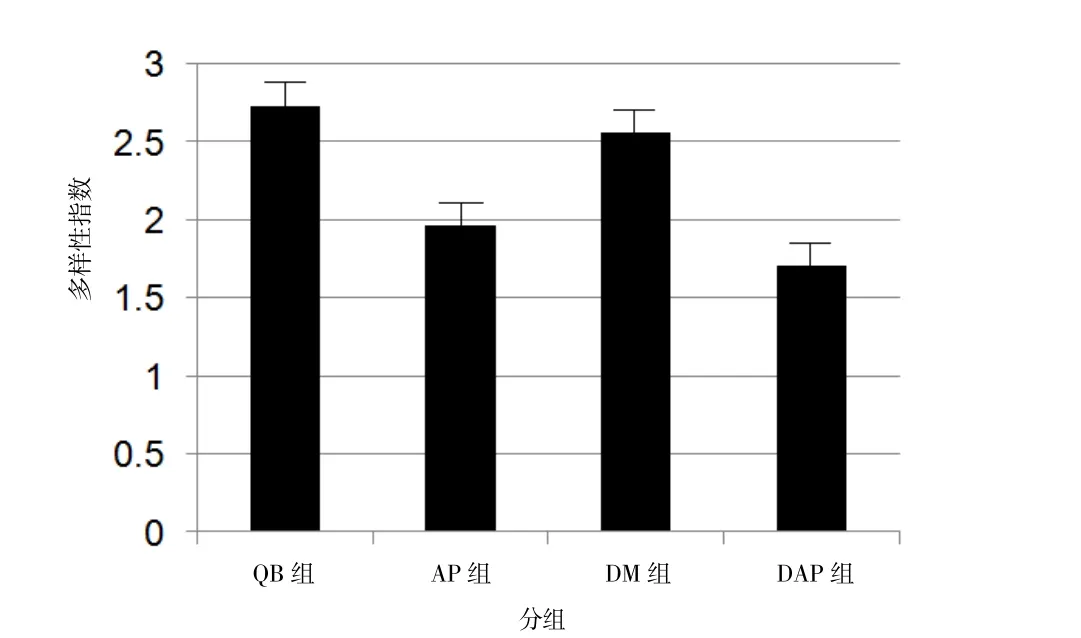
图2 4组大鼠菌群多样性指数比较
2.5 4组大鼠肠道微生物ERIC-PCR指纹图谱的分析及相似性聚类分析 4组不同大鼠粪便中提取的基因组DNA经PCR仪扩增后,每组均可扩增出6~18条不同的片段,所有特征性条带分布于100~2 000 bp,其中85%的特征性条带分布于200~1 500 bp。QB组特征性条带数目总数明显多于其他3组,特征性条带亮度相对均一,DM组次之,DAP组最差;DAP组特征性条带减少,200~500 bp部分条带亮度减弱,800~1 500 bp条带的亮度增强;DAP组与DM组比较特征性条带数量减少,200~500 bp处部分条带亮度减弱,800~1 100 bp条带的亮度增强。将4组大鼠ERIC-PCR指纹图谱进行相似性聚类分析比对,QB组与其他3组有较明显的差异,而AP组、DAP组比较靠近,但又存在一定的差异,见图3。
2.6肠道微生物菌群计数结果及比较 4组间肠道微生物菌群比较,差异具有统计学意义(P<0.05)。进一步两两比较,DAP组的双歧杆菌和乳酸杆菌低于QB、AP组,差异具有统计学意义(P<0.05);DAP组的大肠杆菌和变形杆菌高于QB、AP组,差异具有统计学意义(P<0.05),见表2。
3 讨 论
人体的神经系统、内分泌系统、免疫系统与各种体内微生物存在着非常复杂的联系[14]。糖尿病是内分泌、免疫系统最重要的疾病之一,而肠道是人体内最大的应急场所,肠道菌群的数目、种类远比目前发现的要多,其基因总量是宿主本身基因量的150倍以上[15],肠道微生态也被称为“第二基因组”。 肠道菌群不仅可以通过基因编码等多种机制参与宿主的能量代谢,还可为人体提供维生素、必需氨基酸、抗菌素和多肽等营养物质,分解体内一些有毒有害代谢物质,如亚硝胺、硫化氢和乳酸等,参与人体肠上皮的生长、分化、炎性反应等[16]。
近年来研究表明,肠道微生态与糖尿病、胰腺炎等多种疾病的发生发展密切相关,糖尿病患者机体长期处于一种慢性炎性状态[17],而当发生急性胰腺炎时肠道微生态失调,肠黏膜的免疫功能可放大胰腺组织及全身的炎性反应,使轻症迅速发展至重症;而当发生急性胰腺损伤时,胰腺组织局部微循环障碍,胰岛素分泌减少,增加了糖尿病酮症的风险。糖尿病和急性胰腺炎两者互为因果,使该类疾病病情发展迅速,患者病死率高,严重威胁其生命安全。国外研究表明,糖尿病患者CCK-A受体表达受到抑制,也可使胆囊运动减弱胰腺炎患者死亡的重要原因就是多功能脏器衰竭[18],目前诸多数据已经表明,胃肠功能障碍是胰腺炎并发感染及多系统器官衰竭的重要促发因素,胰腺炎加重的重要原因。糖尿病患者免疫功能较正常人明显降低,抗炎细胞减少,内环境功能紊乱,轻微的外界环境改变即可导致感染发生,进一步触发炎性因子大量释放,在IL-8趋化作用下,中性粒细胞可聚集于胰腺组织[19],导致急性胰腺炎的发生。
血、尿淀粉酶测定是临床诊断急性胰腺炎较为常用的检验方法,两者特异性强但敏感性较差,不能有效对急性胰腺炎做出快速诊断[20]。因此,了解糖尿病合并急性胰损伤大鼠的微生态参与的相互作用,探索快速有效的检测方法,对此疾病的诊断有重要的作用,可为临床糖尿病合并急性胰腺炎的治疗争取宝贵时间。
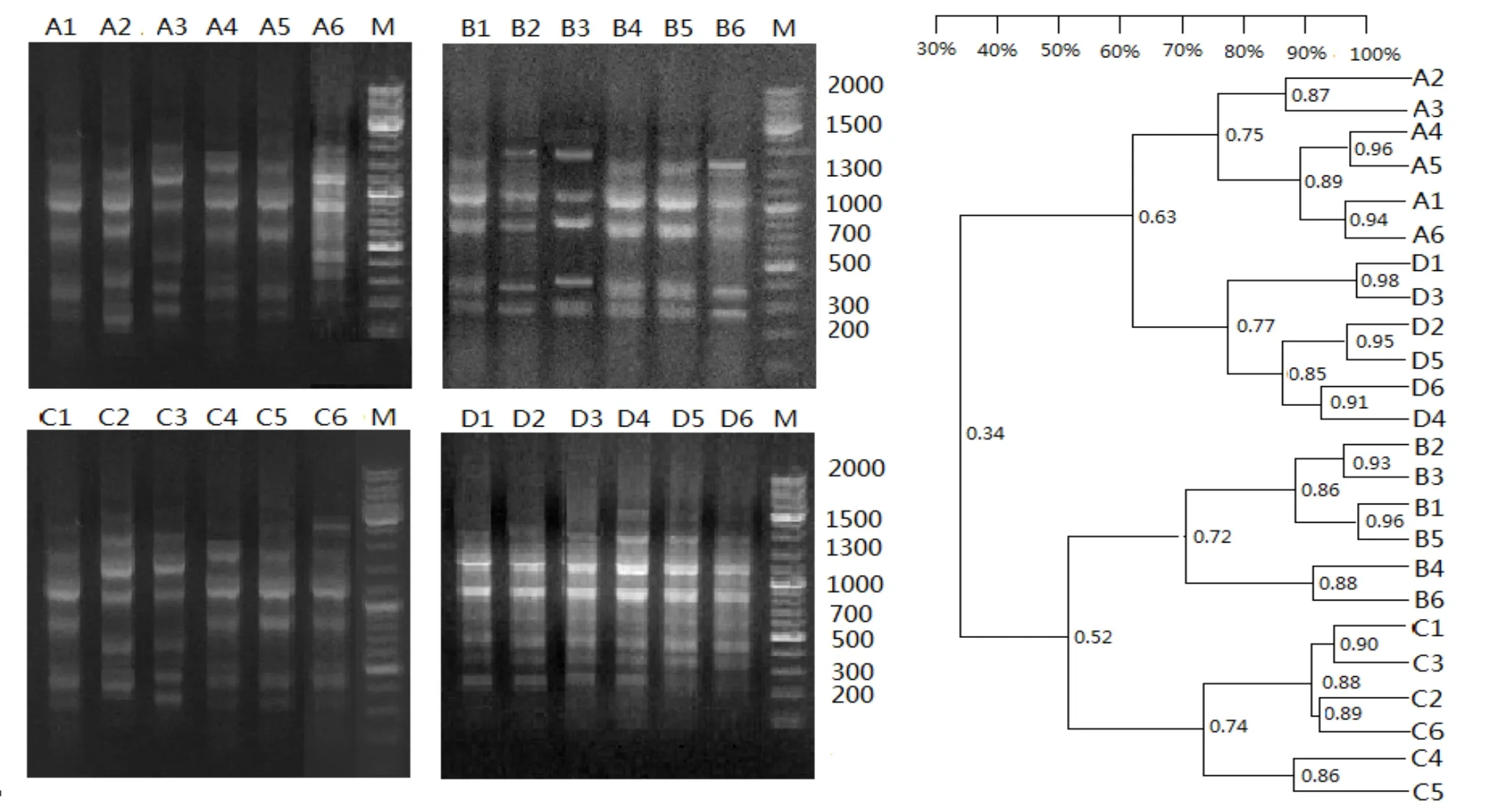
图3 4组大鼠肠道微生物ERIC-PCR指纹图谱及相似性聚类分析图
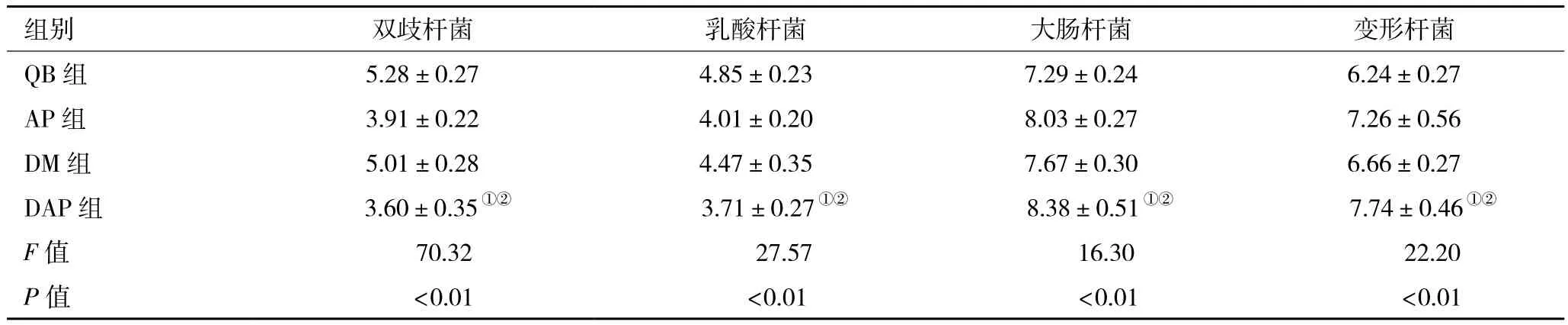
表2 4组肠道优势菌群菌落计数情况(x ±s,l g10n/g)
本研究采用3.5%牛磺胆酸钠胰胆管逆行注射法,制作急性胰腺炎大鼠模型,是比较成熟的造模方法,其在发病机制及病变等方面与人类临床糖尿病合并急性胰腺炎相似且方法稳定简便、成功率高[21]。ERICPCR样品的前期处理和DNA提取过程会影响PCR技术的重复性、准确性和特异性,并且PCR技术本身存在一个样本的检出限,所以粪便基因组提取过程及PCR反应条件的优化,对实验的顺利进行起到至关重要作用,本研究在参考既往研究成果的基础上,反复试验,优化PCR反应条件,最终得到较为清晰的图像[22]。
正常的肠黏膜物理屏障由黏液层肠黏膜上皮细胞和细胞间的紧密连接等构成。肠黏膜上皮细胞通过不断更新来保持肠黏膜屏障的完整性,嗜酸乳杆菌与双歧杆菌是肠道主要的益生菌,双歧杆菌属等专性厌氧菌定植于黏膜上皮细胞表面,能够阻止条件致病菌(如大肠埃希菌)对肠黏膜的黏附和定植,具有免疫调节、抗炎、抗癌、降血脂等方面的作用[23]。急性胰腺炎时肠道屏障的动态平衡被打破,肠麻痹导致肠蠕动减弱,肠道内容物堆积,脱落的细菌不能被及时排出体外,机会致病菌过度繁殖,肠道屏障受损,肠道通透性增加,细菌易发生迁移,打破肠道微生物动态平衡。既往研究发现,重症急性胰腺炎时,大量增殖的大肠埃希菌等条件致病菌通过受损的肠黏膜屏障进入腹腔定植于脏器表面导致腹膜及腹腔脏器感染,并通过扩张的毛细血管进入血液导致内毒素血症及多脏器感染及肠黏膜屏障损害,而且肠道微生态与细菌移位之间相互促进导致恶性循环是成为全身多脏器感染的环节之一[24]。肠道病理评分及死亡大鼠解剖显示DAP组大鼠肠黏膜屏障遭到破坏,肠黏膜绒毛变短、坏死、脱落、绒毛间质水肿、固有膜水肿伴大量炎性细胞浸润、肠壁通透性增加这与文献[25]的研究结果相符。
本研究证实了糖尿病合并急性胰腺炎大鼠肠道微生物ERIC-PCR指纹图谱条带多样性发生明显改变;并通过传统细菌培养法得到了验证。GK大鼠在发生急性胰腺炎前后,肠道菌群发生了明显的变化,GK大鼠并发急性胰腺炎前后的扩增条带有显著的多样性差异,聚类分析结果同样得到了证实;DAP组与AP组大鼠相比较,DAP组大鼠肠道菌群多样性指数进一步降低,表明2型糖尿病是急性胰腺炎加重的原因之一。GK大鼠发生急性胰腺炎损伤后,由于其菌群多样性变化,GK大鼠造模前后其指纹图谱发生明显的变化,在图谱上表现为条带数目减少,菌群多样性的降低,说明急性胰腺炎可使肠道菌群发生明显改变,这与笔者利用传统细菌培养法培养肠道微生物得到结果相符。将4组大鼠ERIC-PCR指纹图谱进行聚类分析对比后发现,QB组与其他3组有较明显的差异,而AP组、DAP组比较靠近,又有一定的差异;本研究发现,糖尿病大鼠在发生急性胰腺炎前后,肠道菌群发生了明显的变化,乳酸杆菌、双歧杆菌数量减少,而有大肠杆菌、变形杆菌数量不同程度的增加,同时笔者还发现,除了上述菌群外,还有很多未培养出来的菌群改变,表现在ERIC-PCR指纹图谱上为条带数量的减少,即菌群多样性降低;尽管目前尚不清楚菌群多样性的改变对糖尿病大鼠发生急性胰腺胰腺损伤有多大危害,但可推测在糖尿病发病过程中,益生菌的减少、条件致病菌的增多可能增加了糖尿病并发急性胰腺炎的风险,因此,笔者团队推测肠道菌群的改变在糖尿病并发急性胰腺炎的发生、发展过程中起到了一定的作用。
总之,本研究发现2型糖尿病大鼠并发急性胰腺炎后肠道菌群的结构均发生改变,菌群多样性减少;益生菌减少及条件致病菌的增多,肠道菌群的改变可增加并发急性胰腺损伤的风险,并且是胰腺炎进一步加重的重要影响因素;肠道菌群的变化参与2型糖尿病合并急性胰腺炎的病程进展,关注肠黏膜屏障的修复并纠正肠道菌群失调可能对该类疾病的转归及预后有一定价值。
【参考文献】
[1]Noel R A, Braun D K, Patterson R E,et al. Increased risk of acute pancreatitis and biliary disease observed in patients with type 2 diabetes: a retrospective cohort study [J]. Diabetes Care, 2009, 32(5): 834-838. DOI:10.2337/dc08-1755.
[2]Girman C J, Kou T D, Cai B,et al. Patients with type 2 diabetes mellitus have higher risk for acute pancreatitis compared with those without diabetes [J]. Diabetes Obes Metab, 2010, 12(9): 766-771. DOI: 10.1111/j.1463-1326.2010.01231.x.
[3]Lai S W, Muo C H, Liao K F,et al. Risk of acute pancreatitis in type 2 diabetes and risk reduction on antidiabetic drugs: a population-based cohort study in Taiwan[J]. Am J Gastroenterol, 2011, 106(9): 1697-1704. DOI:10.1038/ajg.2011.155.
[4]Goto Y, Kakizaki M. The spontaneous 2 diabetes rat: a model of noninsulin dependent diabetes mellitus [J]. Proc Jpn Acad Ser B Phys Biol Sci, 1981, 57(10): 381-384.
[5]Hulton C S, Higgins C F, Sharp P M. ERIC sequences:a novel family of repetitive elements in the genome of Escherichia coli, Salmonella typhimurium and other enterobacteria [J]. Mol Microbiol, 1991, 5(4): 825-834.
[6]Elsas J D V, Duarte G F, Keijzer-Wolters A,et al. Analysis of the dynamics of fungal communities in soil via fungalspecific PCR of soil DNA followed by denaturing gradient gel electrophoresis [J]. J Microbiol Methods, 2000, 43(2):133-151.
[7]Stefater M A, Pérez-Tilve D, Chambers A P,et al.Sleeve gastrectomy induces loss of weight and fat mass in obese rats,but does not affect leptin sensitivity [J].Gastroenterology, 2010, 138(7): 2426. DOI: 10.1053/j.gastro.2010.02.059.
[8]Berrabah W, Aumercier P, Gheeraert C,et al. Glucose sensing O-GlcNAcylation pathway regulates the nuclear bile acid receptor farnesoid X receptor(FXR) [J].Hepatology, 2014, 59(5): 2022-2033. DOI: 10.1002/hep.26710.
[9]Liu Z H, Peng J S, Li C J,et al. A simple taurocholateinduced model of severe acute pancreatitis in rats [J].World J Gastroenterol, 2009, 15(45): 5732-5739.
[10]田 华, 张喜平, 陈 力, 等. 重症急性胰腺炎大鼠模型制备的技术改良[J]. 中华急诊医学杂志, 2005, 14(3):211-214. DOI: 10.3760/j.issn:1671-0282.2005.03.009.
[11]Di Giovanni G D, Watrud L S, Seidler R J,et al.Fingerprinting of mixed bacterial strains and BIOLOG gramnegative (GN) substrate communities by enterobacterial repetitive intergenic consensus sequence-PCR (ERIC-PCR)[J]. Curr Microbiol, 1999, 38(4): 217-223.
[12]Keylock C J. Simpson diversity and the Shannon-Wiener index as special cases of a generalized entropy [J]. Oikos,2005, 109(1): 203-207.
[13]Hughes J B, Hellmann J J, Ricketts T H,et al. Counting the uncountable: statistical approaches to estimating microbial diversity [J]. Appl Environ Microbiol, 2001, 67(10):4399-4406.
[14]Hao L, Lu F, Wu Q,et al. High concentrations of methyl fluoride affect the bacterial community in a thermophilic methanogenic sludge [J]. PLoS One, 2014, 9(3): e92604.
[15]Qin J, Li R, Raes J,et al. A human gut microbial gene catalogue established by metagenomic sequencing [J].Nature, 2010, 464(7285): 59-65.
[16]Jean-Albert G, Marcel M, Combet F C. Germ-free C57BL/6J mice are resistant to high-fat-diet-induced insulin resistance and have altered cholesterol metabolism.[J]. Faseb Journal, 2010, 24(12): 4948-4959.
[17]Unisa S, Jagannath P, Dhir V,et al. Population-based study to estimate prevalence and determine risk factors of gallbladder diseases in the rural Gangetic basin of North India [J]. HPB (Oxford), 2011, 13 (2) : 117-125. DOI:10.1111/j.1477-2574.2010.00255.x.
[18]Yu C W, Shih T T, Hsu C Y,et al. Correlation between pancreatic microcirculation and type 2 diabetes in patients with coronary artery disease: dynamic contrast-enhanced MR imaging [J]. Radiology, 2009, 252(3): 704-712.
[19]Xiao S, Fei N, Pang X,et al. A gut microbiotatargeted dietary intervention for amelioration of chronic inflammation underlying metabolic syndrome [J].FEMS Microbiol Ecol, 2014, 87(2): 357-367. DOI:10.1111/1574-6941.12228.
[20]耿明霞, 殷少华, 马 杰. 不同检测指标对急性胰腺炎的早期诊断价值探讨[J]. 国际检验医学杂志, 2012, 33(22): 2798-2800. DOI: 10.3969/j.issn.1673-4130.2012.22.060.
[21]Liang H Y, Chen T, Wang T,et al. Time course of intestinal barrier function injury in a sodium taurocholate-induced severe acute pancreatitis in rat model [J]. J Dig Dis, 2014,15(7): 386-393. DOI: 10.1111/1751-2980.12148.
[22]陈思翀, 李祯祯, 陈 芳. 人体肠道益生菌的生理功能和安全性研究现状[J]. 中国微生态学杂志, 2007, 19(4): 397-398. DOI: 10.3969/j.issn.1005-376X.2007.04.039.
[23]Frossard J L, Steer M L, Pastor C M. Acute pancreatitis [J].Lancet, 2008, 371(9607):143-152.
[24]Rychter J W, van Minnen L P, Verheem A,et al.Pretreatment but not treatment with probiotics abolishes mouse intestinal barrier dysfunction in acute pancreatitis[J]. Surgery, 2009, 145(2): 157-167. DOI: 10.1016/j.surg.2008.09.011.
[25]李 燕, 吴 浩, 邓一芸, 等. 重症急性胰腺炎大鼠肠黏膜屏障及肠道菌群的变化[J]. 生物医学工程学杂志 , 2015, 32(2): 412-417. DOI: 10. 7507/1001-5515.20150074.

