腰椎后路减压内固定融合术后下肢静脉血栓形成与术后发热的相关性研究
吴璐梅,宋艳丽,王 辉,周 强,杨姗姗
静脉血栓栓塞事件包括肺栓塞和静脉血栓,是潜在的死亡危险因素。在美国,每年大约1/3的静脉血栓相关死亡病例(约150 000~200 000例)是术后发生的[1]。腰椎减压内固定融合术后患者的下地时间通常在术后7 d左右,长期卧床和疼痛所引发的下肢活动受限,常导致下肢深静脉血栓的风险增大[2,3]。由于下肢深静脉血栓脱落而引起的肺栓塞及脑栓塞可致命,所以血栓的预防是当今临床研究的热点,目前公认的机械预防静脉血栓措施包括弹力袜压缩和断续的气动压缩装置,并且药物预防,如低分子量肝素,也能有效地预防静脉血栓[4-6]。通过分析血栓发生的危险因素及影响术后血栓形成的个体因素,进而避免出现下肢静脉血栓,对于患者、家庭和社会具有重大的意义[7]。发热是术后最为常见的症状之一,机体温度的变化是一系列生理病理改变的综合表现,常导致血凝状态的对应性变化,与血栓的出现存在潜在的关联。截至目前,尚无对发热与腰椎术后下肢血栓形成的相关性进行分析的报道。本研究对于接受腰椎后路减压内固定植骨融合手术的病例进行回顾性分析,旨在分析腰椎后路减压内固定融合术后下肢静脉血栓形成与术后发热的相关性。
1 资料与方法
1.1资料 回顾性分析河北医科大学第三医院2009-02至2015-05脊柱二区接受腰椎后路减压内固定融合手术982例的临床资料。其中,男471例,女511例,年龄32~68岁,平均(48.3±6.8)岁。依据术后7 d下肢静脉彩超检查是否发生静脉和/或肌间静脉血栓分为血栓组(存在静脉和/或肌间静脉血栓)和无栓组(未发生血栓)。利用我院病案室病例检索系统收集手术相关数据资料。
1.2资料筛选标准纳入标准:(1)首次接受腰椎减压内固定融合手术者,既往无脊柱手术史;(2)术后7 d超声复查下肢静脉者;(3)术前及术后护理记录完整。排除标准:(1)术前下肢深静脉超声证实存在下肢静脉血栓或肌间静脉血栓者;(2)开窗减压髓核摘除术者;(3)具有脊柱侧凸、脊柱畸形、脊柱肿瘤、脊柱骨折者。
1.3观察指标 收集并比较两组的年龄、性别、手术时间(手术切皮至皮肤缝合结束的总时间)、术中出血量(术中引流瓶血液量)、输血量(压积红细胞及血浆输入总量)、术后引流量(术后引流瓶内总计引出液体量)、手术节段(腰椎手术责任节段数目:内固定及融合情况)、手术前后体温(术前1 d、手术当天、术后1~6 d)。体温测量为6点、10点、14点、18点,取四个时间点的平均值计入该病例当天的体温值。
1.4统计学处理 采用SPSS 13.0软件进行处理,计数资料以频数或率表示,组间比较采用Pearsonχ2检验;计量资料以x±s表示,组间比较采用独立样本t检验,以P<0.05/8=0.006为差异具有统计学意义。
2 结 果
2.1手术情况 982例患者均顺利完成手术,平均手术时间(118.3±24.7)min、术中平均出血量(329.7±54.0)ml、平均输血量(46.2±5.4)ml、术后平均引流量(103.2±13.2)ml、手术节段平均(1.5±0.2)个。所有患者术后第7天下地前行静脉超声检查,127例出现下肢静脉和/或肌间静脉血栓,855例无血栓出现,术后下肢血栓发生率为12.9%。
2.2两组一般资料及手术指标的比较 两组在年龄、性别组成、手术时间、术中出血、输血量、术后引流量、手术节段的比较,差异均无统计学意义(P>0.05,表1),具有可比性。
2.3两组手术前后体温值的比较 两组在术前1 d、手术当天、术后1 d、术后4 d、术后5 d、术后6 d体温值相比较,差异无统计学意义(P>0.05);血栓组术后2 d和3 d体温值高于无栓组,但差异无统计学意义(P>0.006,表 2)。
3 讨 论
外科手术后深静脉血栓形成的三大因素包括静脉血流滞缓、静脉壁损伤和血液高凝状态。当前开展的腰椎减压固定融合手术普遍手术时间较长(2~4 h),术中椎旁肌肉的显露与撑开导致肌肉破坏与溶解、术中血流动力稳定性的波动、麻醉扩容药物的使用等因素,均对血凝状态存在影响。术后数日内血液中血小板较正常高2~3倍,血小板对胶原纤维有很强的亲和力,当静脉内膜损伤后,血小板迅速聚集粘附于损伤部位,同时释放出凝血因子参与血液循环。术后血液呈高凝状态,为血栓形成创造了条件。手术中俯卧位和全身麻醉导致周围静脉扩张静脉流速减慢,麻醉作用使下肢肌内完全麻痹失去收缩功能,回心血量减少;腰椎术后通常下地时间较晚(5~7 d),术后长期卧床休息下肢肌肉处于松弛状态,致使血流滞缓诱发下肢静脉血栓形成。静脉内注射各种刺激性溶液和高渗溶液,如各种抗生素有机碘溶液高渗葡萄糖溶液等,均能在不同程度上刺激静脉内膜,导致静脉炎和静脉血栓形成。本研究认为,腰椎减压固定融合术后发热与血栓形成之间可能存在关联。
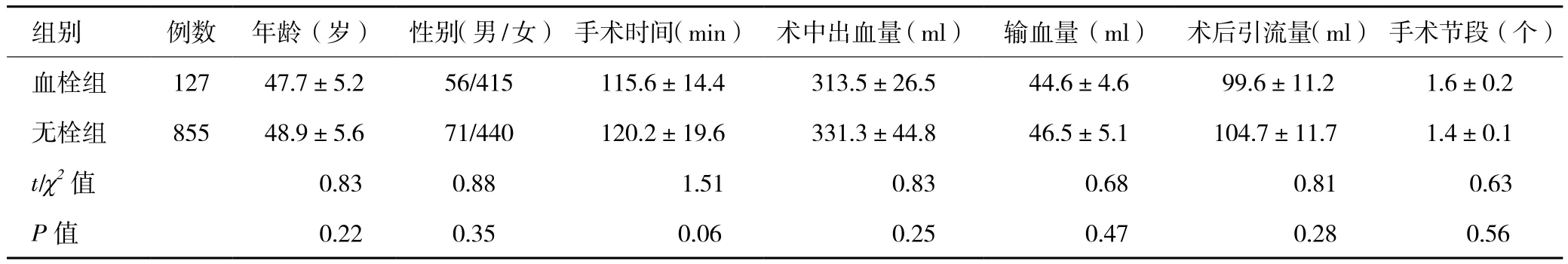
表1 血栓组与无栓组腰椎后路减压内固定融合术患者一般资料及手术指标的比较(x ±s)
发热是术后最为常见的症状之一,其中以非感染性发热最为常见,包括手术反应热、输液或输血反应热、药物热等。手术反应热最为常见,因术后48~72 h多数为引流管拔出时间,伤口内引流液的滞留可造成体温升高,所以发热多在手术当天或术后2 d出现,2~4 d后恢复正常,且体温通常不超过38.5 ℃。一般来说手术反应热的程度和持续时间与手术大小和损伤的程度有关,其机理是人体遭受严重伤或术后诱发一系列复杂的神经-内分泌系统反应和代谢改变,出现皮肤的血管收缩和代谢亢进,过度产热和氧消耗增加,此外损伤区血液成分及其他组织的分解产物吸收亦引起发热,即“吸收热”[8]。出现在输液、输血过程中的发热,患者主要表现为突然寒战、高热,体温可达39~40 ℃,严重者可出现休克。输液反应热的机制包括输入液体质量不合格、液体内加注药物质量不合格或配伍不当、输液器具有质量问题、输液环境或操作不当等原因导致外源性致热源入血激活白细胞释放内源性致热源引起发热。输血热为输血并发症,以非溶血性发热反应最常见,主要原因有致热源污染、免疫反应。药物热的机制一般认为是药物引起的延迟性变态反应,抗原抗体复合物被白细胞吞噬,释放内源性致热源导致体温升高。此外,感染性发热,如伤口感染、肺部感染、泌尿系感染均可导致术后发热的出现[9-11]。
目前,临床普遍认为在高温环境下,机体血液黏度增加、血流缓慢,从而会导致脑血栓形成[12,13]。基础研究也证实,高温可导致正常生理大鼠凝血功能呈现升高趋势,而纤溶功能呈现下降趋势[14]。表现为F1+2升高,D-二聚体下降。围手术期体温升高后新陈代谢会相应加快,体温每升高1 ℃,代谢会加快10%,而新陈代谢的增高,体热产生相应增加,导致体温升高,两者互为恶性循环。患者体温升高可出现呼吸急促、出汗、烦躁不安等症状,还会引起耗氧量增加,产生呼吸性及代谢性酸中毒,增加呼吸和心脏能量消耗[14]。由于体感蒸发会造成血容量的减少和电解质紊乱,血容量下降可引起血细胞比容(hematocrit,HCT)和血浆渗透压升高,从而造成全血黏度的增高,且会引起红细胞脱水,影响红细胞的变形能力,均不利于血凝状态的稳定性。体温升高后,血液流变学将出现明显改变,全血黏度在体温升高初期有所下降,由于体温升高导致血流加速,红细胞在血管内流动加快,红细胞很难聚集,因而表现出红细胞聚集性下降,变形能力增强,出现血液黏度降低[15-18]。
随着体温升高时间的延长,机体应激代偿能力减退,出现红细胞聚集性增强,变形能力下降,表现为低、中、高切时血液黏度增高。如果体温恢复正常后,由于脱水及热蓄积作用,血液黏度仍保持在较高水平上。红细胞压积及纤维蛋白原亦呈升高趋势,体温升高初期1~2 h升高幅度小,体温升高3 h后达到最高,体温升高停止后3 h仅略有下降。体温升高时HCT增加,表现机体有明显脱水,纤维蛋白原升高亦主要与血液浓缩有关。体温升高对机体的这种影响若持续下去,则可能导致微循环负荷加重,红细胞在微血管中流动不畅,当聚集的红细胞流经细小毛细血管时,容易造成堵塞,从而导致下肢深静脉血栓的形成[19,20]。本研究结果显示,血栓组术后2 d和3 d体温高于38.5 ℃,而无栓组体温未见明显波动,尽管两者的差异无统计学意义,但发热所伴随的体液内环境病理生理改变对血栓的形成具有一定关联,笔者认为该时间点体温的升高是腰椎后路减压固定融合术后下肢血栓形成的危险因素。
因此,术后针对患者体温升高的可能因素进行有效控制,例如术后合理应用抗生素避免感染(伤口感染、泌尿系感染、呼吸系统感染等)、合理补液、应用物理降温、心理疏导避免紧张情绪、合理调节室温、注意食物的热效应等措施,对于预防下肢深静脉血栓的形成具有积极作用。
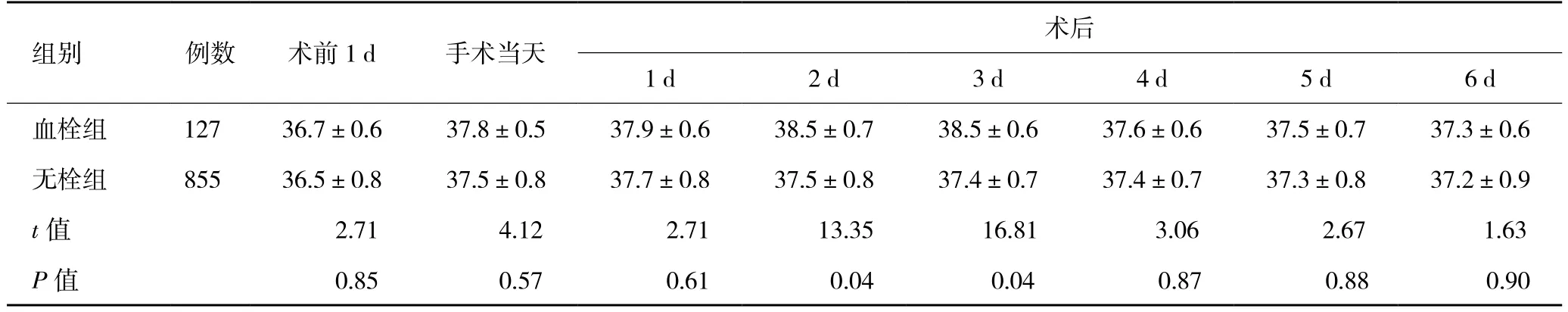
表2 血栓组与无栓组腰椎后路减压内固定融合术患者手术前后体温值的比较(x ±s,℃)
【参考文献】
[1]刘晓燕, 崔玉鹏, 郭霞珍, 等. 高温诱发脑梗塞发病的凝血纤溶活性机制研究[J]. 中华中医药学刊, 2011(6): 1349-1350. DOI: 10.13193/j.archtcm.2011.06.159.liuxy.091.
[2]杜培泽, 孙海波, 孙聪毅, 等. 下肢深静脉血栓形成多种因素的临床分析和研究[J]. 重庆医学, 2015, 44(9):1265-1267. DOI: 10.3969/j.issn.1671-8348.2015.09.039.
[3]李春会, 李惠玲, 邹叶芳, 等. 中老年髋膝关节置换术后患者下肢深静脉血栓的综合干预策略研究[J]. 中华护理杂志, 2015, 50(5): 532-536. DOI: 10.3761/j.issn.0254-1769.2015.05.004.
[4]Bandeira F C, Pitta G B, Castro A A,et al. Postoperative incidence of deep vein thrombosis after major lower extremity amputation [J]. Int Angiol, 2008, 27(6): 489-493.
[5]李文东, 李晓强, 钱爱民, 等. 下肢深静脉血栓形成治疗进展[J]. 中国实用外科杂志, 2014, 34(12): 1190-1193. DOI: 10.7504/CJPS.ISSN1005-2208.2014.12.25.
[6]祝春霞, 周长钰. 心血管病患者骨折后下肢深静脉血栓形成的相关分析[J]. 中华老年心脑血管病杂志, 2014, 16(6): 602-604. DOI: 10.3969/j.issn.1009-0126.2014.06.013.
[7]Deng F, Tang Q, Zeng G,et al. Effectiveness of digital infrared thermal imaging in detecting lower extremity deep venous thrombosis [J]. Med Phys, 2015, 42(5): 2242-2248. DOI: 10.1118/1.4907969.
[8]Shi W Y, Wang L W, Wang S J,et al. Combined direct and indirect CT venography (Combined CTV) in detecting lower extremity deep vein thrombosis [J]. Medicine(Baltimore), 2016, 95(11): e3010. DOI: 10.1097/MD.0000000000003010.
[9]Guo F, Shashikiran T, Chen X,et al. Clinical features and risk factor analysis for lower extremity deep venous thrombosis in Chinese neurosurgical patients [J]. J Neurosci Rural Pract,2015, 6(4): 471-476. DOI: 10.4103/0976-3147.169801.
[10]Chua K, Kong K H, Chan S P. Prevalence and risk factors of asymptomatic lower extremity deep venous thrombosis in Asian neurorehabilitation admissions in Singapore [J].Arch Phys Med Rehabil, 2008, 89(12): 2316-2323.DOI:10.1016/j.apmr.2008.05.025.
[11]叶为群, 凌 琳, 李学华, 等. 围手术期干预对高危人群妇科盆腔手术后下肢深静脉血栓的预防作用[J]. 中国现代医学杂志, 2014, 24(7): 76-79. DOI: 10.3969/j.issn. 1005-8982.2014. 07.019.
[12]Patra S, Srinivas B C, Nagesh C M,et al. Endovascular management of proximal lower limb deep venous thrombosis-A prospective study with six-month follow-up [J].Phlebology, 2015, 30(7): 441-448. DOI: 10.1177/026835 5514538423.
[13]Li F, Wang X, Huang W,et al. Risk factors associated with the occurrence of silent pulmonary embolism in patients with deep venous thrombosis of the lower limb [J]. Phlebology,2014, 29(7): 442-446. DOI: 10.1177/0268355513487331.
[14]Kim M H, Lee J, Jung S,et al. The involvement of ginseng berry extract in blood flow via regulation of blood coagulation in rats fed a high-fat diet [J]. J Ginseng Res, 2017, 41(2):120-126. DOI: 10.1016/j.jgr.2016.01.004.
[15]肖 超, 陈 臣, 陈荣富. 全膝关节置换术后并发下肢深静脉血栓患者血液动力学及流变学改变[J]. 重庆医学, 2014, 43(23): 3083-3085. DOI: 10.3969/j.issn.1671-8348.2014.23.041.
[16]Kim S Y, Lee K T, Mun G H. Postoperative venous insufficiency in microsurgical lower extremity reconstruction and deep vein thrombosis potential as assessed by a caprini risk assessment model [J]. Plast Reconstr Surg, 2015, 136(5): 1094-1102. DOI: 10.1097/PRS.0000000000001701.
[17]Kraft C, Hecking C, Schwonberg J,et al. Patients with inferior vena cava thrombosis frequently present with lower back pain and bilateral lower-extremity deep vein thrombosis [J]. Vasa, 2013, 42(4): 275-283. DOI:10.1024/0301-1526/a000288.
[18]张永春, 江智霞, 张振东, 等. 下肢深静脉血栓形成危险因素的病例对照研究[J]. 中国全科医学, 2012, 353(15): 3357-3359. DOI: 10.3969/j.issn.1007-9572.2012.28.050.
[19]Costanzo L, Di Pino L, Ragusa M,et al. Prevalence of asymptomatic lower limb venous thrombosis in infertile women with thrombophilic disorders [J]. Phlebology, 2015, 30(7): 449-454. DOI: 10.1177/0268355514539317.
[20]Elboudwarej O, Patel J K, Liou F,et al. Risk of deep vein thrombosis and pulmonary embolism after heart transplantation: clinical outcomes comparing upper extremity deep vein thrombosis and lower extremity deep vein thrombosis [J]. Clin Transplant, 2015, 29(7): 629-635.DOI: 10.1111/ctr.12566.

