EV71中和表位嵌合病毒样颗粒的表达纯化
梁璞 伊瑶 苏秋冬 毕胜利
102206 北京,中国疾病预防控制中心病毒病预防控制所
作为一种天然纳米颗粒,病毒样颗粒(virus-like particles,VLPs)可以将外源表位高度重复的展示在其表面,易被抗原提呈细胞识别以提高B细胞、辅助性T细胞及细胞毒性T淋巴细胞(CTL)产生免疫应答的能力[1],已经广泛用于疫苗研究领域[2-4],其中目前效果最好、应用最多的就是乙型肝炎病毒核心抗原(HBcAg)。HBcAg是由180或240个相同多肽亚单位组成的二十面体颗粒,其表面的α-螺旋组织结构允许补源多肽序列插入到主要免疫显性区域羧基端以及氨基端等多个位点,并保持甚至增强其免疫原性[5]。正确折叠和自我组装成VLPs[2],且对人体无细胞毒性,是制备病毒亚单位疫苗的理想载体[7]。
肠道病毒71型(EV71)是引起手足口病(hand,foot and mouth disease,HFMD)的主要病原体,手足口病好发于5岁以下儿童,传染性极强,近十年里,手足口病的年发病率一直位居我国法定传染病报告榜首[8]。EV71是一种嗜神经性病毒,其导致的手足口病更倾向于引发严重的中枢神经系统、呼吸系统和心血管系统并发症[9-10]。EV71是属于小RNA病毒科人肠道病毒A组(EV-A)的,单股正链RNA病毒,编码VP1~VP44种结构蛋白和7种非结构蛋白[10-11],VP1~VP3位于病毒衣壳表面,目前已证实VP1上的SP70与SP55线性表位可以有效刺激中和抗体产生,尤其是SP70表位氨基酸序列在EV71的所有基因亚型中均高度保守[12],且免疫原性明显强于SP55[13]。但单纯的多肽片段免疫原性相对较差,需要强佐剂或是一种理想的抗原表位展示系统来增强SP70对B细胞的刺激作用。
故本研究将EV71中和表位SP70插入截短HBcAg的主要免疫显性区域,利用原核表达系统,得到纯化的表面重复展示SP70表位的嵌合HBc-SP70 VLPs,用以增强SP70的免疫原性,该基因重组VLPs可以作为备选的EV71亚单位疫苗,为下一步开展动物实验评价其免疫保护效果提供基础。
1 材料与方法
1.1主要材料与试剂E.coliBL21(DE3) 感受态细胞购自北京全式金生物技术有限公司;限制性内切酶NedI、XhoI以及T4连接酶购自日本TaKaRa公司;Anti-HBc单克隆抗体购自美国abcam公司;Anti-sp70单克隆抗体购自北京京天成生物技术有限公司;HRP Goat Anti-Mouse IgG购自美国ABclonal公司;BCA Protein Assay Kit 购自美国Thermo Scientific公司。
1.2制备HBcAg嵌合SP70病毒样颗粒
1.2.1 基因合成:将位于EV71中和表位SP70(YPTFGEHKQEKDLEY)插入HBcAg截短氨基酸序列(AA1-144)中的第78与79位氨基酸残基之间(图1),按照大肠埃希菌偏好对该重组蛋白HBc-SP70基因片段进行密码子优化,并在SP70编码基因两端分别加酶切位点BamHI和SnaBI,在重组蛋白基因片段5′端引入酶切位点NdeI,3′端加终止密码子后连接酶切位点XhoI。之后交由生工生物工程(上海)股份有限公司进行基因合成。
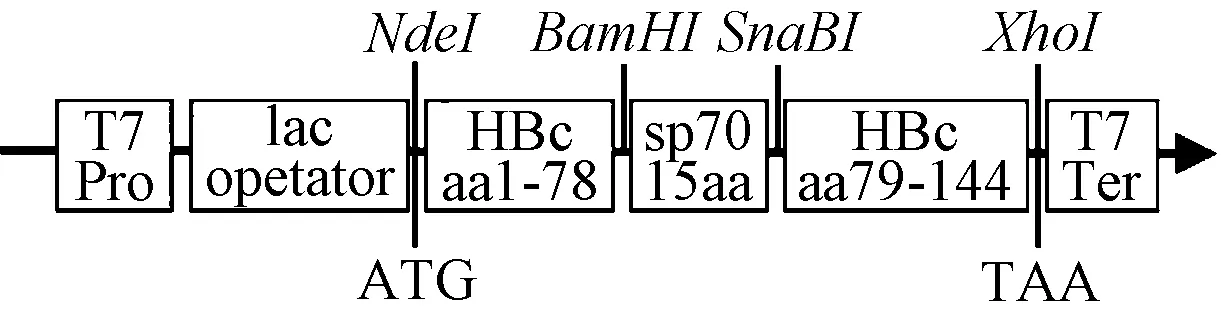
图1 HBc-SP70表达质粒示意图Fig.1 Schematic diagram of HBc-SP70 expression plasmid
1.2.2 构建目的蛋白表达质粒:重组蛋白基因片段人工合成后用限制性内切酶NdeI和XhoI酶切后与经相同酶切处理的表达载体pET-43.1 a连接,连接产物转化入E.coliBL21(DE3)感受态细胞中,37 ℃培养过夜。次日挑取单克隆菌落进行培养及质粒提取,并通过NdeI和XhoI双酶切筛选阳性克隆质粒,将测序鉴定正确的重组质粒保存备用,命名为pHBc-SP70。
1.2.3 目的蛋白HBc-SP70的表达和纯化:将转化入pHBc-SP70的E.coliBL21(DE3)接种于含氨苄青霉素(50 μg/ml)的LB培养基(10 g/L蛋白胨,5 g/L酵母提取物,10 g/L NaCl)中,30 ℃震荡培养过夜后加入等量新鲜LB培养基,37 ℃继续震荡培养至OD600值达到0.6左右时加入IPTG终浓度达到1 mmol/L,32 ℃继续震荡培养4 h。之后离心(4 000 g,10 min,4 ℃)收集菌体,用 mmol/L 10 Tris-HCl缓冲液(含0.01% Triton X-100,pH8.0)重悬菌体后冰上超声破碎(200 W,作用10 s,间隔30 s,15个循环),离心(13 800 g,5 min)取上清液加入DEAE阴离子交换柱,收集未结合介质的穿柱液,上样完毕后用100、200、400 mmol/L的NaCl溶液进行梯度洗脱,并收集相应洗脱液。通过SDS-PAGE观察目的蛋白在穿柱液及各梯度洗脱液中的分布情况。取目的蛋白所在液体组分以10%CsCl溶液垫层后离心(99 9000 g,5 h),沉淀用PBS缓冲液重悬后进一步做0%~60%CsCl密度梯度离心(87 000 g,16 h),注射器抽取离心管中目的蛋白层,经SDS-PAGE确认后即为纯化的目的蛋白HBc-SP70,用PBS 溶液在4 ℃透析过夜,于0 ℃保存。
1.3鉴定目的蛋白HBc-SP70的形态、浓度及抗原性
1.3.1 HBc-SP70的电镜观察:取适量目的蛋白铺展于载网上,磷钨酸染色处理,透射电镜观察。
1.3.2 HBc-SP70的浓度检测:根据BCA Protein Assay Kit操作说明制备牛血清白蛋白(BSA)标准品和BCA工作液,之后采用微孔板方案进行实验,检测各孔在562 nm处的吸光值,并结合标准品浓度(μg/ml)绘制标准曲线,计算待测蛋白浓度。
1.3.3 Western blot鉴定:纯化的HBc-SP70 VLPs上样15% SDS-PAGE后半干转至硝酸纤维素膜(NC),经含5% 脱脂牛奶的TBST封闭过夜后,用anti-SP70单克隆抗体或anti-HBc单克隆抗体室温孵育2 h,TBST洗膜3次后室温孵育HRP标记的羊抗鼠IgG抗体1 h,洗膜后显色。
1.3.4 ELISA鉴定:200 ng/孔HBc-SP70 VLPs包被96孔酶标板4℃过夜,次日用含5%脱脂奶的PBST 37℃封闭2 h,加入anti-SP70单克隆抗体或anti-HBc单克隆抗体100 μl/孔37℃作用1 h,洗板后加入HRP标记的羊抗鼠IgG抗体37℃孵育30 min,洗板后显色15 min,酶标仪检测各孔450 nm处吸光值。
2 结果
2.1嵌合HBc-SP70VLPs的构建表达和纯化如图1构建的重组质粒pHBc-SP70经NdeI和XhoI双酶切鉴定,证实重组蛋白HBc-SP70基因片段(507 bp)表达载体pET-43.1 a,测序确认无突变、移码等现象。
SDS-PAGE分析可见,转化入E.coliBL21(DE3) 的pHBc-SP70经诱导后,在约18.3×103处有明显目的蛋白表达条带(图2 A,泳道1),表明重组质粒pHBc-SP70在大肠埃希菌中可有效表达,之后经超声破碎菌、离心后,目的蛋白主要存在于上清中(图2 A,泳道2), 而且因为不能与DEAE层析介质结合,目的蛋白主要存在于穿柱液中,且约占穿柱液中总蛋白量的60%~70%(图2 A,泳道3)。穿柱液经10%CsCl溶液垫层离心后,沉淀被重悬并进行过夜CsCl密度梯度离心,最后在10%~20%CsCl密度区间内可见一条明显的白色浓缩蛋白层(图2B),经SDS-PAGE确定为目的蛋白HBc-SP70,且纯度在90%以上(图2C)。
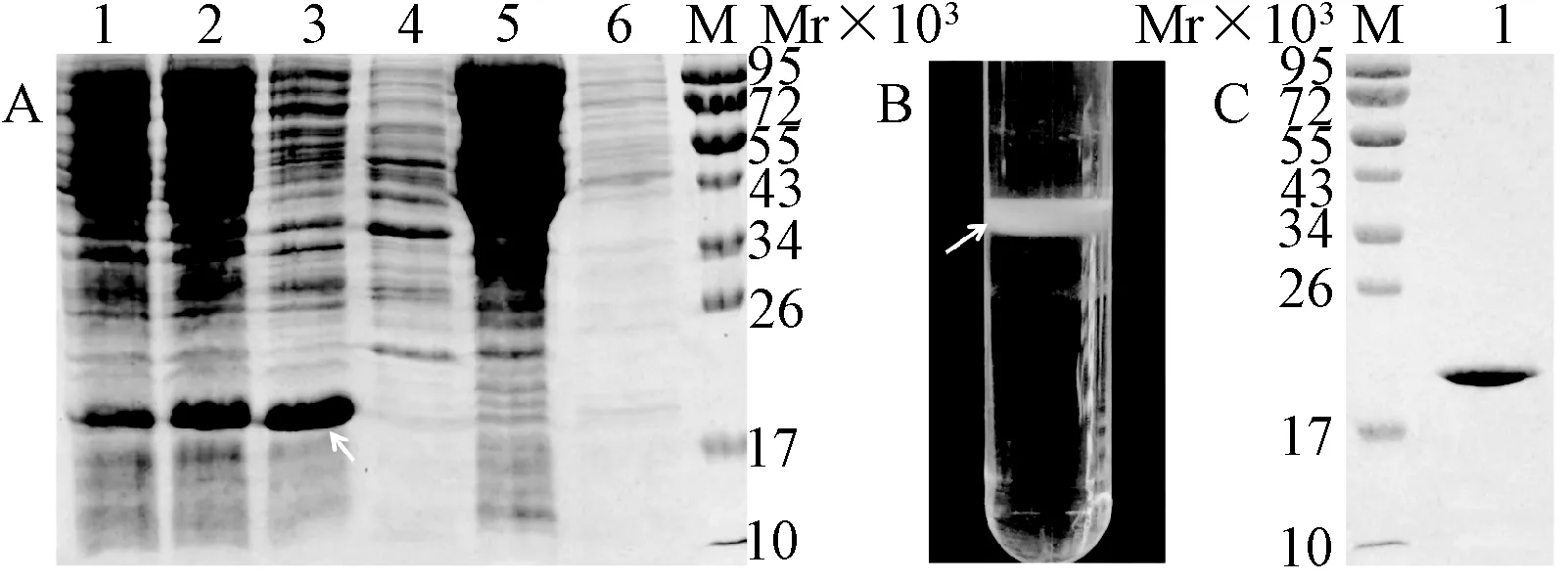
A:1,pHBc-SP70经诱导大量表达后的全菌蛋白;2,超声溶菌后的离心上清液;3,DEAE离子交换层析后的穿柱液;4~6,100、200、400 mmol/L NaCl洗脱液.C:1,纯化的目的蛋白图2 目的蛋白的表达纯化(A),CsCl密度梯度离心后目的蛋白在离心管中的位置(B)SDS-PAGE鉴定图B离心管中的纯化目的蛋白(C)A: 1, The distribution of the total bacterial protein after large-scale expression; 2, The supernatant after sonication; 3, Flow through during the DEAE chromatography; 4~6, elutes washed by 100, 200, 400 mmol/L NaCl. C: 1, Purified target proteinFig.2 The expression and purification of HBc-SP70 VLPs (A), The position of HBc-SP70 VLPs in the centrifuge tube after density gradient centrifugation (B). SDS-PAGE analysis of the purified target protein in the centrifuge tube (C)
2.2嵌合HBc-SP70VLPs的鉴定在透射电镜下,可看到大量纯化融合蛋白HBc-SP70自发折叠组装为直径约28 nm的二十面体空心病毒样颗粒(图3 A)。纯化后总蛋白浓度为1.11 mg/ml。
Western blot结果显示,无论采用抗HBc或抗SP70单抗作一抗,NC膜上约18.3×103处都有一条明显杂交带存在(图3B和3C);ELISA结果也显示,检测抗体为抗HBc或抗SP70单抗时,包被目的蛋白的实验孔在450 nm处的吸光值与空白对照孔(NC)比较均显著增高,差异具有统计学意义(P<0.001)(图3D)。WB与ELISA结果均证实嵌合HBc-SP70 VLPs具有良好抗原性。

1:HBc-SP70 VLPs;2:阴性对照;NC:阴性对照;***:P< 0.001图3 嵌合HBc-SP70 VLPs的电镜照片(A).目的蛋白的Western blot鉴定结果:一抗为抗HBc单克隆抗体(B),一抗为抗SP70单克隆抗体(C).目的蛋白作包被抗原,ELISA间接法鉴定结果1: HBc-SP70 VLPs; 2: negative control; NC: negative control; ***: P< 0.001.Fig.3 Electron microscopy image of the chimeric HBc-SP70 VLPs (A). Detection of purified HBc-SP70 by Western blot assay with anti-HBc monoclonal antibody (B), or with anti-SP70 monoclonal antibody (C). Detection of purified HBc-SP70 by indirect ELISA (D)
3 讨论
目前虽然商品化的EV-A71灭活疫苗已投入使用,但EV71衣壳蛋白VP1与人类脑组织蛋白之间存在共同抗原表位,可诱导机体产生高浓度的自身反应性抗体[14],所以全病毒疫苗具有引起自身免疫性攻击的潜在可能,研发新的基因重组亚单位疫苗十分必要。本研究以HBcAg截短序列为嵌合VLPs骨架,一方面避免了结合感染性核酸的可能,因此在电镜下可以清晰看到HBc-SP70VLP3为空心颗粒(图3 A);另一方面有研究发现[15],全长的HBcAg优先激发Th1 型免疫反应,主要与细胞免疫与局部炎症反应有关,而截短HBcAg则优先激发Th2型免疫反应,主要参与体液免疫应答,涉及B细胞增殖分化与抗体的产生,因此本研究利用截短HBcAg制备的嵌合VLPs可以促使其表面展示的中和表位更有效刺激机体内体液免疫系统,产生更高效价的中和抗体预防EV71感染。另外本研究对嵌合HBc-SP70 VLPs的纯化方法也做了优化:前人研究中[13],重组质粒经IPTG诱导后37℃表达2 h,导致超声破菌后,目的蛋白主要以包涵体形式存在于沉淀中,之后再经过洗涤复性等操作,不但降低了目的蛋白表达量,而且容易造成VLP3表面抗原表位丢失,所以本研究采用32℃低温诱导表达4 h,既提高了目的蛋白表达量,也使HBc-SP70融合蛋白一直以可溶状态存在,避免了变性复性对目的蛋白免疫原性的影响;再者本研究构建的融合蛋白羧基端没有连接His标签,更利于VLPs的自发折叠组装[16],还可以避免刺激机体产生抗His标签抗体,而大多数抗His标签抗体均可与血红素及多种正常组织结合[17],不利于后期免疫效果评价。综上所述,本研究构建的嵌合HBc-SP70 VLPs不仅可以作为未来备选的EV71基因重组亚单位疫苗,对HBcAgVLP3的表达纯化方法还可以广泛应用于制备其他疫苗、抗肿瘤药物或者检测试剂等。
利益冲突:无
参考文献
[1] Bachman MF, Jennings GT. Vaccine delivery: amatter of size, geometry, Kinetics and molecular patterns[J].Nat Rev Immunol. 2010, 10(11):787.DOI:10.1038/nri2868.
[2] Frietze KM, Peabody DS, Chackerian B. Engineering virus-like particles as vaccine platforms[J]. Curr Opin Virol, 2016, 18(6):44-49. DOI: 10.1016/j.coviro.2016.03.001.
[3] Koho T, Ihalainen TO, Stark M, et al. His-tagged norovirus-like particles: A versatile platform for cellular delivery and surface display.[J]. Eur J Pharm Biopharm, 2015, 96(10):22-31. DOI: 10.1016/j.ejpb.2015.07.002.
[4] Thrane S, Janitzek CM, Agerbk M, et al. A Novel Virus-Like Particle Based Vaccine Platform Displaying the Placental Malaria Antigen VAR2CSA[J]. Plos One, 2015, 10(11):e0143071. DOI: 10.1371/journal.pone.0143071.
[5] Whitacre DC, Lee BO, Milich DR. Use of hepadnavirus core proteins as vaccine platforms[J]. Expert Rev Vaccines,2009,8(11):1565-1573.DOI:10.1586/erv.09.121.
[6] Ludwig C, Wagner R. Vius-like particles-universal molevulartoolboxes[J]Curr Opin Biotechnol, 2007,18(6):537-545.DOI:10.1016/j.Copbio.2007.10.013.
[7] Marks M, Stanford C, Newton P. Viral nanoparticles and virus-like particles: Platforms for contemporary vaccine design[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2011, 3(2):174-196. DOI: 10.1097/BRS.0b013e318199650a.
[8] Yang S, Wu J, Ding C, et al. Epidemiological features of and changes in incidence of infectious diseases in China in the first decade after the SARS outbreak: an observational trend study[J]. Lancet Infect Dis, 2017, 17(7):716-725. DOI: 10.1016/S1473-3099(17)30227-X.
[9] Yi E J, Shin Y J, Kim J H, et al. Enterovirus 71 infection and vaccines.[J]. Clin Exp Vaccine Res, 2017, 6(1):4-14. DOI: 10.7774/cevr.2017.6.1.4.
[10] Solomon T, Lewthwaite P, Perera D, et al. Virology, epidemiology, pathogenesis, and control of enterovirus 71[J]. Lancet Infect Dis, 2010, 10(11):778-790.DOI: 10.1016/S1473-3099(10)70194-8.
[11] Huang SW, Cheng HL, Hsieh HY, et al. Mutations in the non-structural protein region contribute to intra-genotypic evolution of enterovirus 71[J]. J Biomed Sci, 2014, 21(1):33. DOI: 10.1186/1423-0127-21-33.
[12] Foo DG, Alonso S, Phoon MC, et al. Identification of neutralizing linear epitopes from the VP1 capsid protein of Enterovirus 71 using synthetic peptides[J]. Virus Res, 2007, 125(1):61-68. DOI: 10.1016/j.virusres.2006.12.005.
[13] Ye X, Ku Z, Liu Q, et al. Chimeric Virus-Like Particle Vaccines Displaying Conserved Enterovirus 71 Epitopes Elicit Protective Neutralizing Antibodies in Mice through Divergent Mechanisms[J]. J Virol, 2014, 88(1):72-81. DOI: 10.1128/JVI.01848-13.
[14] Fan P, Li X, Sun S, et al. Identification of a Common Epitope between Enterovirus 71 and Human MED25 Proteins Which May Explain Virus-Associated Neurological Disease[J]. Viruses, 2015, 7(4):1558-1577. DOI: 10.3390/v7041558.
[15] Zlotnick A, Cheng N, ConwayJ F, et al. Dimorphism of Hepatitis B Virus Capsids Is Strongly Influenced by the C-Terminus of the Capsid Protein[J]. Biochemistry, 1996, 35(23):7412-7421. DOI: 10.1021/bi9604800.
[16] Majorek KA, Kuhn ML, Chruszcz M, et al. Double trouble-Buffer selection and His-tag presence may be responsible for nonreproducibility of biomedical experiments.[J]. Protein Sci, 2015, 23(10):1359-1368. DOI: 10.1002/pro.2520.
[17] 赵向绒, 张海祥, 刘杨,等. His标签单克隆抗体的制备及交叉抗原的表位分析[J]. 细胞与分子免疫学杂志, 2016, 32(5):683-687. DOI: 10.13423/j.cnki.cjcmi.007766.
——一道江苏高考题的奥秘解读和拓展

