小边界与指南边界适形调强放疗联合替莫唑胺化疗在脑恶性胶质瘤的应用及其相关因素的回顾性研究
蒋先明 文 强 叶瑞智 刘丽丹
脑恶性胶质瘤作为难治性的肿瘤之一,在我国的年患病率约为(6~9)/10万,其3年死亡率在全身肿瘤中位于第3位,仅次于胰腺癌与肺癌[1-2]。在采取最大限度的安全切除术的基础上进行放射治疗与给予替莫唑胺同步化疗是治疗脑恶性胶质瘤的首选手段[3-4]。目前,有关放疗操作以适形调强放疗为主,且有关脑恶性胶质瘤的放疗剂量及其时间已形成一致看法,而有关放疗靶区的看法仍未统一[5]。因此,本研究就本院104例脑恶性胶质瘤患者进行探讨,回顾性研究小边界适形调强放疗与指南边界适形调强放疗联合替莫唑胺化疗在其中的应用及其相关因素。
1 资料与方法
1.1 一般资料 将本院2011年3月—2016年3月收治的104例脑恶性胶质瘤患者作为研究对象,均为高级别胶质瘤,且均符合《中国中枢神经系统胶质瘤诊断和治疗指南》中的诊断标准[6],并将104例患者分为行小边界适形调强放疗的观察组及行指南边界适形调强放疗的对照组,两组各52例。两组患者在性别比、年龄、肿瘤位置、卡氏功能状态(Karnofsky performance status,KPS)评分[7]、手术情况及 6-氧-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine DNA methyltranferase,MGMT)基因启动子区甲基化状态等一般资料的比较,差异均无统计学意义(P均>0.05)。见表1。

表1 两组脑恶性胶质瘤患者临床基本情况比较(x±s)
1.2 治疗方法
1.2.1 手术方法 通过导航引导与电生理监测进行手术操作,且通过术前及术后磁共振成像平扫与增强扫描以观察患者肿瘤影像学切除状况。其中,对照组中全切32例,局部切除17例,活体组织检查3例,而观察组中全切25例,局部切除22例,活体组织检查5例。
1.2.2 放疗方法 GTV:术后磁共振成像T1增强成像显示的残留肿瘤或(和)腔术。(1)对照组:CTV1:GTV 外扩 2cm,CTV2:GTV 外扩 1cm;CTV1剂量:45~50Gy,CTV2 剂量:10~15Gy。(2)观察组:CTV1:GTV及其附近水肿外扩 1cm,CTV2:GTV外扩0.5cm;CTV1 剂量:40~45Gy,CTV2 剂量:15~20Gy。两组患者均进行适形调强放疗操作,定位采取仰卧位热塑面罩与头枕进行固定。Simens螺旋CT进行扫描,范围从其颅顶到寰枢椎水平,各层均为3cm。采取同一层厚、同一体位的磁共振成像进行扫描,并分别将CT与磁共振成像显示的图像传输到Pinnacle 9.2工作站,对图像进行融合与制定相关计划。
1.2.3 化疗方法 两组患者在放射治疗的同时,均给予替莫唑胺进行联合化疗操作,75mg/m2,均晨起空腹进行用药,且嘱患者用药1h内不宜进食,放疗操作在用药后3h内进行。放疗结束后1个月,两组均开始替莫唑胺的维持治疗6个疗程,每周期150mg/(m2·d),连续服用5d,28d为1周期。第1周期 150mgm2/m2第 1~5 天;第 2~6 周期 200mg/m2·第1~5天,自第2个疗程起,按照化验结果,适当进行剂量调整,若患者血小板在80×109/L及以上,中性粒细胞在1.5×109/L及以上,且肝肾功能未见受损的情况下,将剂量改为200mg/m2。
1.3 随访处理 两组患者治疗期间均对其每日查房1次,治疗后通过门诊随访的形式,每3个月均对两组患者进行头部增强磁共振成像检查,且按照患者的实际情况加以磁共振成像平扫操作。
1.4 观察指标与疗效评价 (1)近期疗效:将同步放化疗治疗后3个月的疗效评价为标准,评价方法根据RANO法[8]进行①完全缓解:病灶彻底消失,且持续1个月以上;②部分缓解:肿瘤最大直径×最大垂直直径减少超过50%,其余病变并无明显扩大,且持续1个月以上;③疾病稳定:肿瘤最大直径×最大垂直直径减少或提高在50%及以下,且持续1个月时间;④疾病进展:肿瘤最大直径×最大垂直直径扩大25%及以上,亦或发现新病灶。其中,总有效率=完全缓解率+部分缓解率+疾病稳定率;(2)1年平均无进展生存期(progression-free survival of one year,PFS-1):若患者生存时间>1年,则将12个月作为截尾值,记录两组患者的PFS-1情况;其中,无进展生存期定义为患者从首次手术时间起到其肿瘤首次进展或末次随访(或死亡)的时间,主要用于评估两组患者在无进展生存率及生存率指标上是否存在差异。(3)1 年无进展生存率(PFSR-1);(4)记录两组患者的1年生存率情况。
1.5 统计学方法 将两组患者的临床相关数据录入SPSS21.0统计软件进行数据处理分析,其中计量资料用均数±标准差(x±s) 表示并采用t检验,而计数资料用百分率(%)表示,通过单因素分析对计数资料进行χ2检验,对单因素分析存在统计学意义的指标进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组随访结果 两组患者放化疗治疗过程较为顺利,且治疗后两组患者均获随访,其中对照组出现2例血小板轻度降低,1例白细胞轻度降低,观察组出现1例血小板轻度降低。此外,对照组化疗过程中呕吐2例,观察组中1例,3例患者均给予胃复安治疗后呕吐症状明显改善。对照组患者有13例患者发生头皮Ⅰ度放射性反应,观察组中有16例患者亦出现此现象,主要表现在射线路径上局部脱发现象,6个月后患者头发再生良好。两组治疗期间不良反应发生率的比较,差异无统计学意义(χ2=0.89,P=0.17)。
2.2 两组患者近期临床疗效的比较 同步放化疗治疗后3个月,均对两组进行近期疗效的评价,结果显示,对照组治疗总有效率稍低于观察组,但差异无统计学意义(P>0.05),见表 2。

表2 两组脑恶性胶质瘤患者近期临床疗效比较[例(%)]
2.3 两组患者1年生存情况比较 对照组PFS-1、PFSR-1稍低于观察组,但差异无统计学意义(P均>0.05),且两组 1 年生存率均为 100.00%(P>0.05)。见表3。
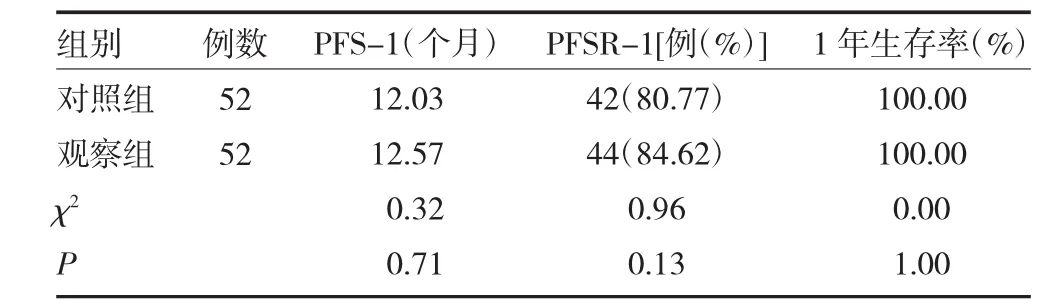
表3 两组脑恶性胶质瘤患者1年生存情况比较
2.4 相关因素分析 手术情况与和MGMT甲基化状态均是近期疗效的影响因素(OR=1.43、1.25,95%CI=[1.05~3.25]、[1.18~3.76],P 均<0.05),而手术情况是 PFS-1 的影响因素(OR=1.67,95%CI=[1.09~3.47],P<0.05)。
3 讨论
脑恶性胶质瘤病情发展较为迅速,且死亡率相对较高[9]。已有研究[10-11]表明,在对脑恶性胶质瘤患者进行适形调强放疗的同时,联合替莫唑胺进行同步化疗能够明显提高患者的生存率,延长其生存时间,同步放化疗的形式较单纯放疗的治疗效果更为理想,已逐渐成为治疗该病的标准方法。目前,学者们对放疗具体边界的看法尚未统一,术后进行单一放疗的患者约82%肿瘤复发出现在原发病灶3cm的范围内[12-13]。故EORTC在磁共振成像强化位置外加3cm的放疗边界,而RTOC在水肿外加2~3cm作为放疗边界[14]。亦有研究[15]指出,通过适形调强放疗联合替莫唑胺化疗时,将CTV的边界定为强化范围外约5mm处,此时患者肿瘤复发均为高剂量区,同时小边界适形调强放疗患者的生存率高于指南边界适形调强放疗患者。该研究表明,采取小边界适形调强放疗联合替莫唑胺化疗对脑恶性胶质瘤患者的治疗是可行的,因其不会增加局部肿瘤复发率,且不易改变复发类型。
本研究结果提示,同步放化疗的联合方法较为安全,不良反应发生率较低。同步放化疗治疗后3个月,指南边界适形调强放疗组PFS-1、PFSR-1、治疗总有效率稍低于小边界适形调强放疗组,但无明显差异。且两组1年生存率均为100.00%。手术情况与和MGMT甲基化状态均是近期疗效的影响因素。结果提示,同步放化疗的联合方法可行,且治疗效果较为理想,特别是MGMT甲基化呈现高表达状态的患者预后效果更为理想。其次,手术情况是PFS-1的影响因素,而MGMT甲基化状态对PFS-1的影响较小(P>0.05)。基于两组疾病进展时间上看,两组局部进展时间均为替莫唑胺化疗完成后5个月,提示针对化疗敏感者,若未采取继续化疗的方案,则容易引起疾病进展,进而减少PFS,这也反映出PFS-1不受MGMT甲基化状态影响的原因,亦提示长周期进行化疗治疗的必要性。
综上所述,小边界适形调强放疗与指南边界适形调强放疗联合替莫唑胺化疗在脑恶性胶质瘤中的疗效相当,缩小边界并不会提高进展率,手术情况是预后的重要影响因素。
参考文献
[1] Perry JR,Laperriere N,O'Callaghan CJ,et al.Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma[J].N Engl J Med,2017,376(11):1027-1037.
[2]王亚华,应雪,张春春,等.替莫唑胺联合姜黄素对C6胶质瘤细胞凋亡的作用[J].实用医学杂志,2016,32(10):1564-1567.
[3]陈新燕,黄李法,张昕.黄李法诊治神经胶质瘤经验介绍[J].浙江中西医结合杂志,2010,20(8):472-473.
[4]徐复娟,徐宝秋.徐宝秋治疗脑胶质瘤经验[J].浙江中西医结合杂志,2013,23(11):869-870.
[5]Wen PY,Kesari S.Malignant gliomas in adults[J].N Engl J Med,2008,359(5):492-507.
[6]《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断和治疗指南(2012)[J].中华医学杂志,2013,93(31):2418-2449.
[7] Wen PY,Macdonald DR,Reardon DA,et al.Updated response assessment criteria for high-grade gliomas:response assessment in neuro-oncology working group[J].J ClinOncol,2010,28(11):1963-1972.
[8]Silginer M,Weller M,Stupp R,et al.Biological activity of tumor-treating fields in preclinical gliomamodels[J].Cell Death Dis,2017,8(4):e2753.
[9]Wang N,Sun P,Lv M,et al.Mustard-inspired delivery shuttle for enhanced blood-brain barrier penetration and effective drug delivery in gliomatherapy[J].BiomaterSci,2017,5(5):1041-1050.
[10] Kоbylinska LI,Klyuchivska OY,Grytsyna II,et al.Differential pro-apoptotic effects of synthetic 4-thiazolidinone derivative Les-3288,doxorubicin and temozolomide in human glioma U251 cells[J].Croat Med J,2017,58(2):150-159.
[11] Sun S,Wang X,Xu X,et al.MiR-433-3p suppresses cell growth and enhances chemosensitivity by targeting CREB in human glioma[J].Oncotarget,2017,8(3):5057-5068.
[12]Koul D,Wang S,Wu S,et al.Preclinical therapeutic efficacy of a novel blood-brain barrier-penetrant dual PI3K/mTOR inhibitor with preferential response in PI3K/PTEN mutant glioma[J].Oncotarget,2017,8(13):21741-21753.
[13]毛德强,潘玲,戴勤弼,等.术后放疗联合替莫唑胺治疗高级别胶质瘤的近期临床疗效及安全性观察[J].重庆医学,2013,42(1):21-23.
[14]谢福川,肖伟,田允铭,等.高级别胶质瘤术后同期放化疗续贯多周期替莫唑胺化疗疗效分析[J].广东医学,2017,38(1):53-55.
[15] Liang F,Wang B,Bao L,et al.Overexpression of ILK promotes temozolomide resistance in gliomacells[J].Mol Med Rep,2017,15(3):1297-1304.

