大黄联合谷氨酰胺对急性肝衰竭模型大鼠肝功能及肠道屏障功能的影响
武 瑞 刘春涛 傅晓晴 王江娅 刘寿荣
肝衰竭是临床常见的严重肝病。而急性肝衰竭(acute hepatic failure,AHF)起病更加急骤且进展快,病死率极高[1]。由于该病发生时,肝细胞大量坏死,枯否细胞功能受损,肠道通透性增加,导致肝脏清除内毒素的功能下降,毒素吸收增加[2],从而进一步导致肠道功能受损。大黄是临床治疗肝病的常用中药之一,味苦,性寒,归脾胃、大肠、肝经,具有攻积导滞、凉血退黄等功效,能通过降低内毒素水平,减轻肝损伤,同时可清除肠内腐败物质和毒素。于盈等[3]研究认为大黄可通过减少炎性因子的释放,进而达到抑制肝细胞凋亡的效果,为肝细胞再生提供微环境。近年研究表明,在危重病和应激状态下,谷氨酰胺(glutamine,Gln)不仅能改善肠道黏膜的结构和功能,促进肠黏膜的修复,保证肠黏膜的完整性和减少肠道细菌移位[4],还能显著升高血中Gln水平,减少患者感染的发生率,从而降低多器官功能衰竭(multiple organ dysfunction syndrome,MODS) 患者的死亡率[5]。本实验通过联合用药治疗来观察AHF时大鼠的肝功能水平、血清和肠组织二胺氧化酶(diamine oxidase,DAO)活性等指标,探讨联合用药对AHF模型大鼠肠道功能紊乱的防治作用机制,为临床提供依据。
1 实验材料
1.1 动 物 成年雄性清洁级SD大鼠60只,体质量180~220g,由浙江中医药大学实验动物中心提供。实验动物合格证号:SCXK(沪)2007-0005。所有大鼠饲养于浙江中医药大学实验动物中心动物房,环境温度22℃,相对湿度55%。
1.2 药物及仪器 大黄饮片(批号070727):杭州中药饮片厂。L-谷氨酰胺(L-Glutamine)分析纯(批号020339):上海捷倍思基因技术有限公司生产。D-氨基半乳糖(GalN)(批号020226):上海捷倍思基因技术有限公司生产。0.9%生理盐水(批号40710223):杭州民生药业集团有限公司。肝功能(批号TP070817):日本和光纯药工业株式会社。DAO检测试剂盒(批号036554):南京建成生物技术研究所。生化培养箱SHP-250型:上海精宏实验设备有限公司。紫外分光光度仪:上海第三分析仪器厂产品。ZMN-9802电脑全自动组织脱水机:常州市华利电子有限责任公司。PAS8000病理图像分析系统:日本奥林巴斯株式会社。ZMN-7803全自动组织包埋机:常州市华利电子有限责任公司。徕卡RM2235型病理切片机:上海徕卡仪器有限公司。

表1 炎症活动度半定量计分系统[计分:P+L+2×(PN+BN)]
2 实验方法
2.1 分 组 60只SD大鼠适应性饲养7天。7天后在相同实验条件及实验环境下将大鼠按体质量分层随机分为肝衰竭模型组、对照组、防治组(大黄联合谷氨酰胺),各20只。
2.2 药物制备 大黄煎液的制备:称取大黄生药饮片700g,加蒸馏水至高于药材2cm左右,浸泡30min,后下煎煮30min,倒出药液;再加蒸馏水至高于药材2cm左右,浸泡30min后煎煮第2次,倒出并合并2次药液,过滤浓缩成生药含量1g/mL浓度,放入4℃冰箱冷藏保存备用。谷氨酰胺溶液的配制:用天平称取谷氨酰胺21g,用蒸馏水配制成3%溶液700mL,放入4℃冰箱冷藏保存备用。
2.3 造模给药 造模前2天给予防治组大鼠1g/mL大黄煎液0.375mL/100g大鼠体质量和3%Gln溶液0.375mL/100g大鼠体质量灌胃,模型组与对照组0.9%生理盐水0.75mL/100g大鼠体质量灌胃。第3天继续给药灌胃,参照文献方法[6]进行造模,使用临时配制的 10%的D-氨基半乳糖(D-GalN)溶液按1500mg/kg大鼠体质量给予模型组和防治组大鼠腹腔以注射方法进行一次性注射,完成造模,并自由饮水进食。实验第4天至第7天同前灌胃治疗,实验总计7天。
2.4 标本采集与处理 每只大鼠在造模后24、48、72和96h分别经眼眶静脉取血标本进行血清总胆红素(total bilirubin,TBil)、丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测。造模后第 4 天将大鼠处死,从大鼠腹主动脉处采集血标本,行全血离心后分离出血清保存于-80℃冰箱中备测DAO。动物处死后,将取出的部分肝右叶投入4%甲醛液中进行快速固定,以备行常规切片、免疫组化等组织病理学检测。取大鼠的末端回肠组织1cm置于标本袋中放入-70℃冰箱保存,待测肠组织DAO。
2.5 检测指标
2.5.1 血清肝功能检测 采用半自动生化分析仪检测各组大鼠造模后 24h、48h、72h、96h 的血清 TBil、ALT、AST水平。
2.5.2 肝组织病理及炎症活动度评分 采用2002年中华医学会肝脏病学分会制定的半定量计分系统(SSS),进行统计分析,见表 1。
2.5.3 血清和肠组织DAO检测 应用南京建成生物技术研究所生产的DAO检测试剂盒,采用双抗体夹心ELISA法,在340nm波长处读取吸光值,自动分析软件分析结果,取各标本均值进行统计分析。
2.6 统计学方法 应用SPSS20.0统计软件进行数据分析。计量资料用均数±标准差(x±s) 表示,采用F检验、q 检验或者 Dunnett’s-t检验,计数资料用 χ2检验,P<0.05为差异有统计学意义。
3 实验结果
3.1 各组大鼠血清TBil比较 造模后24h、48h模型组、防治组血清TBil均高于对照组(P<0.01)。与模型组比较,防治组血清TBil水平明显降低(P<0.01)。72h后模型组和防治组TBil呈逐渐下降趋势;与对照组比较,模型组血清TBil显著升高(P<0.05);与模型组比较,防治组血清TBil水平明显降低(P<0.01)。96h后各组大鼠血清TBil趋于正常但防治组仍低于模型组。见表2。
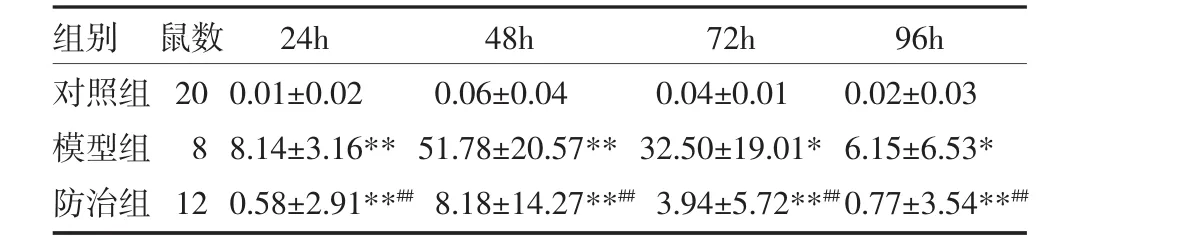
表2 各组大鼠血TBil比较(μmol/L,x±s)
3.2 各组大鼠血ALT比较 造模后24h、48h模型组、防治组血清ALT均明显高于对照组(P<0.01);与模型组比较,防治组血清ALT水平明显降低(P<0.01)。72h后防治组ALT水平均呈下降趋势。96h后各组大鼠血ALT已无差异,见表3。
3.3 各组大鼠血AST比较 造模后24h、48h模型组、防治组大鼠血清AST呈明显上升(P<0.01);与模型组比较,防治组 AST水平明显降低(P<0.01)。72h后模型组、防治组AST水平均明显下降。96h后防治组大鼠AST水平继续下降,接近正常。见表4。
3.4 肝脏病理变化 对照组的肝小叶正常结构清晰可见,肝板排列整齐。模型组肝小叶结构模糊,小叶内肝细胞严重变性,肝索排列紊乱,可见弥漫融合和大块坏死及桥接坏死。防治组肝组织损伤较模型组明显减轻,肝小叶正常结构存在,小叶内肝细胞疏松变性并见点状坏死及小片状坏死,可见少量中性粒细胞、淋巴细胞等浸润,肝板排列拥挤。防治组肝组织病变较模型组明显减轻(见封四图1)。
3.5 各组大鼠血清DAO、肠组织DAO、炎症活动积分比较 防治组及对照组大鼠血清DAO明显低于模型组(P<0.01)。防治组与对照组差异无统计学意义(P>0.05)。防治组及对照组的肠组织DAO明显高于模型组(P<0.01)。防治组与对照组差异无统计学意义(P>0.05)。与对照组比较,防治组和模型组大鼠肝脏炎症积分均明显升高(P<0.01)。防治组积分明显低于模型组(P<0.01)。见表 5。

表3 各组大鼠血ALT比较(U/L,x±s)

表4 各组大鼠血AST比较(U/L,x±s)
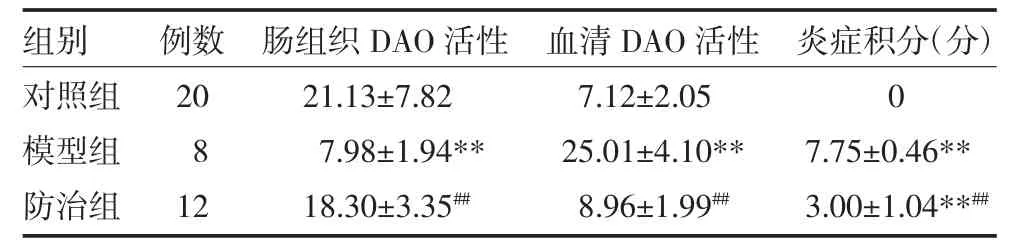
表5 各组急性肝衰竭模型大鼠肠组织和血清DAO及炎症活动积分比较(U/L,x±s)
4 讨论
AHF是短期内出现肝脏功能急剧恶化的严重肝病症候群,死亡率极高,目前发病机制尚未完全明确。现阶段主要倾向于“二次打击”学说,初次打击认为致病因素能直接导致肝细胞的大块坏死;而二次打击是以肠源性的内毒素血症为核心。AHF发生时,肝细胞大量坏死,枯否细胞功能受损,肠道通透性增加导致肝脏清除内毒素的功能下降[2],进一步使得正常肠道屏障受到破坏。而肠道功能损害是引起菌血症甚至MODS的重要机制[7],故应重视恢复宿主的肠道屏障功能[6]。
Gln是谷胱甘肽的合成前体,目前Gln在肠道粘膜屏障保护方面的研究较多,代辉等[8]研究认为在应激状态下Gln能保护机体组织免受氧自由基的损伤,并能降低创伤应激性胃肠道血管的通透性。同时,Gln也在肠道相关免疫系统中扮演着重要的角色,可以在肠道严重受损的情况下增加小肠的吸收面积和肠黏膜的细胞构成[9]。
翟璐等[10]认为大黄能通过促进肠蠕动,改善肠黏膜血流灌注,维持肠菌群的平衡,减少脂多糖(lipopolysaccharide,LPS)的吸收,清除氧自由基,拮抗细胞因子和炎性介质。另一项研究[11]表明,大黄还能保护肠黏膜形态学的完整性和正常通透性,维持肠腔中分泌型免疫球蛋白A(SIgA)于正常水平,从而对免疫系统的调节起到防治作用。于盈等[3]研究认为,大黄素能抑制IKK细胞信号传导通路,进而达到抑制肝细胞凋亡的效果,这可能是其治疗肝功能衰竭的机制。王晓锋等[11]研究认为,大黄与Gln联合应用能保护胃肠黏膜,减轻炎症反应水平,有助于胃肠手术后大鼠胃肠黏膜屏障功能的修复。本研究结果表明,大黄与Gln都具有保护肝脏的功能,而两者联合能够更好的减少AHF时肝脏的炎症、保护肝细胞。
DAO存在于哺乳动物小肠的黏膜或纤毛上皮细胞中[12],对肠黏膜具有保护作用,当小肠黏膜屏障功能受损时,DAO即从细胞内释放入血,此时血清DAO水平明显升高,小肠黏膜组织内DAO水平降低[13]。因而DAO的活性变化水平是反映肝衰竭大鼠肠屏障功能损伤较为理想的指标。本研究显示,防治组血清DAO明显低于模型组(P<0.01),肠组织DAO明显高于模型组(P<0.01),表明早期联合应用大黄和Gln能有效减轻肝衰竭时肠黏膜的损伤水平,联合应用效果更佳。
综上所述,大黄和Gln分别通过各自的途径保护AHF大鼠肝脏及肠屏障功能,并可能通过共同的机制互相促进。
参考文献
[1]中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南(2012 年版)[J].中华肝脏病杂志,2013,21(3):321-327.
[2]刘均艳,朱坚胜,赵海红,等.大黄对急性肝衰竭大鼠肝脏过氧化损伤及HIF-1α表达的影响[J].浙江中西医结合杂志,2011,21(4):225-228.
[3]于盈,王凤玲.大黄素治疗大鼠急性肝功能衰竭时核因子-κB 的动态变化[J].中国药业,2016,25(22):23-26.
[4]富琴琴,林梅芳,邓庆先,等.谷氨酰胺对新生大鼠坏死性小肠结肠炎肠道组织Caspase3及增殖细胞核抗原表达的影响[J].中国新生儿科杂志,2016,31(2):139-144.
[5]周瑞祥.谷氨酰胺强化早期肠内营养治疗重症急性胰腺炎的临床观察[J].医药导报,2013,32(7):885-889.
[6]黄娟君,李小鹏,程晓宇,等.急性肝衰竭大鼠模型肠道防御素-5、分泌型磷脂酶A2和溶菌酶表达变化及其与细菌移位的关系[J].中华肝脏病杂志,2014,22(12):932-937.
[7]邓旻,赵晓丹.肠道屏障功能障碍与MODS的发生及其防治[C].中华医学会急诊医学分会第17次全国急诊医学学术年会,2014.
[8]代辉,孟秋红.谷氨酰胺对创伤性应激性胃肠道溃疡的临床疗效[J].中国临床药理学杂志,2015,31(23):2287-2289.
[9]王爱丽,牛琼,史宁,等.谷氨酰胺对大鼠肠缺血再灌注损伤后闭合蛋白的保护作用[J].中国病理生理杂志,2015,31(2):364-368.
[10]翟璐,高巧营.大黄调控肠道水通道蛋白对脓毒症大鼠肠道菌群的影响[J].中国实验方剂学杂志,2016(3):127-131.
[11]王晓锋,沈耀亮,郑峰,等.大黄联合谷氨酰胺对大鼠肠黏膜屏障损伤后修复的实验研究[J].中国中西医结合急救杂志,2013,20(6):341-344.
[12] Zhao L,Luo L,Jia W,et al.Serum Diamine Oxidase as a Hemorrhagic Shock Biomarker in a Rabbit Model[J].Plos One,2014,9(8):e102285.
[13]Zhang JW,Zhang GX,Chen HL,et al.Therapeutic effect of Qingyi decoction in severe acute pancreatitis-induced intestinal barrier injury[J].World Journal of Gastroenterology,2015,21(12):3537.

