miR-145-5p靶向抑制RAD18表达调控替莫唑胺对脑胶质瘤细胞凋亡的影响
郑忠涛 祝叶 李霞
(海口市人民医院 1神经外科,海南 海口 570208;2全科医学;3万宁市人民医院神经外科)
脑胶质瘤是老年人群较为常见的原发性颅内肿瘤,也是恶性最高、侵袭性最强的人类恶性癌症之一〔1〕。目前,脑胶质瘤的治疗手段包括手术切除,放射治疗和化疗〔2〕。然而,所有这些治疗策略均已被证明无法完全抑制胶质瘤细胞,这也是脑胶质瘤患者复发率极高的重要原因。我国研究显示,脑胶质瘤患者的1、2、5年生存率分别为66.0%、45.3%及24.5%,中位生存时间仅约20个月〔3〕。目前,化疗是脑胶质瘤患者手术后采用的最主要的辅助治疗方法〔2〕。据报道,替莫唑胺是一线化疗药物,对抑制脑胶质瘤细胞增殖和诱导细胞凋亡具有显著作用〔4〕。虽然替莫唑胺治疗已广泛用于脑胶质瘤患者,但由于脑胶质瘤细胞耐药性的形成,其治疗效率并不是很高〔5〕。然而,固有或获得性替莫唑胺抗性的机制尚不清楚。因此,探讨替莫唑胺治疗耐药所涉及的分子机制将有助于提高替莫唑胺化疗在脑胶质瘤中的疗效。微小RNA(miR)是指长度约22个核苷酸的短链非编码RNA,可通过靶向靶基因mRNA 3′-非翻译区来调节癌基因和肿瘤抑制基因的表达〔6〕。近年研究发现,miR-145-5p在恶性肿瘤中发挥肿瘤抑制性miR作用〔7〕。然而,关于miR-145-5p在脑胶质瘤细胞对替莫唑胺化疗药物敏感性的影响尚未见报道。本研究旨在探讨miR-145-5p对调节脑胶质瘤细胞中替莫唑胺化学敏感性的影响,并探讨miR-145-5p及其靶基因的分子机制,以克服脑胶质瘤细胞化疗药物耐药性问题。
1 材料与方法
1.1 研究对象纳入与标本采集 选取2012年2月至2017年2月在海口市人民医院接受手术治疗的老年脑胶质瘤60例,年龄62~76〔平均(67.65±3.76)〕岁,女26例,男34例。脑胶质瘤确诊依据病理切片。术中采集所有患者外周静脉血5 ml,3 600 r/min离心分离血清。所有患者于术后口服替莫唑胺胶囊(国药准字H20040637),江苏天士力帝益药业有限公司生产,7粒/瓶(50 mg),75 mg/(m2·d),4 w为1个疗程,共4个疗程。所有患者门诊随访或电话随访18个月,统计患者复发率和生存率。
1.2 细胞培养和转染 人脑胶质瘤细胞系U87MG购自中国科学院上海生科院细胞资源中心。细胞在含有10%胎牛血清(美国Invitrogen公司),100 U/L青霉素和100 mg/100 L链霉素的DMEM改良培养基(美国Hyclone公司)中,于37℃和5%CO2条件下培养。miR-145-5p模拟物,miR-145-5p抑制剂和阴性对照由上海吉玛制药技术有限公司合成。用Lipofectamine 2000(美国Invitrogen公司)进行细胞转染。
1.3 miR-145-5p对U87MG细胞替莫唑胺化疗敏感性的检测 将U87MG细胞以每孔3 000个细胞接种于96孔板中并培养过夜以形成贴壁附着。次日,用浓度为200 pmol/L的miR-145-5p模拟物和阴性对照转染细胞。4 h后,分别加入含有不同浓度替莫唑胺的DMEM,浓度范围为12.5~800.0 μmol/L,通过MTT测定法测定细胞存活率。孵育48 h后,向每个孔中加入20 μl MTT的完全培养基,孵育4 h后用150 μl二甲基亚砜替换培养基并混合10 min,在492 nm下测量吸光度,计算替莫唑胺的半抑制浓度(IC50)值。
1.4 RNA提取和实时荧光定量聚合酶链式反应(qRT-PCR) 分别使用血清RNA提取试剂盒(武汉生之源生物科技有限公司)与Trizol试剂(美国Invitrogen公司)提取血清和各组细胞总RNA。采用一步法逆转录试剂盒(北京宝日医生物技术有限公司)将1 μg总RNA逆转录为cDNA后qRT-PCR检测。U6和GAPDH基因分别用作miR-145-5p和RAD18的内参。采用茎环法逆转录miR-145-5p。miR-145-5p和U6的逆转录引物分别是5′-CTCAACTGGTGTCGTGGAGTTTCAGTTGATGCATTC-3′和5′-CTCAACTGTGTTGGAGTCGGCAATTCAGTAA-AATATGGAAC-3′。miR-145-5p qRT-PCR的引物序列为:上游5′-CCAGCTGGGCTCACTGAACAATGA-3′和下游5′-CAACTGGTGTCGTGGAGTCGGC-3′。U6 qRT-PCR的引物序列为:上游5′-CTCGCTTCGGCAGCACAT-3′和下游5′-AACGCTTCACGAATTTGCGT-3′。RAD18的引物序列为:上游5′-GGTGAACTGGGGGAGGATTG-3′和下游5′-GGGCAGGCATGTT GACTTCAC-3′,GAPDH的引物序列为:上游5′-GAAGGTGAAGGTCGGAGTC-3′和下游5′-GAAGATGGTGATGGGATTTC-3′。所有引物由上海吉玛制药技术有限公司合成。每个样品检测3次,以2-ΔΔCT法来定量基因表达水平。
1.5 miR-145-5p靶基因预测和双荧光素酶报告基因测定 通过TargetScan在线预测RAD18的3′-UTR中miR-145-5p的种子序列,RAD18的野生型全长3′-UTR片段通过PCR进行扩增,纯化PCR产物并用限制酶消化并插入pGLO载体中以产生pGLO-RAD18-wt。从RAD18的3′-UTR突变预测的种子序列,使用重叠PCR方法以pGLO-RAD18-mut。以每孔4 000个U87MG细胞接种到96孔板中。使用Lipofectamine2000将pGLO-RAD18-wt,pGLO-RAD18-mut和pGLO共转染到具有miR-145-5p模拟物或阴性对照的细胞中。使用双荧光素酶测定试剂盒在转染后24 h进行荧光素酶测定。每组重复测量3次。
1.6 流式细胞术检测细胞凋亡 转染阴性对照、miR-145-5p模拟物、替莫唑胺(400 μmol/L)和替莫唑胺(400 μmol/L)+miR-145-5p模拟物孵育48 h后,用Annexin V-APC试剂盒进行U87MG细胞凋亡检测,检测仪器为美国伯乐公司FACS Calibur型流式细胞仪。应用AnnexinV-FITC和PI染色15 min。以Annexin V-FITC阳性凋亡细胞的数量占细胞总数的百分比计算细胞凋亡率。每组重复测量3次。
1.7 Western印迹检测 与miR-145-5p模拟物,miR-145-5p抑制剂,阴性对照,替莫唑胺(400 μmol/L)和替莫唑胺(400 μmol/L)+miR-145-5p模拟物孵育48 h后,在RIPA缓冲液中裂解U87MG细胞。将等量的蛋白质进行SDS-PAGE并转移至PVDF膜,并与RAD18、Bcl-2、Caspase、GAPDH一抗孵育,再与辣根过氧化物酶耦联的二抗温育后,通过在美国伯乐ChemiDoc MP凝胶成像仪上使用增强的化学发光底物试剂盒(美国Thermo Scientific公司)显现阳性条带。
1.8 裸鼠成瘤实验 SPF级雌性4~6周龄无胸腺裸鼠(BALB/c,15~20 g)20只,购自武汉大学动物实验中心〔SCXK (鄂)2016-0016〕,本研究实验动物福利伦理委员会的批准号:201801006。根据生物安全及生物伦理指导原则,实验动物饲养和实验过程中均按实验动物3R原则给予人道关怀。
将3×106个U87MG细胞悬浮于100 μl磷酸盐缓冲盐水中并皮下接种到20只裸鼠腹腔中建立脑胶质瘤异种移植模型。10 d后当肿瘤可见时,将裸鼠随机分成4组(n=5),第1组,将阴性对照(2 nmol)注射到裸鼠腹腔中;第2组,将miR-145-5p(2 nmol)注射到裸鼠腹腔中;第3组,将替莫唑胺(25 mg/kg)注射到裸鼠腹腔中;第4组,将miR-145-5p(2 nmol)和替莫唑胺(25 mg/kg)注射到裸鼠腹腔中。于接种U87MG细胞后第28天处死裸鼠并切除肿瘤称重。
1.9 统计学分析 采用GraphPad Prism7软件进行F检验、t检验及χ2检验。
2 结 果
2.1 脑胶质瘤患者术后血清miR-145-5p水平与预后相关性 术后脑胶质瘤患者血清miR-145-5p水平为6.12±1.87(-log),中位数为6.01(-log),依据miR-145-5p表达水平的中位数分为高表达组(n=30)和低表达组(n=30),两组性别、年龄、吸烟、饮酒史等差异均无统计学意义(P>0.05),见表1。18个月随访后,高表达组共6例复发,2例死亡;低表达组共14例复发,9例死亡。低表达组复发率显著高于高表达组(χ2=4.800,P=0.028);而高表达组生存时间显著高于低表达组(χ2=5.572,P=0.017,图1)。
2.2 miR-145-5p表达与U87MG细胞对替莫唑胺敏感性的关系 用miR-145-5p模拟物和阴性对照转染U87MG细胞后,经不同浓度替莫唑胺处理48 h。如图2所示,与阴性对照组相比,随着替莫唑胺浓度的增加,miR-145-5p模拟物组细胞活性显著降低,且miR-145-5p模拟物组可将替莫唑胺的IC50从406 μmol/L降至103 μmol/L。
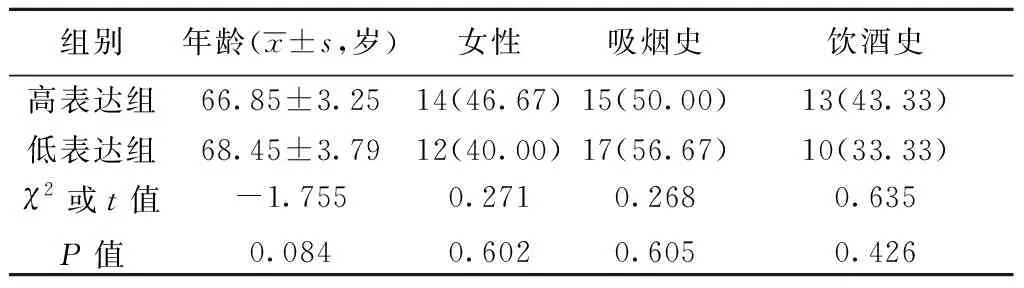
表1 miR-145-5p高表达组和低表达组间基本资料比较〔n(%),n=30〕

图1 脑胶质瘤术后血清miR-145-5p水平与患者预后分析

图2 miR-145-5p表达与U87MG细胞对替莫唑胺敏感性的关系
2.3 miR-145-5p靶基因选择与验证 应用TargetScan在线预测(图3)和双荧光素酶报告基因检测结果显示,pGLO-RAD18-wt组中,miR-145-5p模拟物组的荧光素酶活性(0.89±0.56)显著高于阴性对照组(0.27±0.37,P<0.05);而pGLO-RAD18-mut组中,miR-145-5p模拟物组(0.86±0.47)与阴性对照组(0.84±0.45)间荧光素酶活性的差异无统计学意义(P>0.05),提示RAD18是miR-145-5p的靶基因。转染48 h后,与阴性对照组〔13.45±3.54(-log)〕相比,miR-145-5p模拟物组RAD18〔7.04±1.67(-log)〕的mRNA水平明显降低,miR-145-5p抑制剂组RAD18〔18.98±4.33(-log)〕的mRNA水平明显增高,差异均有统计学意义(P<0.05)。
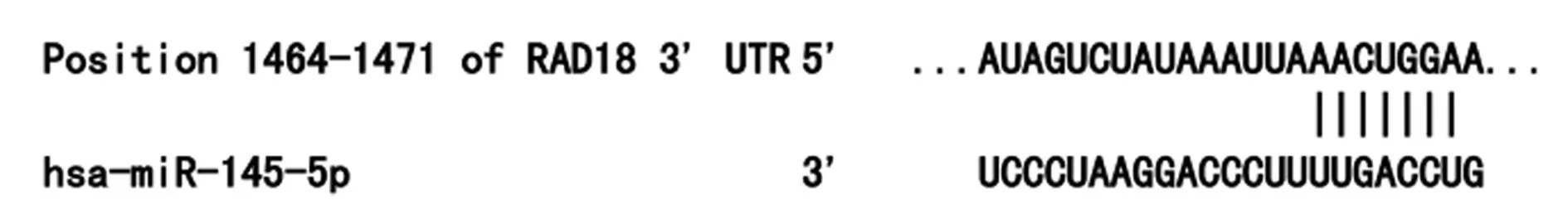
图3 miR-145-5p靶基因的预测
2.4 miR-145-5p对替莫唑胺诱导U87MG细胞凋亡的影响 与阴性对照组〔(5.19±0.32)%〕相比,替莫唑胺组〔(19.53±0.90)%〕、miR-145-5p模拟物组〔(17.32±0.77)%〕和替莫唑胺+miR-145-5p模拟物组〔(36.19±2.06)%〕细胞凋亡能力均显著提高(P<0.05),且替莫唑胺+miR-145-5p模拟物组细胞凋亡能力显著高于替莫唑胺组和miR-145-5p模拟物组(P<0.05),而替莫唑胺组和miR-145-5p模拟物组间差异无统计学意义(P>0.05)。与阴性对照组(RAD18:1.74±0.15,Bcl-2:1.35±0.11,Caspase:1.28±0.11)相比,替莫唑胺组(RAD18:0.83±0.10,Bcl-2:0.79±0.08,Caspase:2.15±0.15)、miR-145-5p模拟物组(RAD18:1.41±0.11,Bcl-2:1.02±0.09,Caspase:1.59±0.13)和替莫唑胺+miR-145-5p模拟物组(RAD18:0.62±0.07,Bcl-2:0.83±0.08,Caspase:3.97±0.24)的Caspase蛋白显著增高,RAD18和Bcl-2蛋白显著降低(P<0.05);miR-145-5p抑制剂组(RAD18:4.32±0.36,Bcl-2:5.11±0.42,Caspase:0.54±0.06)Caspase蛋白显著降低,RAD18和Bcl-2蛋白显著增高(P<0.05),见图4。

1~5:阴性对照组、miR-145-5p模拟物组、替莫唑胺组、miR-145-5p抑制剂组、替莫唑胺+miR-145-5p模拟物组图4 miR-145-5p对替莫唑胺诱导U87MG细胞凋亡相关蛋白表达的影响
2.5 miR-145-5p对替莫唑胺在裸鼠体内化疗敏感性的影响 与阴性对照组〔(2.45±0.33)g〕相比,单独注射替莫唑胺组〔(1.73±0.22)g〕、miR-145-5p组〔(1.91±0.25)g〕及替莫唑胺+miR-145-5p组〔(0.93±0.15)g〕裸鼠的肿瘤质量显著降低,且替莫唑胺+miR-145-5p组的肿瘤质量显著低于替莫唑胺组与miR-145-5p组(P<0.05)。
3 讨 论
越来越多miR与肿瘤相关的研究表明,miR在调节肿瘤细胞对化疗药物敏感性和耐药性方面发挥重要作用〔8,9〕。此前报道指出,miR-145-5p参与乳腺癌、膀胱癌等恶性肿瘤的发生并被视为脑胶质瘤的肿瘤抑制因子〔7,10〕。最近的证据表明miR-145-5p可通过下调TPT1使泌乳素瘤对溴隐亭的敏感性增加〔11〕。然而,关于miR-145-5p在脑胶质瘤细胞对替莫唑胺化疗药物敏感性的影响尚未见报道。本研究结果提示,miR-145-5p低表达与脑胶质瘤患者的预后不良相关,且可能与替莫唑胺耐药相关。进一步分析提示,上调miR-145-5p可以增加脑胶质瘤U87MG细胞对替莫唑胺的化学敏感性。前期研究证实,RAD18可通过下调p53表达,诱导胶质瘤对放射治疗产生抵抗〔12〕。本研究结果表明miR-145-5p可作用于RAD18并抑制其表达。鉴于 RAD18在前期研究中被证实可使FANCD2和PCNA蛋白的泛素化水平降低,并可抑制细胞凋亡〔13〕,本研究结果与前期研究相一致,表明miR-145-5p可通过抑制RAD18表达,调控凋亡相关蛋白Bcl-2与Caspase的表达水平,进一步促进细胞凋亡,并增加胶质瘤对替莫唑胺的敏感性。本研究尚有以下不足之处:①本研究收集的样本数量有限,且样本都来源于本院,这可能会使结果产生一定偏移,未来还需更多大样本多中心的研究对本次研究的结果进行验证;②本研究使用U87MG而非脑胶质瘤原代细胞,相比之下,原代细胞最大程度地保留了胶质瘤的肿瘤特性,可使结果的可信度进一步提高,因此,未来可使用脑胶质瘤原代细胞对本次实验结果进行验证。综上,本研究首次就miR-145-5p调控替莫唑胺治疗脑胶质瘤的潜在机制进行探究,并发现miR-145-5p可通过靶向抑制RAD18蛋白表达,进一步促进胶质瘤细胞凋亡,从而增加胶质瘤对替莫唑胺的敏感性。这些研究结果有望为脑胶质瘤的临床治疗提供新思路。

