规模化驴场几种重要传染病的调查研究
王仁虎,夏 楠,姜桂苗,陶永梅,刘宪斌 ,曲洪磊,刘桂芹,秦绪岭,刘文强*
(1.聊城大学,山东聊城 252059;2.东阿阿胶股份有限公司,山东东阿 252200; 3.临清市魏湾镇畜牧兽医站,山东临清 252600)
传统的分散养殖模式效益低下,造成了我国毛驴存栏量逐年降低,不能满足急剧增长的阿胶生产、驴肉和驴奶等行业发展的需要。为此,近几年出现的规模化养驴业得到了迅速发展,仅山东省就建立了超过200个规模化养驴场和扶贫驴场。这些畜牧场一旦出现传染病的流行,将会给养驴产业造成严重的经济损失,对其处理和治疗必然涉及到抗生素等药物的使用和残留,影响养殖安全,也进而影响相关产品的品质。而多种人兽共患传染病一旦出现,将给阿胶生产、驴肉、驴奶等行业带来直接而严重的食品药品安全危机。目前,国内外有关驴传染病的发病规律、地域分布、诊断方法、检测标准、预防控制和检疫净化措施等相关资料都需要进行调查研究。理论上马属动物疫病均可能在规模化养驴场发生和流行,多种动物共患的疫病,特别是人兽共患传染病也有可能在规模化养驴场造成感染。
根据相关文献报道,并结合我国其他畜种传染病的防控经验,在规模化养驴场有可能发生并造成严重威胁的传染性疾病包括流感、沙门菌病、布鲁菌病、疱疹病毒感染和日本脑炎等[1-5]。流感在驴群中发生的风险性高,特别是集约化规模化养殖场的风险更大。人、猪与马的流感病毒都是H3亚型,加之近3年禽流感H7N9亚型毒株流行严重,不排除发生种间传播和病毒重组,产生新的变异毒株的可能,极易在规模养驴场流行[6-8]。日本脑炎引起发热、神经症状和流产等表现,马属动物对日本脑炎易感性非常高,造成高热稽留、流产和神经症状等[5,9]。布鲁菌病造成马尔他热、繁殖异常,引起严重的贸易限制,其易感动物是羊、牛、猪和人等,国外也有驴群血清学调查的报道[10]。沙门菌引起败血症、肠炎、怀孕母驴流产,是动物性食品中最重要的细菌控制指标[11]。针对这些传染病的抗原或抗体检测应用于驴场检测,可以为传染病的监测净化和养驴产业的健康发展提供基础数据支持。
1 材料与方法
1.1 材料
1.1.1 驴场选择 于2015年11月和2016年6月,分别于山东省聊城市7个县区13个规模驴场,选择存栏量在300头~1 000头之间的驴场采样。
1.1.2 样品采集 按照常规方法共采集血液、棉拭子和病料226份。其中血液样品111份(健康驴45份、有呼吸道症状的驴66份),用于检测日本脑炎、布鲁菌病、流感病毒;拭子样品55份(健康驴30份、有呼吸道症状的驴25份),用于检测流感病毒;粪便样品63份(新生死亡驴驹23份、有腹泻症状的驴40份),用于检测沙门菌;采集流产死胎驴驹的肝脏病料7份用于检测布鲁菌病、日本脑炎、疱疹病毒和沙门菌。
1.1.3 主要试剂 PCR和反转录试验相关试剂,上海生工生物工程技术服务有限公司产品;布鲁菌病虎红凝集试验诊断抗原,青岛易邦生物工程有限公司产品;胶体金布鲁菌病诊断试纸条和C-ELISA布鲁菌病试剂盒,中国兽医药品监察所产品;马日本脑炎ELISA试剂盒,上海瓦兰生物科技有限公司产品;沙门菌培养的中国蓝培养基、SS琼脂培养基和血液琼脂培养基等,山东鑫科生物科技股份有限公司产品。
1.2 方法
1.2.1 样品处理 对血液样品,静置30 min后,以3 000 r/min离心15 min,取血清备用。粪便样品取1 g加到9 mL灭菌生理盐水中,充分混匀后吸取1 mL连续作10倍稀释后备用。鼻咽拭子使用生理盐水充分振荡洗涤,然后12 000 r/min离心30 min,取上清液备用。流产死胎和新生驴驹死亡后采集粪便和肝脏样品,用于分离沙门菌。
1.2.2 H3N8亚型流感病毒的血凝性检测和RT-PCR检测 参考1.2.1所述方法,将鼻咽拭子样品处理后接种10日龄SPF鸡胚,72 h后取尿囊液进行HA测定。使用Trizol试剂提取全血和拭子处理样品的RNA,参照文献[12]方法和HA、NA引物序列,进行反转录和PCR反应,并对反应产物进行电泳观察。
1.2.3 马疱疹病毒检测 取流产死胎驴驹的肝脏病料,委托中国农业科学院哈尔滨兽医研究所参考前文所述的real-time PCR进行鉴定。
1.2.4 布鲁菌病的检测 采用(竞争抑制)胶体金试纸条、虎红平板凝集试验和C-ELISA对血清样品进行了布鲁菌病筛查。按照说明书要求的程序进行操作。布鲁菌C-ELISA抗体检测试剂盒,内含抗原包被板、单克隆抗体4C3、阳性对照血清、阴性对照血清、羊抗鼠酶标抗体、羊抗鼠酶标抗体稀释液、样品稀释液、20倍洗涤液、底物显示液、终止液、血清稀释板等。
抑制率(PI)=(阴性对照OD 450 nm-检测样品OD 450 nm)/阴性对照OD 450 nm×100%
当血清样本的PI≥30%时,为布鲁菌病抗体阳性;当血清样本的PI<30%时,为布鲁菌病抗体阴性。
1.2.5 马日本脑炎抗体ELISA检测 参照试剂盒说明书进行操作。
试验有效性:阳性对照孔OD值平均值≥1.00,阴性对照孔OD值平均值≤0.15。临界值(Cut off)计算:临界值=阴性对照孔平均值+0.15;样品OD值<临界值(Cut off),样品为阴性;样品OD值>临界值(Cut off),样品为阳性。
1.2.6 沙门菌检测 按照无菌操作方式,取流产死胎、新生驴驹死亡后采集粪便和肝脏样品病料,使用血液琼脂培养基、SS琼脂培养基和中国蓝琼脂培养基分离沙门菌,然后将其置于37℃培养,对分离产物进行16 S rDNA鉴定。
2 结果
2.1 H3N8亚型流感病毒的RT-PCR检测
对怀疑流感的样品接种鸡胚,HA检测其血凝性,结果为阴性。对健康驴的血液和鼻咽拭子,以及有呼吸道症状的发病驴共170份病料进行了流感病毒检测,结果均为阴性(图1)。对于有发热、咳嗽和呼吸道炎症症状的病料进行细菌学分离,结果分离到金黄色葡萄球菌、肺炎链球菌、(洋葱)伯克霍尔德菌等。

M.DNA 标准;1~10.样品;+.阳性对照;-.阴性对照
M.DNA Marker;1-10.Samples;+.Positive control;-.Negative control
图1部分病料流感病毒的RT-PCR检测结果
Fig.1 The results of RT-PCR detection of influenza virus in part samples
2.2 马疱疹病毒的检测
经哈尔滨兽医研究所使用荧光定量PCR检测,结果表明,2份死胎驴驹病料中分离到马疱疹病毒4型(EHV-4),发现EHV-4感染率为3.6%(2/55),EHV-1病毒检测为阴性。
2.3 布鲁菌病的检测
使用虎红平板凝集试验、C-ELISA试验(表1)和胶体金(图2)检测52份病料,均为阴性。 由于所有检测样本检测结果均为阴性,所以选取10个样本结果进行展示。
2.4 马日本脑炎抗体ELISA检测
健康成年驴血清11份、新生死亡驴驹和流产驴驹13份,共24份样品,马日本脑炎抗体均为阴性。
2.5 沙门菌的检测
从发生驴驹死亡、流产和子宫炎等病料中分离沙门菌的结果均为阴性。

表1 布鲁菌抗体C-ELISA检测结果(部分)
注:+.阳性;-.阴性。
Note:+.Positive;-. Negative.
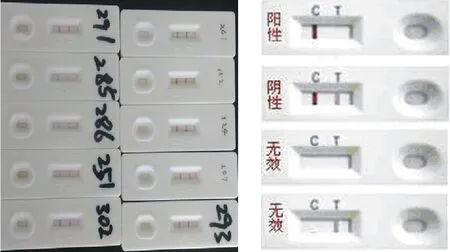
图2 布鲁菌胶体金抗体检测结果(部分)
3 讨论
据世界动物卫生组织(OIE)报道,近5年来每年世界上许多国家都会发生数十起不同程度的马病疫情,包括马流感、马传染性贫血和疱疹病毒感染等,部分已成为地方流行性疫病,国内也有少量马的检疫调查报告[12-13]。由于我国每年都从国外进口大量的驴皮、赛马或宠物马,国外疫区的非洲马瘟、西尼罗病和马脑病等多种烈性传染病也可能借此进入我国。驴养殖场会流行哪些疫病,并无相关文献或报道。参考其他畜禽规模化养殖场的发病危害,推测在规模驴场马流感、日本脑炎、布鲁菌病和沙门菌病等常见疫病具有严重危害,而且可以感染多种动物,甚至感染人。因此,有必要对养驴场的这些疫病进行调查分析,以评估其感染和分布情况。
马驴至少可以感染3种布鲁菌,即B.abortus(牛布鲁菌)、B.suis(猪布鲁菌)和B.canis(犬布鲁菌)。布鲁菌病属于慢性人兽共患传染病,以双相热、关节炎、生殖系统侵害为特征。国外马和驴布鲁菌病的阳性率不等[14],但是一般不会造成感染和发病,国内目前没有马属动物布鲁菌病的流行病学材料。由于驴群多数来自牧区,所以必须进行布鲁菌病调查和检疫。本文的调查结果显示,目前整个区域的规模驴场布鲁菌病处于良好的无疫状态。为了保证结果的准确性,使用了3种不同的检测方法,包括使用基于布鲁菌菌体、光滑型布鲁菌的LPS抗原等不同层次的试剂盒检测布鲁菌,结果均为阴性。布鲁菌胶体金抗体检测试纸使用便捷,仅需5 min即可得出结果,适用于基层服务人员。布鲁菌C-ELISA抗体检测准确性高。应用虎红凝集试验、布鲁菌胶体金抗体检测试纸条检测和布鲁菌C-ELISA抗体检测,结果一致,表明这些方法可以用于驴场布鲁菌病的调查。
自从1956年在捷克分离到H7N7亚型和1963年从美国分离到H3N8亚型流感病毒以来,马流感在国外报道较多,我国也曾经报道过马流感在马、驴和骡群体中呈暴发性流行或者检测出较高的血清阳性率,贵州省A型流感病毒的血清抗体阳性率为79.49%[15]。驴群中发生流感的风险性高,特别是集约化规模化养殖场的风险更大。人、猪、马的流感均属于H3亚型,不能排除种间传播和病毒重组产生新变异毒株的可能。由于运输应激、气候骤变和驴只抵抗力降低发生呼吸道疾病(例如感冒、支气管炎和肺炎等)后也可以继发马流感,也会由于马流感继发细菌感染。但是本次试验使用RT-PCR检测了马流感病毒的感染情况,并未检测出该病毒的核酸成分,仅仅分离到了肺炎链球菌、大肠埃希菌和金黄色葡萄球菌等病原菌(另有报道),这表明马流感在这些规模驴场尚未造成严重感染和流行,但是需要密切监测。
驴对日本脑炎病毒的易感性较高,在云贵川区域经常造成严重发病和损失,与该病在这些区域的地方流行性有较大关系[16],因此也是驴场调查的重点内容。本次调查未检测到本病发生,表明日本脑炎在这些规模驴场尚未造成感染,但是同样应该继续密切监测。
从流产驴驹的肝脏中检测到EHV-4,表明在驴场存在着疱疹病毒的感染。按照文献报道,EHV-1主要引起流产,EHV-4多引起马呼吸系统症状,在国内外报道较多[17-18]。这表明,这种EHV-4的感染还可能不是造成流产的主要原因,但是应该对此种疱疹病毒密切监测。以上检测可有效评估驴场生产中重要疫病的感染状况,为准确诊断病原、科学制定防疫措施提供技术支持。
在驴群可能发生的传染病中,多种动物共患的传染病主要有13种,包括驴流感(Equine influenza)、沙门菌病(Salmonellosis)、大肠杆菌病(Colibacillosis)、巴氏杆菌病(Pasteurellosis)、布鲁菌病(Brucellosis)、螨病/癣病(Acariasis/tinea disease)、破伤风(Tetanus)、肉毒梭菌中毒(Botulism)、炭疽(Anthrax)、日本脑炎(Japanese encephalitis)、衣原体病(Chlamydiosis)、支原体病(Mycoplasmosis)、钩端螺旋体病(Leptospirosis);主要在驴发生的传染病10种,包括马鼻肺炎(疱疹病毒1/4型)[Equine rhinopneumonia (herpesvirus 1/4)]、马传染性贫血(Equine infectious anaemia)、传染性子宫炎(Contagious equine metritis)、马腺疫(Strangles)、马传染性脑脊髓炎(Equine infectious encephalomyelitis)、流行性淋巴管炎(Epizootic lymphangitis、鼻疽(Glanders)、类鼻疽(Melioidosis)、非洲马瘟(African horse sickness)、流行性动脉炎(Equine viral arthritis);其他可在驴上发生的疫病有7种,包括伊氏锥虫病(Trypanosomiasis evansi)、巴贝斯虫病(Donkey babesiosis)、媾疫(Dourine)、马痘(Horsepox)、副结核(Paratuberculosis)、特定血清型的马链球菌病(Streptococcosis of specific serotype)和葡萄球菌病(Staphylocosis)等[1,5,7]。虽然本研究的监测结果表明这些传染病对驴群会产生不同程度的危害性,但是对其中几种重要传染病的初步调查结果表明,项目区的规模驴场处于良好的健康状态,提示应该坚持自繁自养的发展模式,做好生物安全工作,保障驴产业的健康发展。
参考文献:
[1] Virmani N,Bera B C,Gulati B R,et al.Descriptive epidemiology of equine influenza in India (2008-2009):temporal and spatial trends[J].Vet Ital,2010,46(4):449-458.
[2] 刘建国,陈 亮,李仁阁,等.驴沙门氏菌病的诊断与治疗[J].畜牧兽医杂志,2014(3):88-89.
[3] Lucero N E,Ayala S M,Escobar G I,et al.Brucellaisolated in human and animals in Latin America from 1968 to 2006 [J].Epidemiol Infect,2008,136(4):496-503.
[4] Vissani M A,Becerra M L,Olguín P C,et al.Neuropathogenic and non-neuropathogenic genotypes of equid herpesvirus type 1 in Argentina[J].Vet Microbiol,2009,139(3-4):361-364.
[5] 付启勇.马流行性乙型脑炎研究近况[J].中国兽医科技,1985(3):57-59.
[6] 冯淑萍,韦建华,易春华,等.广西马流感H3N8毒株的HA基因序列测定与分析[J].黑龙江畜牧兽医,2015(7):31-34.
[7] 马 建,刘 影,王晓钧.2015年国际马传染病疫情动态[J].中国预防兽医学报,2016,38(4):339-342.
[8] 张志诚,王志亮,侯哲生,等.基于病例-对照设计的中国马流感发生的集聚度探测研究[J]. 科学通报,2012,57(23):2192-2199.
[9] 杨 芳.家畜乙型脑炎的防制[J].养殖技术顾问,2014(10):129.
[10] Ocholi R A,Kwaga J K,Ajogi I.Phenotypic characterization ofBrucellastrains isolated from livestock in Nigeria[J].Vet Microbiol,2004,103(1-2):47-53.
[11] 王 欣.马沙门氏菌病的流行及诊治方法[J].现代畜牧科技,2017(4):129.
[12] 蒋桃珍,刘月焕,刘 健,等.2007年华北地区H3N8亚型马流感病毒的分离与鉴定 [J] .中国兽医学报,2010,30(5):607-611.
[13] 王永红.一起马流感疫情的成功防控 [J].甘肃畜牧兽医,2013,43(9):45-46.
[14] Ehizibolo D O,Gusi A M,Ehizibolo P O,et al.Serologic prevalence of brucellosis in horse stables in two northern states of Nigeria [J].J Equine Sci,2011,22(1):17-19.
[15] 冉隆仲,洪尼宁.贵州省部分马病血清学调查 [J].中国动物检疫,2014,31(11):86-89.
[16] 李艺星,尹遵栋,杨俊峰,等.2005年流行性乙型脑炎疫情分析 [J].中华实验和临床病毒学杂志,2006,20(3):216-218.
[17] Hu Z,Zhu C,Chang H,et al.Development of a single-tube duplex Eva Green real-time PCR for the detection and identification of EHV-1 and EHV-4 [J]. Appl Microbiol Biotechnol,2014,98(9):4179-4186.
[18] Patel J R,Heldens J.Equine herpesviruses 1 (EHV-1) and 4 (EHV-4)-epidemiology,disease and immunoprophylaxis: a brief review [J].Vet J,2005,170(1):14-23.

