发酵对黄芪中黄芪甲苷含量的影响
侯美如,尹珺伊,王 岩,刘 宇,陈楠楠,秦平伟,史同瑞
(黑龙江省兽医科学研究所,黑龙江齐齐哈尔 161006)
黄芪(Astragalus)系常用扶正中药之一,具有益气固表、补气养血、利水消肿、脱毒、敛疮生肌等功能[1],被广泛应用于人类及动物疾病的预防与治疗中。随着对黄芪制剂研究的逐步深入,应用微生物发酵手段替代传统炮制技术的研究也取得了一定的进展[2]。由于黄芪发酵产物受发酵物料组分、发酵菌种及发酵工艺等因素的影响,因此其有效活性成分的含量也不相同。黄芪中的主要活性成分是黄芪甲苷(astragaloside),黄芪甲苷也是《中国药典》中黄芪质量标准检测的标志物[3]。由于药典中使用的检测方法是薄层扫描法[4]与高效液相色谱-蒸发光散射检测器(high performance liquid chromatography couple with evaporative light scatting detector,HPLC-WLSD)[3]检测法,这些方法在含量测定中存在着试剂腐蚀性强、试验误差大、蒸发光散射器普及面不广等问题。为丰富黄芪发酵程度及产品质量评价方法,本文应用高效液相色谱-紫外检测法(high performance liquid chromatography couple with ultraviolet detector,HPLC-UV)检测黄芪甲苷含量,同时,比较黄芪固态发酵对黄芪甲苷含量的影响,为发酵黄芪制品的质量控制提供数据支持,为生产应用提供质量保障。
1 材料与方法
1.1 材料
1.1.1 仪器设备 日本岛津SPD-20A紫外检测器、LC-20AT二元泵、Labsolution色谱工作站,日本岛津公司产品;KQ5200B超声清洗仪,昆山市超声仪器有限公司产品;电子天平,梅特勒-托利多仪器(上海)有限公司产品;ZNCL-S自能恒温磁力搅拌器,上海羌强仪器设备有限公司产品;PINE-TREE帕恩特标准试剂级超纯水机,北京湘顺源科技有限公司产品;恒温振荡器HZQ-FX型,哈尔滨市东联电子技术开发有限公司产品。
1.1.2 菌株与试剂 产纤维素酶解淀粉芽胞杆菌SSY1株,由黑龙江省兽医科学研究所细菌研究室分离鉴定并保存;黄芪甲苷标准品(含量98%,批号20160924),购自上海金穗生物科技有限公司;黄芪,购自河北凯达药业有限公司;乙腈(色谱纯,批号20161210)、甲醇(色谱纯,批号20161108),购自天津市科密欧化学试剂有限公司。
1.2 方法
1.2.1 标准品制备 精密称取4.8 mg黄芪甲苷标准品,置于10 mL容量瓶中,加入适量流动相,超声溶解,定容至刻度,备用。
1.2.2 发酵黄芪及对照品制备
1.2.2.1 黄芪发酵 按照黄芪粉30%、黄豆粉10%、CaCO30.2%、水59.8%组分制备发酵培养基。取解淀粉芽孢杆菌种子液,以2%接种量接种黄芪发酵培养基,在37℃发酵培养72 h,发酵物中活菌数约为7.67×108CFU/g。
1.2.2.2 对照品 另外取无菌肉汤,按2%接种量接种黄芪固态发酵培养基,按照发酵黄芪制备方法进行发酵培养。
1.2.3 有效成分的提取 取发酵组及对照组固体培养基各5 g,分别加水50 mL,置于微量振荡器上混匀1 h,离心取上清,分别置于分液漏斗中,加入正丁醇50 mL,进行萃取。弃液再次用正丁醇萃取,合并正丁醇萃取液,加入10 g/LNaOH溶液100 mL,洗涤3次,除色素后用超纯水洗至中性,收集正丁醇溶液,置70℃水浴挥干溶剂,加甲醇溶解,待完全溶解后定容至5 mL,摇匀,经0.45 μm滤膜过滤,超声除气,备用。
1.2.4 色谱条件 Inertsustain C18色谱柱(150 mm×4.6 mm,5 μm),流动相为乙腈、水(32∶68),检测波长203 nm,柱温25 ℃,流速1 mL/min,进样量:20 μL。
1.2.5 系统适应性试验 分别取标准品、发酵黄芪组及对照组黄芪甲苷提取液,经超声,过0.45 μm滤膜后进样20 μL,对方法系统适应性进行考察。
1.2.6 线性关系考察 用流动相稀释黄芪甲苷标准品溶液,稀释浓度分别为0.48、0.36、0.24、0.12、0.06 mg/mL,摇匀,经0.45 μm滤膜过滤,超声除气,备用。按上述色谱条件对黄芪甲苷含量进行测定,以液相色谱峰峰面积(A)对浓度(C)绘制标准曲线。
1.2.7 精密度试验 精密吸取黄芪甲苷标准品溶液20 μL,重复进针6次,测定的黄芪甲苷峰面积,对方法精密度进行考察。
1.2.8 稳定性试验 取黄芪甲苷标准品分别于0、2、4、6、8、10 h进样1次,对方法稳定性进行考察。
1.2.9 加样回收率试验 精密称取已知含量的黄芪粉末各3份,分别加入黄芪甲苷标准品溶液0.5、0.25、0.125 mL,按1.2.3有效成分的提取方法进行操作,测定峰面积,计算回收率。
1.2.10 样品含量测定 取黄芪发酵组及对照组黄芪甲苷提取液各20 μL,按上述色谱条件对黄芪甲苷含量进行测定。
2 结果
2.1 系统适应性试验
由图1可知,标准品、发酵黄芪组及对照组黄芪甲苷提取液分别在2.149、2.165、2.157 min的保留时间出现独立峰。
2.2 线性关系考察
以液相色谱峰峰面积(A)对浓度(C)绘制标准曲线,结果见图2。其回归曲线为A=2 034 519.61C-4711.54,相关系数R2=0.999 3,线性范围为0.06 mg/mL~0.48 mg/mL,结果表明线性回归较好。

A.黄芪甲苷标准品色谱图;B.对照组及发酵组黄芪甲苷色谱图;1.黄芪甲苷标准品;2.发酵组黄芪甲苷;3.对照组黄芪甲苷
A.Chromatogram of astragaloside standard; B.Chromatograms of astragaloside in control group and fermentation group;1.Astragaloside standard; 2.Fermentation group astragaloside; 3.Control group astragaloside
图1黄芪甲苷色谱图
Fig.1 Chromatogram of astragaloside
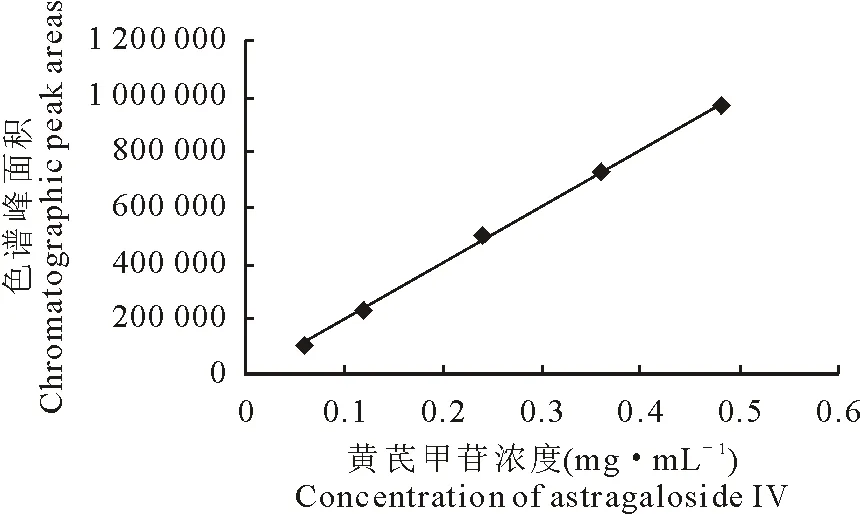
图2 黄芪甲苷标准曲线
2.3 精密度试验
黄芪甲苷标准品溶液,重复进针6次,测定的黄芪甲苷峰面积分别为700 587、683 752、712 945、694 757、705 461,RSD为1.58%,表明方法精密度符合要求。
2.4 稳定性试验
对黄芪甲苷标准品于不同时间点进针,测得峰面积分别为700 587、723 413、695 423、687 562、713 549,RSD为2.04%,结果表明,黄芪甲苷在10 h内稳定性良好。
2.5 加样回收率试验
由表1可以看出,该方法回收率高,稳定性强,平均回收率可达99.75%。
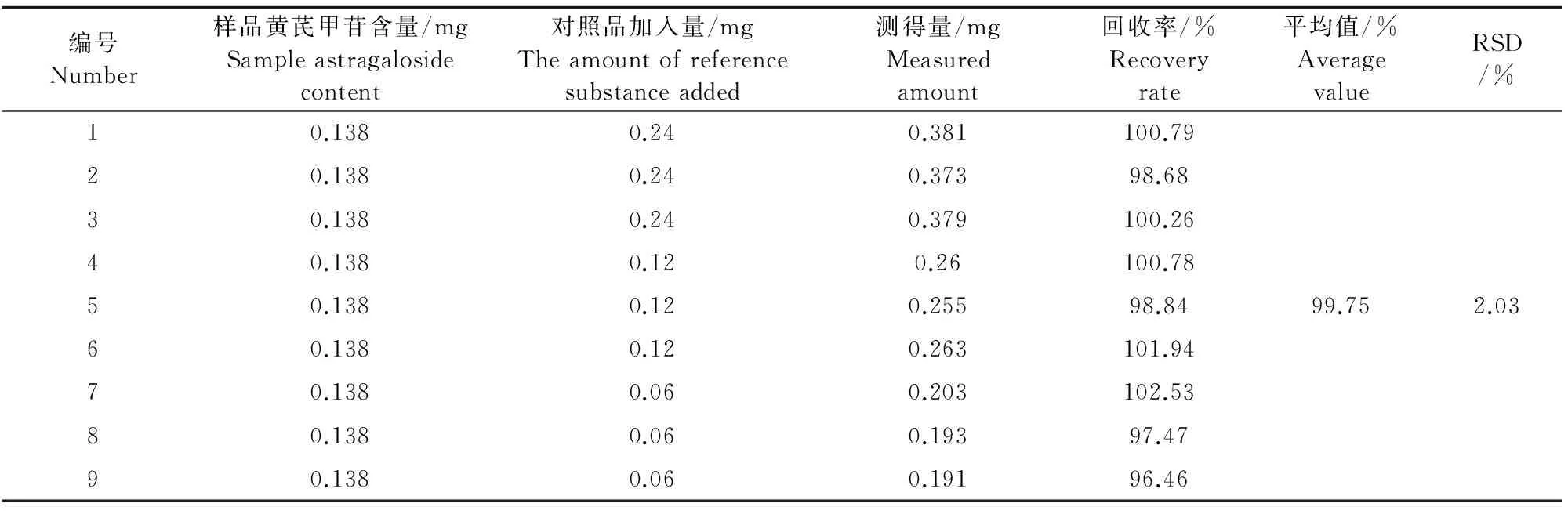
表1 回收率试验结果
2.6 样品含量测定
由表2可知,经37℃恒温培养72 h,黄芪发酵组与不接菌对照组黄芪甲苷质量分别为6.336 mg/g±0.002 1 mg/g和4.593 mg/g±0.002 5 mg/g,发酵组黄芪甲苷含量明显高于对照组,较对照组高37.95%。
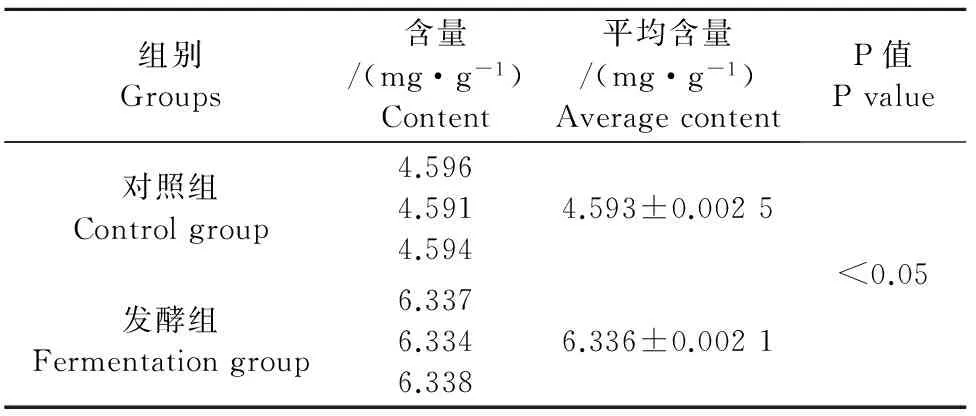
表2 发酵黄芪中总皂苷含量的变化
3 讨论
黄芪甲苷含量的检测方法有薄层色谱法、香草醛-比色法及高效液相色谱法等。已有报道中多采用薄层色谱法,且在2000版《中国药典》[4]及2000年版《中国兽药典》[5]均应用薄层色谱法检测黄芪甲苷含量,该方法能够提供图像用以直接观测并传达色谱结果,制备量大,成本低,速度快,但前处理步骤较多,人为影响因素大,排除干扰困难,准确度差,重现性不好[6]。香草醛-比色法所用试剂具有刺激性气味,腐蚀性强,操作人员需做好必要的防护。由于黄芪甲苷仅在波长200 nm处附近有末端吸收,因此,在《中华人民共和国药典》2010年版一部及2015年版一部[3,7]中均采用蒸发光散射器(HPLC-ELSD)对黄芪甲苷含量进行检测,但蒸发光散射器成本高,普及率低,还需要配置高压氮气或空气,且试验中还产生有害废气。紫外检测器为高相液相色谱的标准配置,不仅灵敏度高、噪音低、线性范围宽、有较好的选择性,且对环境温度、流动相组成变化和流速波动不太敏感,可等浓度洗脱,亦可梯度洗脱。因此,HLPC-UV法更易被广泛的应用于黄芪甲苷的质量检测。
对于HLPC-UV方法中检测波长和流动相的选择上,由于黄芪甲苷在近紫外区仅在200 nm左右有末端吸收,文献中多在200 nm~210 nm处选择检测波长,波长越长噪音越小,但灵敏度亦下降,常选用的波长为200、203、205 nm处,检测流动相多以乙腈-水,选取的浓度不尽相同[8-12]。通过对以往报道中的检测波长及浓度进行筛选,本文建立的HPLC-UV色谱检测条件采用了等浓度洗脱,流动相选择乙腈∶水(32∶68)、流速1.0 mL/min、检测波长为203 nm,试验证明,该条件下黄芪甲苷的峰形对称,尖锐,与样品本底有良好的分离,且该方法在0.06 mg/mL~0.48 mg/mL范围内线性关系良好,精密度及回收率高,稳定性好,适用于固态发酵黄芪中黄芪甲苷含量的检测。
本文应用分离的解淀粉芽胞杆菌对黄芪固体发酵72 h,经液相色谱法测定,黄芪甲苷质量分数较对照组提高了37.95%,这与许多学者的研究结果相一致。王士中[13]运用糙皮侧耳菌对黄芪进行发酵,经检测发现发酵后黄芪甲苷含量增加,但增加幅度不高,其推测是由于糙皮侧耳菌在发酵生产过程中产生的丰富酶系,如纤维素酶、半纤维素酶、漆酶及果胶酶等,对黄芪中木质纤维素、半纤维素、木质素及果胶等物质进行分解利用,将黄芪的活性成分充分释放,使黄芪甲苷含量增加。孙豪栋[14]通过筛选和诱变育种,获得可以将黄芪皂苷转化为黄芪甲苷的微生物菌株,以突变的伞枝犁头霉作为菌种,进行发酵处理,使黄芪甲苷产率从28.3%增加至31.1%,进一步优化培养条件,黄芪甲苷产率最高可达42.86%。马伟等[15]运用保加利亚乳酸杆菌发酵黄芪,其黄芪总皂苷质量分数显著升高,增长了22%。而郁帅陆等[16]运用灵芝液体种子液对黄芪固体培养基进行发酵,发现黄芪甲苷含量降低,其推测可能因高温灭菌,使连接苷元和多糖的多糖苷键部分断裂,并生成非极性皂苷元,而不能经极性较大的甲醇提取到,使检测结果降低。
由于发酵技术的影响因素是多方面的,受到发酵菌种、发酵成分及发酵条件等因素的影响,产生的活性物质也有所增加或减少,原因也各异,本试验仅对黄芪甲苷的含量变化进行了测定,而并未对其他成分变化进行检测。为探究引起成分增加的原因,笔者对本文分离得的解淀粉芽胞杆菌产纤维素酶性质进行了研究,发现该菌种具有产纤维素酶的能力。有报道指出纤维素酶可提高黄芪有效成分的释放[17],这可能是本试验发酵黄芪甲苷含量增加的原因之一。但本试验导致黄芪甲苷含量增加的原因,是解淀粉芽胞杆菌产纤维素酶分解细胞壁,使有效成分释放,或是由菌种将黄芪皂苷转化为黄芪甲苷,亦或是由非极性皂苷元转化为可溶于甲醇溶剂皂苷的结果,仍需进一步的试验和数据加以证实。
参考文献:
[1] 徐丽莉,袁久林.黄芪炮制历史沿革及现代研究思路[J].中华中医药学刊,2011,29(9):2071-2073.
[2] 徐荣芳,薛慧清,闫润红,等.黄芪药材的发酵研究进展[J].山西中药学院学报,2012,13(3):136-138.
[3] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化工业出版社,2015:302-303
[4] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化工业出版社,2000:249-250.
[5] 中国兽药典委员会.中华人民共和国兽药典(二部)[M].北京:化学工业出版社,2000:256-257.
[6] 邬成华.高效液相色谱-蒸发光散射检测法测定黄芪注射液中黄芪甲苷的含量[J].上海医药,2001,22(2):83-84.
[7] 国家药典委员会.中华人民共和国药典 一部[M].北京:化工业出版社,2010:283-284.
[8] 李欢欣,郝桂明,赵春杰,等.反相高效液相色谱法测定黄芪中黄芪甲苷的含量[J].中国药学杂志,2003,38(3):212 -213.
[9] 李 慧,钟慧文.RP-HPLC法测定益肝灵胶囊中黄芪甲苷的含量[J].中成药,2002,24(11):882-883.
[10] 郑志仁,宋纯清,刘 涤,等.RP-HPLC法测定黄芪毛状根中黄芪甲苷的含量[J].中草药,1999,30(2):98-99.
[11] 杨春欣,孙丽霞,许根英.薄层色谱-分光光度法测定黄芪粉针剂中黄芪甲苷的含量[J].中草药,2001,32(4):312-314.
[12] 胡芳弟,封士兰,赵健雄,等.HPLC法测定黄芪中黄酮类成分和黄芪甲苷的含量[J].分析测试技术与仪器,2003,9(3):173-177.
[13] 王士中.黄芪的糙皮侧耳发酵及其发酵液的药效研究[D].甘肃兰州:兰州大学,2008.
[14] 孙豪栋.黄芪总皂苷的微生物转化及其条件优化的研究[D].河南郑州:河南大学,2011.
[15] 马 伟,贾艳姝,刘秀波,等.药用植物黄芪乳酸发酵成[J].东北林业大学学报,2013,41(1):129-132.
[16] 郁帅陆,何 旬,陆利霞,等.黄芪固态发酵中有效成分的变化[J].食品与药品,2007,9(3):8-10.
[17] 郑立颖,魏彦明,陈 龙.纤维素酶在黄芪有效成分提取中的应用[J].甘肃农业大学学报,2005,40(1):94-96.

