Ⅰ群禽腺病毒4型陕西分离株33K、Fiber-1、Fiber-2、pⅢa基因的克隆及序列分析
冯 茹,高宇瑾,张梦荷,高 辉,张 豪,吕 涛,陈 成,杨彦涛,王承宝*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.西北农林科技大学生命科学学院,陕西杨凌 712100;3.陕西省杨凌区职业技术教育中心,陕西杨凌 712100)
禽腺病毒(Fowl adenovirus,FAV)属于禽腺病毒科禽腺病毒属,根据群特异性抗原的不同,可将其分为3群,即Ⅰ群、Ⅱ群和Ⅲ群[1]。其中,Ⅰ群禽腺病毒包括从鸡、火鸡、鹅及其他禽类分离的共12个血清型,能够与其他引起禽类呼吸道疾病的病原微生物共同作用于家禽,该病呈隐性感染,既可经排泄物水平传播,也可经卵垂直传播,污染鸡胚,代表株为鸡胚致死性孤儿病毒(Chicken embnyo lethal orphan,CELO)[2]。McFerran J B等[3]利用L1~L4这4个高变环的特点和RFLP技术把Ⅰ群禽腺病毒划分为A~E 5个基因型。
Ⅰ群禽腺病毒为线状双链DNA病毒[4],五邻体(Penton)、六邻体(Hexon)和纤维蛋白(Fiber)是病毒的3个主要结构蛋白,它们共同构成病毒核衣壳。其中,纤维蛋白主要通过识别宿主细胞上的特异受体而使病毒吸附结合在宿主细胞上,基因组中Fiber-1和Fiber-2基因表达的2个纤突蛋白与该病毒的毒力和免疫原性相关[5]。缺失Fiber-1基因后病毒依然能复制,但失去野生型病毒特有的特异性转导作用。Fiber-2基因对病毒增殖、组装及扩散的某个阶段是必须的,缺失该基因不能产生病毒粒子[6-7]。研究发现编码纤突蛋白的基因区与禽腺病毒的毒力和抗原性有关[8]。33K蛋白是FAV-Ⅰ的非结构蛋白,参与衣壳的形成过程[9],为空壳病毒粒子的组成成分,当病毒DNA进入衣壳时,33K蛋白开始被蛋白酶水解[10-11]。此外,pⅢa蛋白是病毒传染相关的剪接增强子,33K蛋白通过pⅢa充分激活腺病毒的剪切,启动蛋白质装配。pⅢa蛋白位于病毒衣壳的表面,由前体蛋白剪切后磷酸化而成,每个五邻体基底与5个pⅢa单体相连[12-13]。因此,本试验拟克隆陕西分离株的33K、Fiber-1、Fiber-2和pⅢa基因,并对序列进行分析,为研究其蛋白结构及在Ⅰ群禽腺病毒的诊断以及预防过程中发挥的作用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 病料来源与鸡胚 2017年从陕西省某疑似腺病毒感染的肉鸡场采集病料;SPF鸡胚购自北京梅里亚维通有限公司。
1.1.2 受菌体与载体 大肠埃希菌DH5α感受态细胞,北京博迈德生物技术有限公司产品;含有Hind Ⅲ、XbaⅠ酶切位点的pCold-SUMO载体,购自淼灵质粒平台。
1.1.3 主要试剂 限制性内切酶Hind Ⅲ和XbaⅠ,NEB生物公司产品;DNA连接酶、基因组DNA提取试剂盒、胶回收试剂盒、质粒纯化试剂盒、DNA Marker DL 5 000,宝生物工程(大连)有限公司产品;2×TaqPCR Master mix,天根生化科技有限公司产品。
1.2 方法
1.2.1 病毒的分离纯化及基因组DNA的提取 参照文献[14-15]介绍的方法,取发病鸡的肝脏组织处理后通过卵黄囊接种于10日龄SPF鸡胚,于37℃温箱孵育24 h后观察,剔除死胚,每天照蛋2次,温育至96 h以上,将无致死胚全部置于4℃,4 h后收获尿囊液。基因组的提取参照基因组DNA提取试剂盒说明书操作,于-20℃保存。
1.2.2 引物设计及PCR扩增 根据GenBank中公布的Ⅰ群禽腺病毒的基因序列,应用Primer Premier 5设计了如下所示的特异性引物,由北京奥科鼎盛生物科技有限公司杨凌实验室合成如下。
33K上游引物序列为TTCAAGCTTATGGCCCAGAGAATGGTC;下游引物序列为CTATCTAGACTAGCGTTGCGAGCCCTC;Fiber-1上游引物序列为TTCAAGCTTATGTCGGCCCTAATCGCC;下游引物序列为CTATCTAGATTAGGGGCCCGGAGCATT;Fiber-2上游引物序列为TTCAAGCTTATGCTCCGGGCCCCTAAA;下游引物序列为CTATCTAGATTACGGGAGGGAGGCCGC;pⅢa上游引物序列为TTCAAGCTTATGAGTTCGACTGAAGTC;下游引物序列为CTATCTAGATTAGTAAAAGCGTAGGCG。 下划线处是酶切位点,前者为Hind Ⅲ酶切位点,后者是XbaⅠ酶切位点,方便其扩增片段之后插入到pCold-SUMO质粒的Hind Ⅲ和XbaⅠ克隆位点,为后续进行蛋白的原核表达奠定一定的基础。
PCR扩增体系为50 μL,其中2×PCR Mix 25 μL,上、下游引物各1 μL,DNA 2 μL,加ddH2O补充至50 μL。反应按下列条件进行:94℃ 2 min; 94℃ 30 s,55℃ 30 s,72℃ 2 min,反应30个循环;最后72℃ 2 min,同时设立阴性对照。PCR产物经10 g/L琼脂糖凝胶电泳检测。
1.2.3 目的片段的克隆与鉴定 FAV-Ⅰ基因的PCR产物经10 g/L琼脂糖凝胶电泳鉴定后,按胶回
收试剂盒使用说明回收纯化目的条带,用限制性内切酶Hind Ⅲ和XbaⅠ对PCR产物和pCold-SUMO载体双酶切后回收酶切产物,用连接酶于16℃连接30 min,将连接产物转化至大肠埃希菌DH5α感受态细胞后,加入LB液体培养基于37℃摇床振荡培养1 h后,涂布到含氨苄抗生素(Amp)的LB琼脂平板37℃过夜培养,筛选白色菌落进行挑菌,接种于3 mL含有Amp的LB液体培养基中,37℃震荡培养过夜后,用质粒提取试剂盒提纯重组质粒并进行酶切鉴定。
1.2.4 重组质粒序列测定及分析 将所获得的阳性重组质粒送华大基因公司测序。将测序结果经NCBI的数据库进行BLAST分析。从GenBank中下载Ⅰ群禽腺病毒相关毒株的基因序列:FAV-2:685(KT862805.1);FAV-3:SR49(KT862807.1);FAV-4:CH/HNJZ/2015(KU558760.1),CH/SDDZ/2015(KU558761.1),CH/SXCZ/2015(KU558762.1),CH/AHBZ/2015(KU569295.1),CH/JSXZ/2015(KU569296.1),HLJFAd15(KU991797.1),HLJDAd(KX538980.1),B1-7(KU342001.1);FAV-5:340(NC-021221.1);FAV-8a:TR59(KT862810.1);FAV-8b:764(KT862811.1);FAV-9:A-2A(AF083975.2);FAV-11:380(KT862812.1),HEV(AF074946.1),EDSV(Y09598.1),应用DNA Star和MEGA7.0软件以Clustal W方法进行同源性和遗传进化分析。
2 结果
2.1 FAV-Ⅰ33K、Fiber-1、Fiber-2、pⅢa蛋白基因的PCR扩增
以陕西分离株基因组DNA为模版,PCR扩增基因序列,经浓度为10 g/L的琼脂糖凝胶电泳鉴定。结果如图1所示,可见33K、Fiber-1、Fiber-2、pⅢa分别约为590、1 300、1 400、1 800 bp的条带,与预期的片段大小相符。
2.2 重组质粒的酶切鉴定
将回收的蛋白基因片段、pCold-SUMO载体双酶切后连接,转化大肠埃希菌DH5α感受态细胞,通过Hind Ⅲ、XbaⅠ双酶切鉴定重组质粒,经浓度为10 g/L琼脂糖凝胶电泳鉴定,结果如图2所示,从重组质粒中切出空载体pCold-SUMO 4 700 bp和目的片段,与预期结果相符,说明成功构建了重组质粒。

M.DNA标准DL 5 000;1. 33K;2.Fiber-1;3.Fiber-2;4. pⅢa;5.阴性对照
M.DNA Marker DL 5 000; 1. 33K; 2.Fiber-1; 3.Fiber-2; 4. pⅢa; 5.Negative control
图1 FAV-Ⅰ33K、Fiber-1、Fiber-2和pⅢa基因的PCR结果
Fig.1 PCR amplification result of FAV-Ⅰ 33K,Fiber-1,Fiber-2 and pⅢa genes

M.DNA标准DL 5 000;1.pCold-SUMO-33K双酶切; 2.pCold-SUMO-Fiber-1双酶切; 3.pCold-SUMO-Fiber-2双酶切; 4.pCold-SUMO-pⅢa双酶切
M.DNA Marker DL 5 000; 1.pCold-SUMO-33K digested withHind Ⅲ andXbaⅠ; 2.pCold-SUMO-Fiber-1 digested withHind Ⅲ andXbaⅠ; 3.pCold-SUMO-Fiber-2 digested withHind Ⅲ andXbaⅠ; 4.pCold-SUMO-pⅢa digested withHind Ⅲ andXbaⅠ
图2重组质粒的酶切鉴定
Fig.2 Identification of recombinant plasmid digested withHind Ⅲ andXbaⅠ
2.3 基因序列分析
对重组质粒进行序列分析表明获得了含上述蛋白基因的克隆,将序列提交至GenBank,登录号分别为33K(MF595802)、Fiber-1(MF595801)、Fiber-2(MF595799)、pⅢa(MF595800)。用DNA Star和BLAST软件将测得的基因核苷酸序列及推导的氨基酸序列与GenBank中收录的国内外FAV-4核苷酸及氨基酸序列进行同源性比对,分析可得所克隆的33K基因长585 bp,共编码194个氨基酸,与国内外FAV-4对照毒株的同源性相比,其核苷酸同源性为99.3%~100%,氨基酸同源性为91.5%~100%;Fiber-1基因长1 296 bp,共编码431个氨基酸,其核苷酸同源性为98.5%~100%,氨基酸同源性为65.9%~100%;Fiber-2基因长1 440 bp,共编码479个氨基酸,其核苷酸同源性为98.1%~100%,氨基酸同源性为99.3%~100%;pⅢa基因长1 773 bp,共编码590个氨基酸,其核苷酸同源性为98.6%~100%,氨基酸同源性为98.5%~100%,具体见表1~表4。用MEGA7.0绘制系统进化树,遗传进化分析显示(图3~图6),陕西分离株与Ⅰ群禽腺病毒亲缘关系较近,特别是与血清4型的禽腺病毒更接近,与血清2型、3型、5型、8型、9型和11型相对较远,结果显示,陕西分离株确为Ⅰ群禽腺病毒血清4型。

图3 33K序列的进化分析
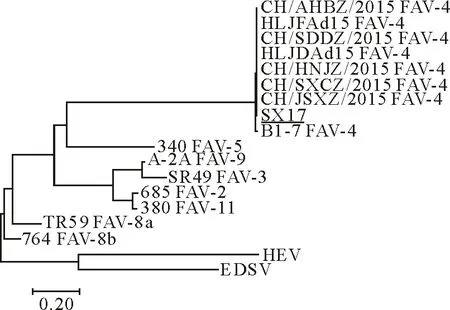
图4 Fiber-1序列的进化分析
3 讨论
禽心包积液-包涵体肝炎综合征(Hydropericardium syndrome-inclusion body hepatitis,HPS-IBH)是主要由禽腺病毒4型(Fowl adenovirus-4,FAV-4)引起的一种高传染性和高死亡率的新型家禽疾病。2015年6月以来,我国多数省份的鸡群发生该病,主要流行C和E两种基因型,4和8b两种血清型。该病的发病特征为3周龄~5周龄鸡突然死亡,病死率高达80%[16-18]。没有明显的临床症状,个别鸡在死亡前出现精神沉郁、羽毛卷曲等临床表现。病死鸡的剖检病变主要为心包腔中蓄积有大量的淡黄色水样或胶状液体,心脏松弛,肝脏充血、肿大。近年来,随着家禽养殖规模的逐渐扩大,由FAV-4引起的心包积液-包涵体肝炎综合征等,给养禽业造成了巨大的经济损失[19-20]。

图5 Fiber-2序列的进化分析

图6 pⅢa序列的进化分析
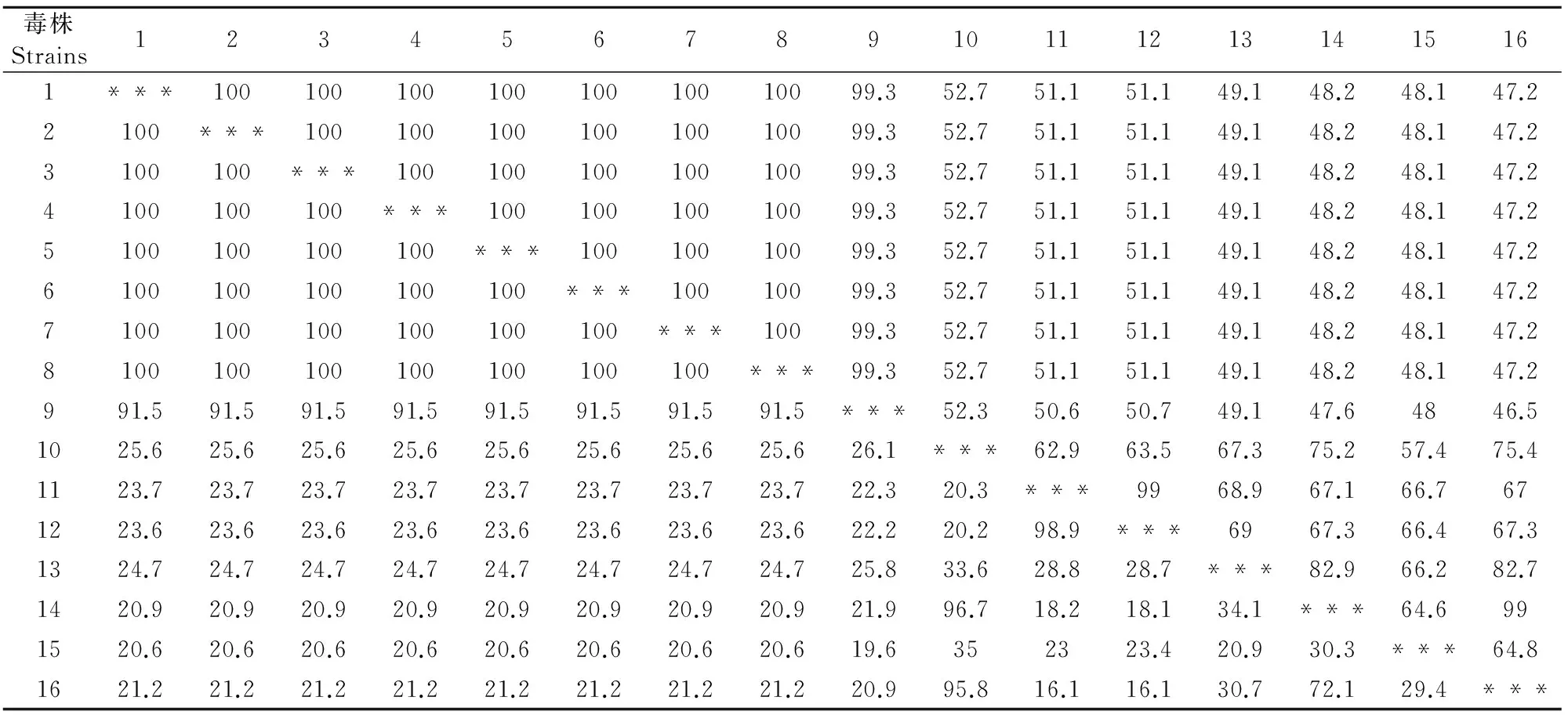
毒株Strains123456789101112131415161***10010010010010010010099.352.751.151.149.148.248.147.22100***10010010010010010099.352.751.151.149.148.248.147.23100100***10010010010010099.352.751.151.149.148.248.147.24100100100***10010010010099.352.751.151.149.148.248.147.25100100100100***10010010099.352.751.151.149.148.248.147.26100100100100100***10010099.352.751.151.149.148.248.147.27100100100100100100***10099.352.751.151.149.148.248.147.28100100100100100100100***99.352.751.151.149.148.248.147.2991.591.591.591.591.591.591.591.5***52.350.650.749.147.64846.51025.625.625.625.625.625.625.625.626.1***62.963.567.375.257.475.41123.723.723.723.723.723.723.723.722.320.3***9968.967.166.7671223.623.623.623.623.623.623.623.622.220.298.9***6967.366.467.31324.724.724.724.724.724.724.724.725.833.628.828.7***82.966.282.71420.920.920.920.920.920.920.920.921.996.718.218.134.1***64.6991520.620.620.620.620.620.620.620.619.6352323.420.930.3***64.81621.221.221.221.221.221.221.221.220.995.816.116.130.772.129.4***
注:右上为核苷酸同源性,左下为氨基酸同源性;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.380;11.764;12.TR59;13.SR49;14.685;15.340;16.A-2A。
Note:The nucleic acids were showed in the right upper,amino acids in the left lower;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.380;11.764;12.TR59;13.SR49;14.685;15.340;16.A-2A.
尽管FAV感染在国内鸡场十分普遍,但我国对该病的研究还相对薄弱。本研究通过基因克隆技术,构建了4个重组质粒,成功克隆33K、Fiber-1、Fiber-2和pⅢa基因,并对其序列进行分析,序列分析发现所克隆序列与Ⅰ群腺病毒中血清4型同源性最高,为98%~100%,与其他血清型同源性较低,33K、Fiber-1、Fiber-2、pⅢa基因与其他血清型同源性分别为47.2%~52.7%、29.8%~44.3%、32.4%~52.7%、33.9%~70.8%。从基因遗传进化树上看,4个基因均与Ⅰ群禽腺病毒亲缘关系最近,特别与血清4型最接近,而与Ⅱ群、Ⅲ群FAV亲缘关系较远,属于不同的进化支。综上分析表明,陕西分离株归属于Ⅰ群禽腺病毒血清4型,对进一步研究该病在陕西的流行和防治等具有重要意义。依据基因的特异性及其在宿主免疫反应中的作用,本研究在获得相关目的基因的同时,将相关基因克隆入pCold-SUMO原核表达载体用于后期的蛋白表达和纯化,选用的pCold-SUMO表达载体带有SUMO标签,可实现蛋白在E.coli中的高效可溶性表达,后期的研究成果也为FAV-4病毒感染的诊断和蛋白功能分析等奠定了基础。
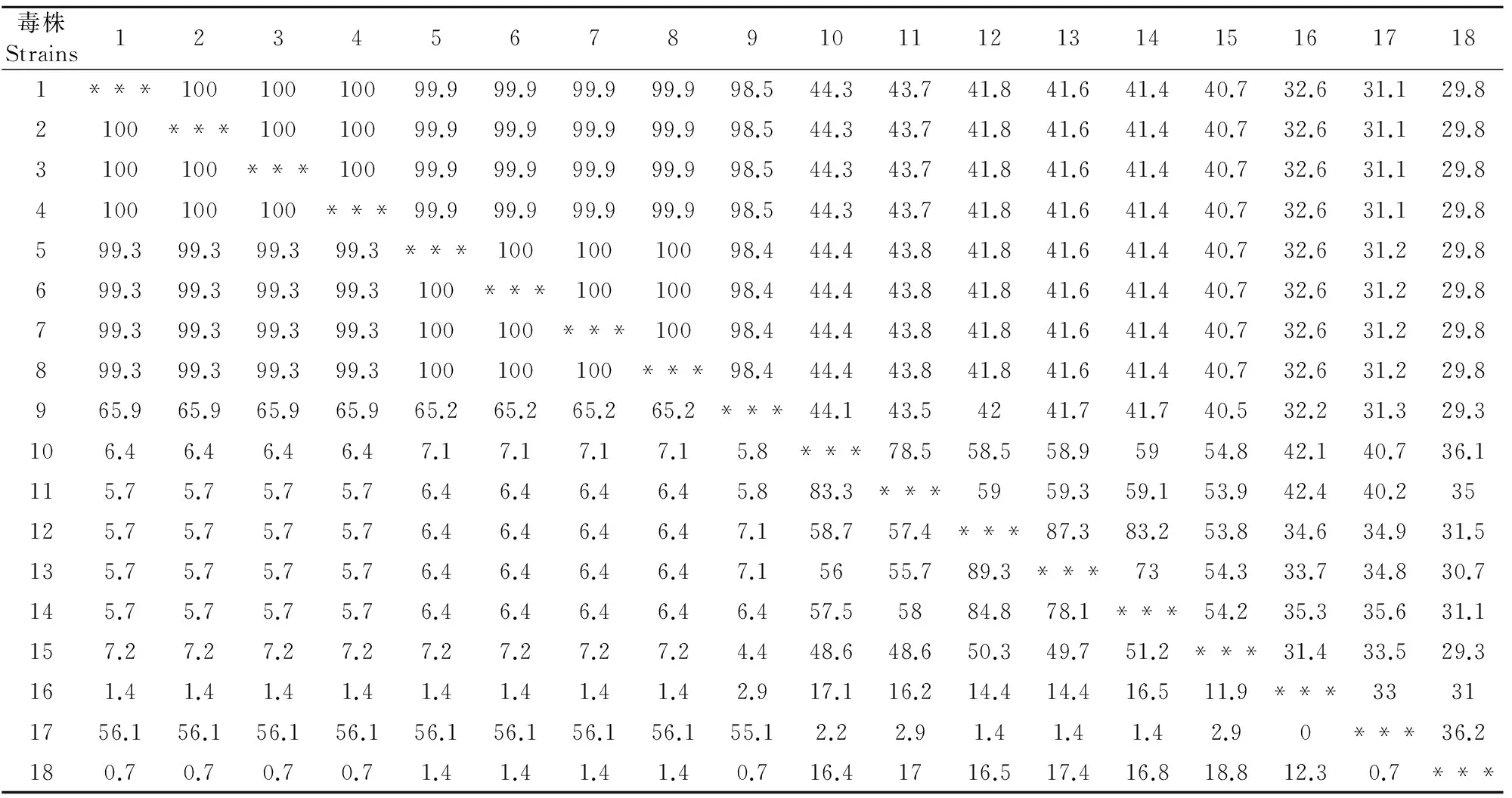
表2 Fiber-1基因核苷酸与推导的氨基酸序列同源性比较结果
注:右上为核苷酸同源性,左下为氨基酸同源性;1.SX17;2.CH/HNJZ/2015;3.CH/SXCZ/2015;4.CH/JSXZ/2015;5.CH/SDDZ/2015;6.CH/AHBZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.A-2A;13.SR49;14.380;15.340;16.685;17.HEV;18.EDSV。
Note:The nucleic acids were showed in the right upper,amino acids in the left lower;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.380;13.A-2A;14.SR49;15.340;16.685;17.HEV;18.EDSV.
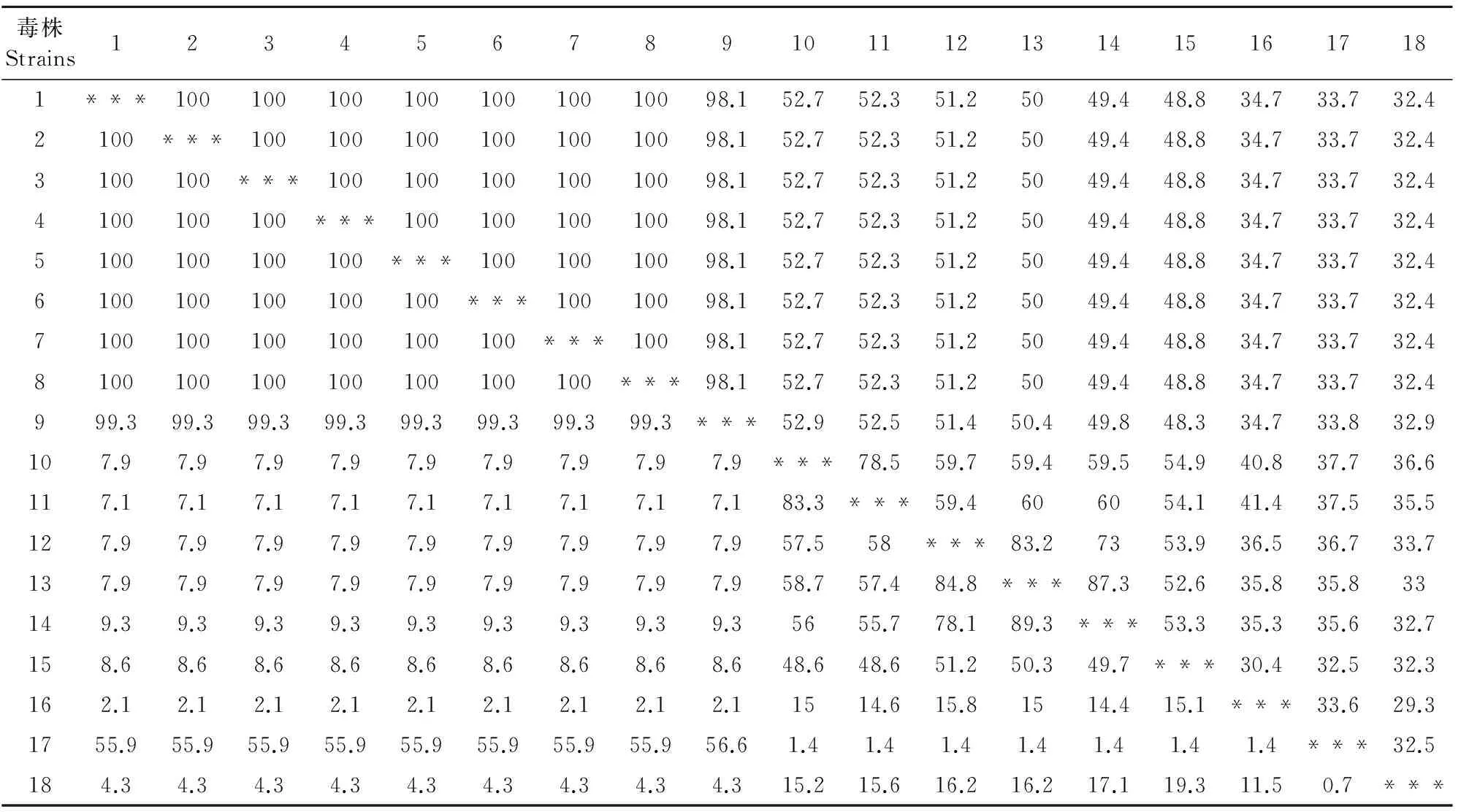
表3 Fiber-2基因核苷酸与推导的氨基酸序列同源性比较结果
注:右上为核苷酸同源性,左下为氨基酸同源性;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.380;13.A-2A;14.SR49;15.340;16.685;17.HEV;18.EDSV。
Note:The nucleic acids were showed in the right upper,amino acids in the left lower;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.380;13.A-2A;14.SR49;15.340;16.685;17.HEV;18.EDSV.

表4 pⅢa基因核苷酸与推导的氨基酸序列同源性比较结果
注:右上为核苷酸同源性,左下为氨基酸同源性;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.340;13.SR49;14.685;15.380;16.HEV;17.EDSV;18.A-2A。
Note:The nucleic acids were showed in the right upper,amino acids in the left lower;1.SX17;2.CH/HNJZ/2015;3.CH/SDDZ/2015;4.CH/SXCZ/2015;5.CH/AHBZ/2015;6.CH/JSXZ/2015;7.HLJFAd15;8.HLJDAd15;9.B1-7;10.764;11.TR59;12.340;13.SR49;14.685;15.380;16.HEV;17.EDSV;18.A-2A.
参考文献:
[1] Monreal G.Poultry science reviews[M].Northants: Science Reviews 2000 Ltd, 1992,4:1-27.
[2] 罗思思,谢芝勋,邓显文,等.Ⅰ群禽腺病毒五邻体基因的克隆及原核表达[J].广东农业科学,2011,38(7):154-157.
[3] McFerran J B,Connor T J,Adair B M.Studies on the antigenic relationship between and isolate (127) from the egg drop syndrome 1976 and a fowl adenovirus[J].Avian Pathol J,1978,7(4):629-636.
[4] 张明明,秦爱建,庄骁颖,等.CAG和MLP启动子控制的重组禽腺病毒构建[J].畜牧与兽医,2010,42(3):23-27.
[5] Fessler S P,Young C S H.The role of the L4 33K gene in adenovirus infection[J].Virology,1999,263(2):507-516.
[6] Gelderblom H,Maichlelauppe I.The fibers of fowl adenoviruses[J].Arch Virol,1982,72(4):289-298.
[7] Morin N,Boulanger P.Morphogenesis of human adenovirus type 2:sequence of entry of proteins into previral and viral particles[J].Virology,1984,136(1):153-167.
[8] Jackie P,Wright P J,Sheppard M.A single gene encoding the fiber is responsible for variations in virulence in the fowl adenoviruses[J].J Virol,1996,70(8):5115-5122.
[9] 李茂祥,李红卫,殷震,等.减蛋综合征病毒33K蛋白基因克隆及结构分析[J].中国兽医学报,1999,19(3):221-225.
[10] 文艳玲,谢芝勋,黄 琦,等.禽腺病毒1型和4型六邻体蛋白抗原表位和密码子偏爱性分析[J].动物医学进展,2007,28 (11):17-20.
[11] Farley D C,Brown J L,Leppard K N.Activation of the early-late switch in adenovirus type 5 major late transcription unit expression by L4 gene products[J].J Virol,2004,78(4):1782-1791.
[12] 武 敏.Ⅰ群禽腺病毒JS株Ⅲa蛋白的原核表达及其单克隆抗体的制备[D].江苏扬州:扬州大学,2009.
[13] Kim J N,Byun S H,Kim M J,et al.Outbreaks of hydropericardium syndrome and molecular characterization of Korean fowl adenoviral isolates[J].Avian Dis,2008,52(3):526-530.
[14] Zhao J,Zhong Q,Zhang G Z,et al.Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J].PLoS One,2015,10(7):e0133073.
[15] Li L,Luo L,Wen G,et al.Genome sequence of a fowl adenovirus serotype 4 strain lethal to chickens,isolated from China[J].Genome Announce,2016 ,4(2):e00140-16.
[16] Asthana M,Chandra R,Kumar R.Hydropericardium syndrome:current state and future developments[J].Arch Virol,2013,158(5):921-931.
[17] 袁万哲,李玉保,王建昌,等.鸡心包积液-肝炎综合征的初步研究[J].中国兽医科学,2016,46(2):157-160.
[18] 袁万哲.科学防控鸡心包积液-肝炎综合征[J].中国动物保健,2016,18(2):35-35.
[19] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[20] Tan P K,Bergelson J C M,Michou A I,et al.Defining CAR as a cellular receptor for the avian adenovirus CELO using a genetia analysis of the two viral fiber proteins[J].J Gen Virol,2001,82(6):1465-1472.

