猪伪狂犬病病毒和猪繁殖与呼吸综合征病毒抗体同步检测的液相芯片技术
肖 丽,丛 锋,刘向楠,李秀珍,饶 丹,练月晓,黄碧洪,张 钰,黄 韧,郭鹏举,陈梅丽
( 广东省实验动物监测所/广东省实验动物重点实验室,广东广州 510663)
伪狂犬病病毒(Pseudorabies virus,PRV)属于α疱疹病毒属,猪是伪狂犬病病毒的天然宿主、 贮存者和传播者[1-2]。感染猪的临床症状及病死率主要取决于宿主的年龄和所涉及的病毒株的毒力,是危害养猪业的重大传染病之一。而猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)为动脉炎病毒属,能使猪发生繁殖和呼吸障碍有关的传染性疾病。该病毒首先在1987年发现于美国。从2006年起,我国国内开始暴发高致病性猪繁殖与呼吸综合征,并引起大量猪死亡[3-4]。 液相芯片技术是一项新的快速高通量检测技术,该技术集流式细胞技术、荧光编码微球、激光、数字信号处理和传统的生化技术于一体,是一种多功能的分析平台[5-6]。因此,不断探索出更快更好的针对这两种病原抗体的检测方法,有重要的实际意义。
本文拟建立一种利用液相芯片技术同步检测猪伪狂犬病病毒抗体和猪繁殖与呼吸综合征病毒抗体的方法,所用蛋白抗原均来自于原核表达的蛋白,分别是PRRSV N蛋白和PRV gE蛋白,所建立的双重检测PRRSV和PRV抗体液相芯片方法,可以应用于猪病临床检测和流行病学调查等。
1 材料与方法
1.1 材料
PRV gE蛋白和PRRSV N蛋白,本实验室表达和纯化,并于-20℃保存;荧光磁性纳米微球、微球偶联试剂盒,美国Luminex公司产品;生物素标记的羊抗猪二抗,北京索莱宝科技有限公司产品;藻红蛋白标记的链霉亲和素(SAPE),Invitrogen公司产品;稀释液和洗液均为PBS+10 g/L BSA;16份健康猪血清及临床血清由华南农业大学动物科技学院马静云教授惠赠;PRV gE蛋白ELISA检测试剂盒,CIVtest公司和INgezim公司产品;PRRSV ELISA试剂盒,INgezim公司和BIOCHEK公司产品。
1.2 方法
1.2.1 抗原偶联微球 按照微球偶联试剂盒说明书进行。在相同微球数量下,通过偶联不同蛋白抗原量,来优化蛋白抗原偶联微球量。
1.2.2 抗原偶联微球效果验证 微球稀释成50个/μL,50 μL/孔加入96孔板,设置3个重复;阳性血清与阴性血清分别按1∶25~1∶3 200稀释,50 μL/孔,以稀释液为空白对照,混匀后室温振摇1 h;洗液洗3遍,然后加入稀释成1∶1 000的生物素标记的羊抗猪二抗50 μL/孔,室温振摇30 min;洗涤3遍后,加入1∶100稀释的SAPE 50 μL/孔,室温振摇30 min;洗3遍后加入50 μL/孔洗液,上机读MFI值。有效判定标准:当平均荧光强度(mean fluorescence intensity,MFI)的阳性与阴性比值大于3,且空白对照小于300,说明该蛋白偶联微球有效。
1.2.3 单一液相芯片检测 操作方法同1.2.2。唯一区别就是将不同稀释度下的相同血清样品换成一定稀释度下的不同血清样品。
1.2.4 特异性验证 检测两个蛋白抗原偶联的微球与其他猪病病原,包括猪圆环病毒2型(Porcine circovirus Ⅱ,PCV2)、猪瘟病毒(Classical swine fever virus,CSFV)、猪细小病毒(Porcine parvovirus,PPV))的血清样品之间有无交叉反应;具体操作方法同 1.2.2。同时,这2个病原之间有无交叉反应也要进行验证,具体操作方法也同 1.2.2。之所以选择猪病的这3种病原(PCV2、CSFV、PPV)进行特异性试验,是因为这3种病原和PRRSV及PRV都属于猪的免疫抑制病病原,临床症状相似,在猪病病原检测中进行相互区分很有必要。
1.2.5 单一液相芯片法的抗体检测和ELISA试剂盒灵敏度对比 将相同血清按2倍比稀释,分别进行相应液相芯片法检测和ELISA试剂盒检测。对比两种方法的阳性检出对应的最大稀释度。血清稀释度最小从1∶25开始,液相芯片法稀释液为PBS+10 g/L BSA,而ELISA试剂盒的稀释液使用ELISA试剂盒配备的样品稀释液。
1.2.6 双重液相芯片法的抗体检测及样品检测 在检测稀释液(PBS+10 g/L BSA)中分别将两种微球稀释成50个/μL;每孔加入50 μL,使两种微球每孔均为2 500个;之后操作同1.2.2。样品检测试验中,样品来源于其他实验室赠送。
1.2.7 阳性判定标准 对16份健康猪血清同时进行猪伪狂犬病病毒和猪繁殖与呼吸综合征病毒抗体的液相芯片法检测。将这16份猪健康血清按1∶800稀释,之后具体操作方法同1.2.2。然后分别将读取的MFI值的平均值加上3倍标准差之和作为判定阈值,若样品血清的MFI值大于判定阈值,则该样品判定为阳性,若样品血清的MFI值小于判定阈值,则该样品判定为阴性。
2 结果
2.1 蛋白抗原偶联微球量优化
每2.5×105个微球偶联PRV GE蛋白2.5、5.0、10.0、20.0 μg,检测不同蛋白抗原偶联微球量对MFI值影响(同一份血清,稀释度均为1∶25),检测方法按照1.2.2进行(图1)。结果表明,在相同检测条件下, 每2.5×105个微球偶联PRV GE蛋白2.5 μg时,MFI值已经最大,所以PRV GE蛋白的最佳蛋白抗原偶联微球量为2.5 μg。同样,按每2.5×105个微球偶联 PRRSV N蛋白0.8、2.0、8.0、15.0 μg,检测方法按照1.2.2进行,每个偶联量对应的检测血清稀释度为1∶25(在此试验中所用的PRRSV阳性样品来自临床ELSIA阳性,且为同一份血清样品),验证不同蛋白抗原偶联微球量对MFI值的影响(图2)。结果表明,PRRSV N蛋白的最佳蛋白抗原偶联微球量为8.0 μg。

图1 PRV GE蛋白最佳偶联量优化

图2 PRRSV N蛋白最佳偶联量优化
2.2 判定阈值的确定及特异性试验结果
16份阴性猪血清1∶800稀释(因为血清在1∶800稀释时的P/N值最大,即阳性血清与阴性血清区分最明显)检测相应两个抗原的MFI值,并计算各自的判定阈值,计算公式为MFI值平均值加上3个标准差,计算得出判定阈值分别为:PRV 1 281.0 和PRRSV 727.12,样品MFI值大于各自的阈值判定为阳性;特异性试验检测结果显示,与其他几种猪病病原(CSFV、 PCV、PPV)的阳性血清无交叉反应,且两种病原之间,相互也无交叉反应(图3)。

图3 液相芯片检测PRV和PRRSV血清的特异性
2.3 单一体系X-MAP法与ELISA的灵敏度比较
分别就同一份阳性血清按照2倍比梯度稀释,分别进行X-MAP法及ELISA检测,比较最大检出稀释倍数(图4和表1)。 结果表明,检出PRV抗体的X-MAP稀释倍数是相应ELISA的66倍,而检出PRRSV抗体的X-MAP稀释倍数是相应ELISA的32倍。
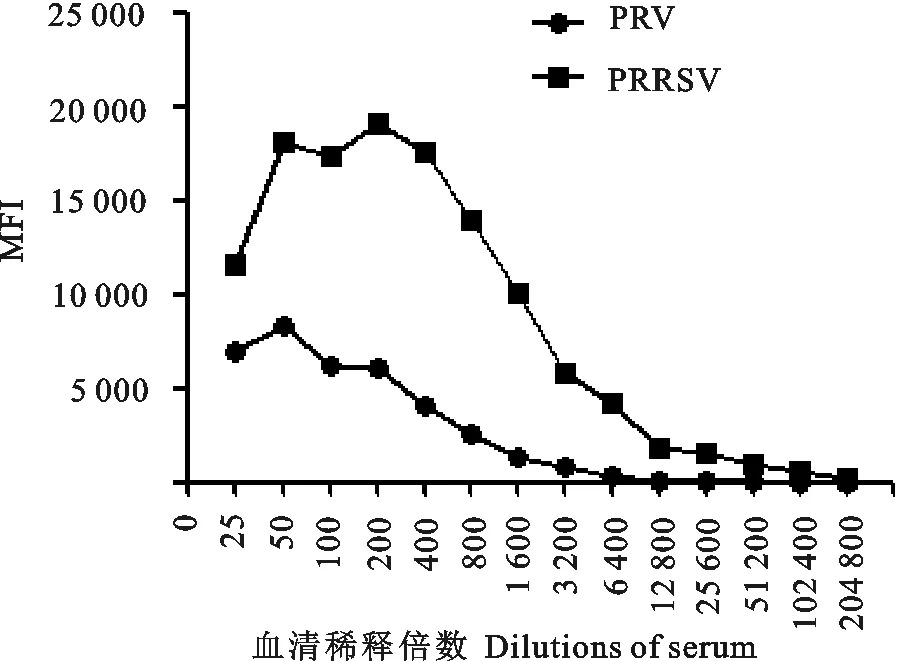
图4 液相芯片检测PRRSV和PRV抗体的灵敏度

血清Serum最低检测限LowestdetectablelimitELISA液相芯片分析系统LuminexPRV<1/1001/3200PRRSV8001/52800
2.4 液相芯片技术同步检测猪血清样本中PRRSV抗体和PRV抗体
利用双重X-MAP法检测同步检测50份猪临床血清。在50份猪血清样品中,用ELISA试剂盒检测出PRRSV抗体阳性样品41个,阴性样品9个。41个ELISA阳性样品中,X-MAP检测也均为阳性;而9个ELISA阴性样品中有2个X-MAP阳性,这也证明了X-MAP法比ELISA法灵敏度更高。另外,还用了另一商品化的ELISA试剂盒对样品复检,结果发现,前ELISA阳性样品仍然为阳性,而9份前ELISA阴性样品中检出5份阳性,说明后一品牌的ELISA试剂盒(INgeZim)灵敏度更高。同样,在这50份猪血清样品中用ELISA检测出PRV抗体阳性样品为7个,阴性样品43个;并且在7个ELISA阳性样品中,X-MAP阳性只有3个,这可能是因为阳性样品基数太少导致的误差,也可能与ELISA试剂盒的检测误差有关;在43个阴性样品中,X-MAP阳性21个,阴性22个,这说明X-MAP法的灵敏度比ELISA法高66倍的试验结果是成立的。因为在用X-MAP法检测PRV抗体中,7个ELISA阳性样品中,X-MAP阳性只有3个,所以为了判断是否是ELISA试剂盒的检测误差导致的,本研究还用了不同品牌的商品化ELISA试剂盒(CIVtest)来复检。结果发现,两个商品化ELISA试剂盒的符合率40/50,符合率中等,其中7份前ELISA阳性样品中只检出1个阳性,而43份前ELISA阴性样品中检出4份阳性,综上所述,两个ELISA试剂盒对比不明显。但是如果把两种ELISA结果矛盾的10份样品去掉,剩下的40个样品中有1个ELISA阳性样品,且X-MAP法检测也为阳性。在其余39份ELISA阴性样品中,X-MAP检测出21份阳性,18份阴性,也说明X-MAP法的灵敏度比ELISA高。
3 讨论
目前,PRRSV抗体和PRV抗体检测技术包括血清中和试验(serum neutralization test,SN)、免疫过氧化物酶单层试验、酶联免疫吸附试验 (enzyme-linked immunosorbent assay,ELISA)等,其中ELISA被广泛应用[7-9]。但是ELISA不能同步检测多种病原,且特异性不强,而液相芯片技术作为一种新的用于检测病原抗体的技术,优点主要是可以同时检测多种病原抗体,成本相对较低,而且快速和同步检测多个样品。
在本研究中,相同X-MAP法检测条件下,确定了各自的最佳蛋白抗原偶联微球量,分别为PRRSV N蛋白8.0 μg、PRV GE蛋白2.5 μg。针对该液相芯片技术,还进行了二抗-Biotin浓度对MFI值影响的探索。结果证明,当二抗-Biotin浓度范围在4.0 μg/mL~0.5 μg/mL时,对P/N值的影响不显著,但是对MFI值影响显著,MFI值随着二抗-Biotin浓度的增加而增加,当二抗-Biotin浓度从1.0 μg/mL上升到2.0 μg/mL时,MFI值显著增加。基于此,本研究常使用折中的2.0 μg/mL的二抗浓度作为工作浓度,既保证了MFI值的相对较高,也对P/N值影响不显著,也降低二抗-Biotin的用量,节约成本。同理,当二抗-Biotin浓度定为2.0 μg/mL时,SAPE浓度的变化对MFI值影响不显著,但对P/N值影响较大。当SAPE浓度为2.5 μg/mL时,P/N值最大。所以,本研究中将SAPE浓度定为2.5 μg/mL。另外,与ELISA灵敏度比较发现, PRRSV的X-MAP血清稀释倍数是相应ELISA的32倍,而PRV的X-MAP稀释度是相应ELISA法的66倍。由此可见,X-MAP的灵敏度远比ELISA高。而且特异性检测结果显示,与猪其他几种病原的抗体无交叉反应。
综上所述,利用液相芯片技术同步检测猪伪狂犬病病毒抗体和猪繁殖与呼吸综合征病毒抗体的方法具有良好的应用价值。
参考文献:
[1] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:700-713.
[2] 斯特劳B E,阿莱尔S D,蒙加林W L,等.猪病学[M].8版.北京:中国农业大学出版社,2000:195-196.
[3] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[4] Zhou L,Yang H.Porcine reproductive and respiratory syndrome in China[J].Virus Res,2010,154:31-37.
[5] Croft H,Malinowski T,Krizbai L,et al.Use of luminex MAP derived Bio-Plex bead-based suspension array for specific detection of PPVW and characterization of epitopes on the coat protein of the virus[J].J Virol Methods,2008,153(2):203-213.
[6] Ray C A,Bowsher R R,Smith W C,et al.Development validatin and implementtation of a multiplex immunoassay for the simultaneous determinatin of five cytokines in human serum[J].J Pharm Biomed Anal,2005,36(5):1037-1044.
[7] Chai Z,Ma W,Fu F,et al.A SYBR Green-based real-time RT-PCR assay for simple and rapid detection and differentiation of highly pathogenic and classical type 2 porcine reproductive and respiratory syndrome virus circulating in China[J].Arch Virol, 2013,158(2):407-415.
[8] 官家明,施开创,陈汉忠,等.猪繁殖与呼吸综合征病毒检测技术研究进展[J].动物医学进展,2013,34(8):88-92.
[9] 王莉娟,陆明哲,陈义平,等.伪狂犬病检测技术研究进展[J].中国畜牧兽医,2005(6):42-44.

