TMEM38B纯合突变导致罕见ⅪⅤ型成骨不全症
吕 芳,徐晓杰,高 鹏,宋玉文,夏维波,邢小平,李 梅*
(中国医学科学院 北京协和医学院 北京协和医院 1.内分泌科 卫生部内分泌重点实验室;2.骨科, 北京 100730)
成骨不全症(osteogenesis imperfecta,OI)是一组临床表型和基因型具有明显异质性的罕见结缔组织病,其发病率为1/10 000~20 000,主要临床表型包括骨骼脆性增高、反复骨折和骨骼畸形,骨骼外表现包括蓝巩膜、牙本质发育不全和听力异常等[1]。
目前已发现至少19种致病基因(http://www.le.ac.uk/ge/collagen/),其中85%~90%由 Ⅰ型胶原编码基因COL1A1和COL1A2突变所致,呈常染色体显性遗传,其他基因突变通过影响Ⅰ型胶原合成、翻译后修饰、折叠、胶原交联、骨骼矿化或成骨细胞分化,导致OI[1]。
1 材料与方法
1.1 对象
患者,男,2岁9月,维吾尔族人,因“反复骨折1年9月”,于2016年就诊于北京协和医院内分泌科。患者为第1胎第1产,母亲孕期平顺,足月顺产,出生体重2.7 kg,身长不详。患者1岁学习走路时出现右胫骨骨折,此后轻微外力下再骨折3次,分别为左胫骨和双股骨骨折,均行外固定治疗。既往史无殊。家族史:父母为近亲婚配(图1),体健,否认骨折家族史。查体:身高83 cm(小于同性别和同年龄儿童-3SD),体质量12 kg(位于同性别和同年龄儿童-1SD到中位数),未见牙本质发育不全,巩膜稍蓝,粗侧听力正常。双下肢呈膝内翻畸形,四肢关节韧带无松弛。无脊柱侧突和后突畸形,胸廓无畸形。
本研究获北京协和医院科研伦理委员会批准,在研究开始前征得患者父母同意并签署知情同意书。
1.2 方法
1.2.1 临床表型评估:在北京协和医院检验科采用常规方法检测血清钙、磷、总碱性磷酸酶、丙氨酸氨基转移酶和肌酐;采用罗氏电化学发光法检测β-胶原降解产物、25羟维生素D和全段甲状旁腺素。在放射科完成头颅及胸腰椎侧位、双股骨和胫腓骨正位X线平片检查,采用双能X线吸收仪(DXA,GE Lunar公司)测定患者腰椎1- 4、股骨颈和全髋部位骨密度。
1.2.2 致病基因突变检测:采集患者及其父母外周静脉血,提取基因组DNA(采用QIAampDNA Blood Mini试剂盒)。采用二代高通量捕获测序平台(next generation sequence, NGS, Illumina HiSeq2000平台)检测OI致病基因,该平台覆盖19种已知成骨不全症的致病基因(包括COL1A1、COL1A2、IFITM5、PPIB、SERPINF1、CRTAP、SERPINH1、FKBP10、SP7、BMP1、TMEM38B、PLOD2、P3H1、P4HB、PPIB、SEC24D、SPARC、WNT1和CREB3L1)和700余种其他罕见骨病的候选基因。目标区域碱基覆盖度为98.95%,测序深度达200×。
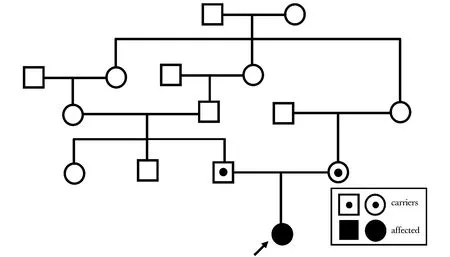
图1 患者家系图Fig 1 Pedigree of the OI family
针对NGS平台发现的致病突变,采用Primer 3软件设计引物,采用聚合酶链反应(polymerase chain reaction,PCR)扩增相应外显子及其与内含子交界区。上游引物序列:5′-CACCCACATTTAAAGTCCC T-3′,下游引物序列:5′-GTGATAGAATTATGGCTCC CT-3′。PCR扩增产物纯化后,用荧光自动测序仪(ABI3700)直接测序,结果与参考序列NM_018112.2比对,以确定患者基因突变位点及类型,进一步与人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)和成骨不全症数据库(http://www.le. ac.uk/ge/collagen/)比对,确定其是否为新型突变位点。
2 结果
2.1 患者临床表型特点
患者幼年起病,主要表现为反复轻微外力下骨折,并逐渐出现双下肢骨骼畸形,巩膜稍蓝,无听力异常及牙本质发育不全等骨骼外表现。患者肝肾功能正常,血钙:2.48 mmol/L(参考范围:2.13~2.70 mmol/L),磷:1.87 mmol/L(参考范围:1.29~1.94 mmol/L),总碱性磷酸酶:180 U/L(参考范围:42~390 U/L),甲状旁腺素:18.5 pg/mL(参考范围:12.0~65.0 pg/mL),均在正常范围内。25羟维生素D:9.5 ng/mL (参考范围:20~50 ng/mL),提示维生素D严重缺乏,骨吸收指标β-胶原降解产物浓度:1.55 ng/mL(参考范围:0.26~0.512 ng/mL),高于正常。骨骼X线片示胸腰椎骨质疏松,双股骨、胫骨弯曲畸形,双股骨和右侧胫骨骨皮质不连续,局部骨痂形成,颅骨未见明显缝间骨(图2)。骨密度:腰椎1-4为0.292 g/cm2(Z评分为-4.97),股骨颈为0.207 g/cm2(Z评分为-7.55),全髋为0.275 g/cm2(Z评分为-5.21)。因患者骨折未愈合,仅给予钙剂和维生素D制剂治疗,暂未予双膦酸盐治疗。
2.2 OI致病基因突变分析
NGS采用SOAP aligner 软件对原始数据进行分析,比对多个正常人群单核苷酸多态性数据库,如单核苷酸多态性数据库(dbSNP build 137),千人基因组计划数据库(the 1 000 Genomes Project)和华大公司内部数据库,以常染色体显性遗传<1%,常染色体隐性遗传<0.5%为阈值,鉴别单核苷酸多态性。进一步分析可能导致蛋白质异常的突变,包括框移突变、无义突变、错义突变和剪切位点突变等。发现患者存在TMEM38B纯合突变:第4外显子507位核苷酸G突变为A(c.507G>A)。Sanger测序证实上述结果。该突变导致169位色氨酸提前终止,产生截短蛋白(p.W169X),其父母亲均为携带者(图3)。该突变在国内外OI患者中均有致病性报道[2- 4](表1)。
由于DEDS固有的离散性和内部机制的复杂性,往往难以用常规的差分方程、微分方程等数学模型来描述,同时关于系统动态过程的解析表达也很难得到,而离散事件系统仿真则能借助仿真的方式很好地描述DEDS各方面的性能,因此,它是目前研究DEDS最为流行的方法之一。

A.lateral films of the skull: no wormian bones at the occipital region; B.lateral films of the spine: osteoporosis without vertebral compression fractures; C.anteroposterior films of the femur and tibiofibular: bilateral bowing femurs and tibiofibular with fractures, slender long bone with thin cortices
图2成骨不全症患者的影像学表现
Fig2RadiologicalfindingsinpatientwithOI
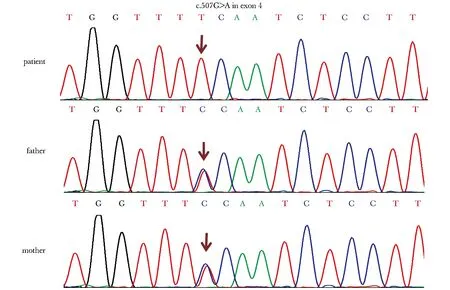
A homozygous mutation ofTMEM38Bwas identified as: c.507G>A in exon 4.this parents were both asymptomatic heterozygous carriers for the mutation
图3TMEM38B测序结果
Fig3SangersequencingresultsoftheTMEM38B
3 讨论
本研究确诊一例以反复轻微外力下骨折为主要表现的OI儿童患者。患者存在低骨密度、长骨纤细且骨皮质菲薄的骨骼特点。生化检查提示维生素D缺乏、骨吸收指标升高。NGS发现TMEM38B第4外显子具有纯合突变(c.507G>A,p.W169X)。
TMEM38B于2012年首次被报道导致OI ⅪⅤ型,该基因位于9q31.2,编码跨膜蛋白38B[5]。跨膜蛋白38B为B型三聚物的细胞内阳离子通道(trimeric intracellular cation channel type B,TRIC-B),在大多数组织的内质网表达,对维持内质网钙离子释放和储存有重要作用[4,6- 7]。钙离子参与I型胶原的合成、折叠、修饰和分泌等多个环节[4],Ca2+依赖的激酶/磷酸酶信号通路参与多能间充质干细胞向成骨细胞分化[8- 9]。因此,TMEM38B突变可影响上述多个环节,导致骨骼脆性增加,反复骨折。
目前已报道5种TMEM38B突变导致OI(图4),本研究首次在维吾尔族患者中发现TMEM38Bc.507G>A突变导致ⅪⅤ型OI (表1)。TMEM38B所致OI患者多为中重度临床表型OI,仅少数病情较轻,部分可有蓝灰色巩膜、听力异常和心脏瓣膜异常等骨骼外表现[2- 5, 9- 11]。本例与既往报道的TMEM38B突变患者临床表型类似。
OI临床诊断主要依赖于家族史、骨骼脆性增加和典型的骨骼外表现,影像学检查可以协助诊断,尚缺乏OI特异的生化指标。本例患者主要表现为反复骨折,无OI家族史,仅有巩膜稍蓝的骨骼外表现,因此诊断OI前需要进行鉴别诊断。现已有报道显示超过100种非创伤性疾病可导致骨骼脆性增加,如致密性成骨不全症、Hajdu-Cheney综合征、低磷骨软化、青少年特发性骨质疏松症、骨硬化症和先天性无痛症等[12]。大多数疾病通过临床表现、影像学检查和致病基因突变检测,能够很好地进行鉴别诊断。
OI尚无根治性治疗方法,双膦酸盐为最常用的治疗药物, 可通过抑制破骨细胞活性, 增加骨密度,减少骨折发生率。本中心曾报道三例TMEM38B突变患者接受双膦酸盐治疗,治疗后骨密度升高,骨折率下降[2],但是双膦酸盐在OI ⅪⅤ型中的疗效尚需在大样本患者中进一步证实。
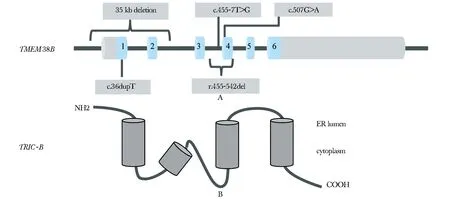
1-6.exon 1-6 of TMEM38B图4 已报道的TMEM38B的突变信息(A)和TRIC的分子模式图(B)Fig 4 Previous reported mutation information of TMEM38B(A) and topology model of TRIC channels(B)

familypatient(n)originsexsillencetypeage1stfracture(years)numberoffracturesdeformityBShearinglossDIBPstreatmentefficacyofBPsRef12ChineseHanMOIⅣ1.4-1.62-6nonononoyesBMD↑[2]2-46TurkishMOIⅣ0-20-13variablewhitetoblueNANAyesBMD↑,fracture↓[9]5NATurkeyNANANANANANANANANANA[3]61ChineseUygurMOIⅢ14yesyesnonononointhisresearch
BS.blue sclerae; DI.dentinogenesis imperfecta; BPs.bisphosphonates.
本研究确诊一例以反复轻微外力下骨折为主要表现的维吾尔族OI儿童患者,证实TMEM38B第4外显子纯合突变(c.507G>A,p.W169X)为其致病基因。对于幼年起病、反复骨折的患者,需重视OI的可能,应积极进行致病基因突变检测,有助于明确诊断及指导临床治疗。
参考文献:
[1] Forlino A, Marini JC. Osteogenesis imperfecta [J]. Lancet, 2016, 387:1657- 1671.
[2] Lv F, Xu XJ, Wang JY,etal. Two novel mutations in TMEM38B result in rare autosomal recessive osteogenesis imperfecta [J]. J Hum Genet, 2016, 61:539- 545.
[3] Caparros-Martin JA, Aglan MS, Temtamy S,etal. Molecular spectrum and differential diagnosis in patients referred with sporadic or autosomal recessive osteogenesis imperfecta [J]. Mol Genet Genomic Med, 2016,5:28- 39.
[4] Cabral WA, Ishikawa M, Garten M,etal. Absence of the ER cation channel TMEM38B/TRIC-B disrupts intra-cellular calcium homeostasis and dysregulates collagen synthesis in recessive osteogenesis imperfecta [J]. PLoS Genet, 2016,12:e1006156. doi: 10.1371/journal.pgen.1006156.
[5] Shaheen R, Alazami AM, Alshammari MJ,etal. Study of autosomal recessive osteogenesis imperfecta in Arabia reveals a novel locus defined by TMEM38B mutation [J]. J Med Genet, 2012,49:630- 635.
[6] Zhou X, Lin P, Yamazaki D,etal. Trimeric intracellular cation channels and sarcoplasmic/endoplasmic reticulum calcium homeostasis [J]. Circ Res, 2014,114:706- 716.
[7] Yamazaki D, Komazaki S, Nakanishi H,etal. Essential role of the TRIC-B channel in Ca2+handling of alveolar epithelial cells and in perinatal lung maturation [J]. Development, 2009,136:2355- 2361.
[8] Zayzafoon M. Calcium/calmodulin signaling controls osteoblast growth and differentiation [J]. J Cell Biochem, 2006,97:56- 70.
[9] Webb EA, Balasubramanian M, Fratzl-Zelman N,etal. Phenotypic spectrum in osteogenesis imperfecta due to mutations in TMEM38B: unravelling a complex cellular defect [J]. J Clin Endocrinol Metab, 2017,102:2019- 2028.
[10] Volodarsky M, Markus B, Cohen I,etal. A deletion mutation in TMEM38B associated with autosomal recessive osteogenesis imperfecta [J]. Hum Mutat, 2013,34:582- 586.
[11] Rubinato E, Morgan A, D’Eustacchio A,etal. A novel deletion mutation involving TMEM38B in a patient with autosomal recessive osteogenesis imperfect [J]. Gene, 2014,545:290- 292.
[12] Bronicki LM, Stevenson RE, Spranger JW. Beyond osteogenesis imperfecta: Causes of fractures during infancy and childhood [J]. Am J Med Genet C Semin Med Genet, 2015,169:314- 327.

