小鼠骨髓间充质干细胞外泌体的分离与鉴定
王如岭,卫小凤,齐 阔,王黎明,李 莹2,,4,白仲添2,,4,严 祥*
(兰州大学第一医院 1.老年病科; 2.普外二科; 3.甘肃省生物治疗与再生医学重点实验室;4.甘肃省肝胆胰研究所,甘肃 兰州730000)
外泌体(exosome)是由细胞内多泡体与细胞膜融合后释放到细胞外隙或生物学体液中的膜性囊泡[1],广泛存在于人体大多数体液中如血液、尿液和唾液等[2],其中包含有蛋白质、RNA、microRNA和DNA片段等[3]多种成分,参与人体许多重要的生理或病理过程,在细胞通讯、细胞迁移、免疫反应和肿瘤细胞增殖等方面起了重要的作用,影响疾病的发生发展[4]。目前,外泌体的生物学研究受到极大关注,其相应的提取和鉴定方法是展开相关研究的重要前提。本研究报道了骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)外泌体的一种分离和鉴定方法,为外泌体的深入研究提供实验基础。
1 材料与方法
1.1 材料
1.1.2 实验动物:SPF级BALB/C小鼠,雄性8 只,体质量20~30 g[中国农业科学院兰州兽医研究所实验动物中心,许可证号:SCXK(甘)2015- 0001]。
1.1.1 主要试剂:DMEM/ F1培养基、胰蛋白酶和胎牛血清(Hyclone 公司);双抗(青霉素及链霉素,Gibco公司);PBS缓冲液、CD单克隆抗体(BD公司);外泌体提取试剂盒(Invitrogeng公司);细胞裂解、蛋白抽提试剂和ECL化学发光试剂盒(Thermo Fisher公司);兔抗鼠CD9、CD63单克隆抗体 (SBI公司)。
1.2 方法
1.2.1 小鼠骨髓间充质干细胞的分离和培养:用全骨髓贴壁培养方法进行BMSCs的培养。细胞计数后调整为1×106个/mL后移入25 cm2培养瓶,放置于含5% CO2、37 ℃饱和湿度的细胞培养箱中孵育,72 h后全量换液。此后每2~3 d更换培养液。当原代细胞增殖汇合至80%左右时进行传代,以后每3~5 d传代1 次。
1.2.2 小鼠骨髓间充质干细胞的鉴定:选择汇合度80%左右第3 代BMSC进行表面鉴定。弃去培养瓶内培养基,加入0.25%胰蛋白酶进行消化离心,离心后的沉淀用1×PBS缓冲液清洗2 遍,进行细胞计数,调整细胞为1×106个/mL,并移入1.5 mL EP管中,每管分别加入CD73抗体、CD105抗体和CD45抗体,37 ℃避光,孵育30 min,再以1×PBS洗涤3 次,行流式细胞分析。
1.2.3 小鼠骨髓间充质干细胞外泌体的分离:待细胞增殖状态良好后,血清改为无外泌体血清继续培养。收集培养第3代间充质干细胞的培养上清液,经0.22 μm滤器过滤,再经超滤管浓缩。然后按照提取试剂盒说明书加入相应比例的试剂和浓缩上清,混匀后4 ℃ 孵育过夜,4 ℃,10 000×g离心1 h,然后吸取上清,最后获得的沉淀为外泌体。
1.2.4 外泌体的鉴定
1.2.4.1 电镜检测外泌体: 取分离纯化外泌体10 μL,加入等体积PBS 稀释后滴加于2 mm的载样铜网上,于室温静置1 min 后用滤纸将多余液体轻轻吸去,用3%(w/v) 磷钨酸钠溶液室温负染1 min,用双蒸水轻轻洗1 遍后室温晾干,于透射电子显微镜观察并照相。
1.2.4.2 Nano-ZS检测外泌体粒径: 将分离得到外泌体沉淀用1 mL经过滤的PBS混匀,然后缓慢注入仪器进行检测,并保存分析数据。
1.2.4.3 流式细胞仪检测外泌体标志物: 经抽提分离得到外泌体沉淀,用100 μL经过滤的PBS混匀,密封冰上保存,CD63和CD81两组抗体染色,标记为CD63和CD81;不染色的外泌体作为阴性对照,标记为阴性对照NC。上机检测。
1.2.4.4 Western blot检测外泌体标志性蛋白: 收集分离得到的外泌体,细胞裂解和蛋白抽提试剂提取总蛋白,BCA法测定蛋白浓度。配置 5%浓缩胶和 10%分离胶进行 SDS-PAGE电泳。在 S1模式电压80 V和 S2模式120 V电压下分离,250 mA将凝胶上的蛋白湿转到PVDF膜上,2% BSA封闭液室温摇床摇动封闭 1 h,加入兔抗鼠一抗(CD9 1∶1 000; CD63 1∶1 000; GAPDH 1∶1 000) 4 ℃孵育过夜。TBST漂洗后加入羊抗鼠二抗(1∶1 000),室温孵育1 h,再次TBST漂洗,ECL显色。
2 结果
2.1 小鼠骨髓间充质干细胞表面分子的鉴定
第3 代 BMSC:CD45呈阴性表达,CD73和 CD105呈阳性表达(图1)。BMSC表面分子表达情况为∶CD45 0.8%、CD73 98.6%和CD105 95.9%。
2.2 透射电镜观察外泌体形态
骨髓间充质干细胞外泌体呈圆形或椭圆形,大小不均匀,直径约30~100 nm,有完整的膜结构,内含低密度物质(图2)。

图1 流式细胞仪检测骨髓间充质干细胞Fig 1 Flow cytometry profile of BMSCs
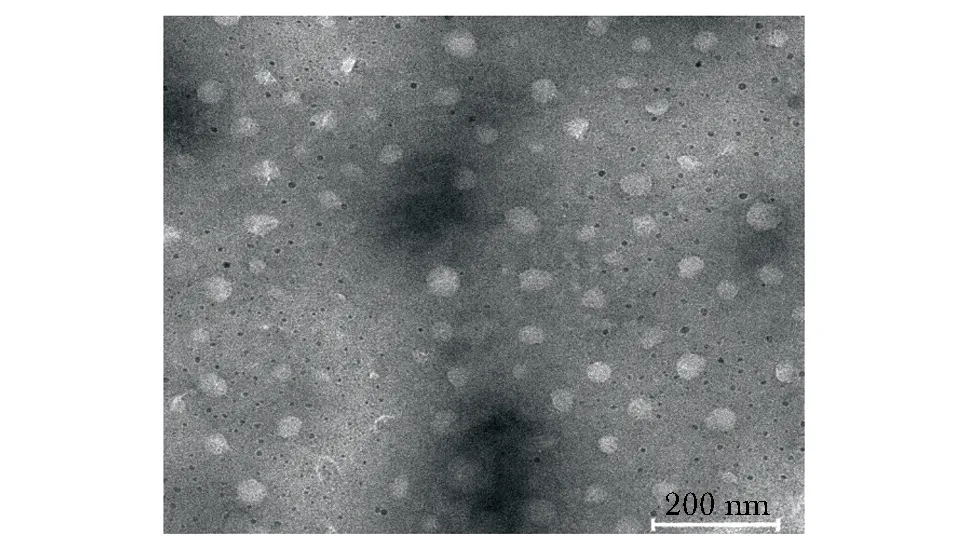
图2 电镜下的外泌体形态Fig 2 Transmission electron micrograph of exosome
2.3 外泌体粒径分析
外泌体平均粒径23.99 nm,粒径主峰61.25 nm。粒子分布系数(polymer dispersity index,PDI)0.517 (图3)。
2.4 流式细胞仪检测外泌体表面标志物
骨髓间充质干细胞的外泌体CD63和CD81呈阳性表达(图4)。
2.5 Western blot检测外泌体特异标志蛋白CD9和CD63
提取的外泌体表达CD63和CD9蛋白(图5)。
3 讨论
目前,外泌体的研究取得了很大的研究进展,但总体还是处于研究的初始阶段并且面临着很多的挑战[5]。外泌体分离与鉴定的研究是该领域探索的重要基础。本研究选取小鼠骨髓间充质干细胞,采用全骨髓贴壁法进行培养,并用流式细胞对其进行了表型鉴定,结果显示符合干细胞的特征;在培养细胞和收集细胞培养上清的过程中进行了改良,该方法也可适用于其他细胞来源外泌体的分离,具有一定的借鉴意义。在细胞增殖状态良好时改用无外泌体血清,保证了细胞的营养需要,较饥饿培养效果更好;通过滤器和超滤管收集细胞培养上清,起到了纯化和浓缩的作用,大大的节省了外泌体提取试剂并且可以获得更多更纯的外泌体; 透射电镜观察提取物,发现背景杂质少,颗粒外观符合外泌体典型特征;用目前较为先进的纳米技术对外泌体进行分析,结果显示:外泌体平均粒径23.99 nm,粒径主峰61.25 nm,均在外泌体理论的粒径范围内;粒子分布系数(PDI)0.517在0.08~0.7之间,证明体系分散度适中,检测结果置信度高;外泌体粒径中20~200 nm范围占70%以上,与外泌体的粒径分布吻合;流式检测外泌体表面标志性蛋白CD6和CD81的表达,均呈阳性,符合外泌体的特征;蛋白CD63和CD9在所有的外泌体中均呈现阳性,Western blot过程中采用两个复孔进行验证,均呈阳性表达,符合外泌体特征。

图3 外泌体粒径密度分布Fig 3 Size distribution by intensity of exosome
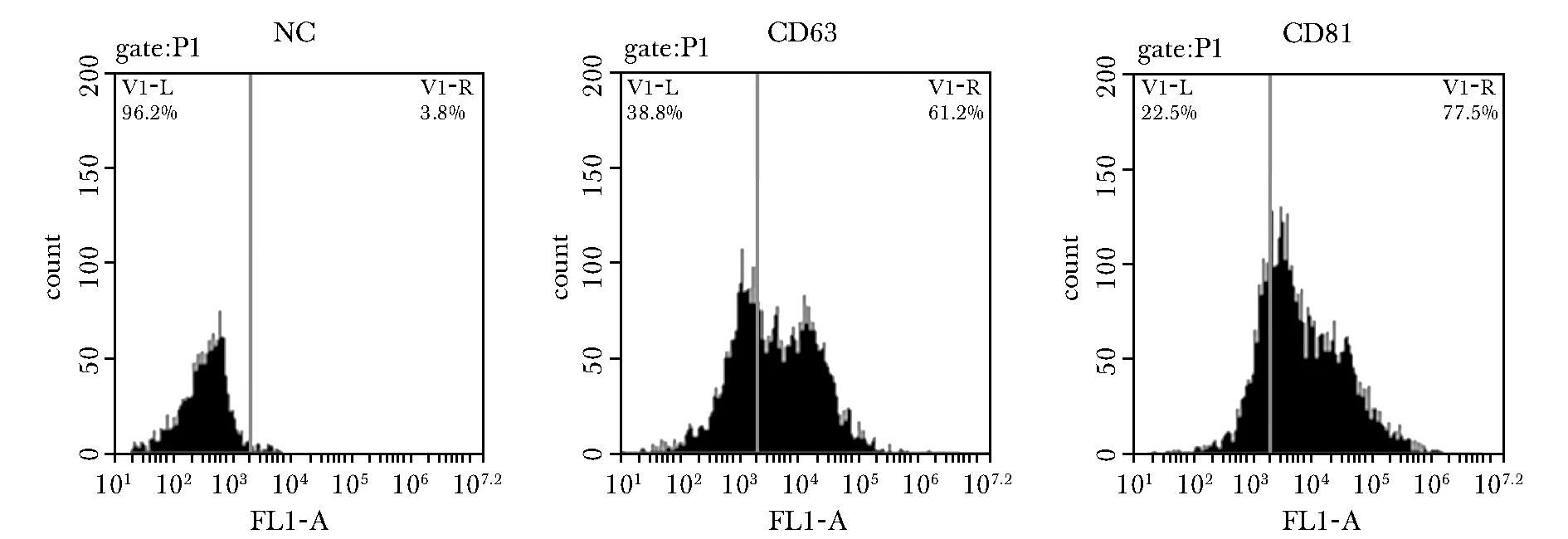
图4 流式细胞检测外泌体标志物Fig 4 Flow cytometry profile of exosome markers

图5 Western blot检测外泌体蛋白Fig 5 Expression of CD9 and CD63 in exosome by Western blot
综上所述,本研究针对骨髓间充质干细胞外泌体的分离和鉴定是可行的,并具有一定的创新性和借鉴意义,为外泌体的深入研究奠定了实验基础。外泌体内含有与细胞来源相关的蛋白质、DNA、mRNA 和 miRNA等[6],其作用渐渐为人们所重视,外泌体是由细胞分泌的,可以行使部分细胞功能,在体内的安全性优于细胞疗法,同时他还能够通过生物屏障,在细胞间传递功能性核酸分子,从而发挥各种生物学功能。外泌体有望成为肿瘤检测和诊断的生物标志物[7]、新型给药途径[8]、基因治疗[9]和无细胞治疗载体[10],对于疾病的诊断、治疗和预后判断具有重要的研究价值和广阔的应用前景。
参考文献:
[1] Wu J, Qu Z, Fei ZW,etal. Role of stem cell-derived exosomes in cancer.[J]. Oncol Lett, 2017, 13:2855- 2866.
[2] Wu Z, Zeng Q, Ke C,etal. Exosomes: small vesicles with big roles in hepatocellular carcinoma[J]. Oncotarget, 2016, 7:60687- 60697.
[3] Emanueli C, Shearn AI, Angelini GD,etal. Exosomes and exosomal miRNAs in cardiovascular protection and repair[J]. Vascul Pharmacol, 2015, 71:24- 30.
[4] Shao Y, Shen Y, Chen T,etal. The functions and clini-cal applications of tumor-derived exosomes[J]. Oncotarget, 2016, 7:60736- 60751.
[5] Tkach M, Théry C. Communication by extracellular vesicles: where we are and where we need to go[J]. In Cell, 2016,164:1226- 1232.
[6] Nedaeinia R, Manian M, Jazayeri MH,etal. Circulating exosomes and exosomal microRNAs as biomarkers in gastrointestinal cancer[J].Cancer Gene Ther, 2017, 24:48- 56.
[7] Zhang X, Pei Z, Chen J,etal. Exosomes for immunoregulation and therapeutic Intervention in cancer[J]. J Cancer, 2016, 7:1081- 1087.
[8] Lai RC, Yeo RW, Tan KH,etal. Exosomes for drug delivery-a novel application for the mesenchymal stem cell[J]. Biotechnology Advances, 2013, 31:543- 551.
[9] Dang XT, Zeng XR. Targeted therapeutic delivery using engineered exosomes and its applications in cardiovascular diseases [J]. Gene, 2016, 575:377- 384.
[10] Phinney DG, Pittenger MF. Concise review:MSC-derived exosomes for cell-free therapy[J]. Stem Cells, 2017, 35:851- 858.

