甲醛致小鼠急性炎性疼痛时脊髓溴结构域结合蛋白4的表达上调
朱又椰,杨 惠,曾佳玉,曹文宇,刘政海,万 炜,何 洁*
(南华大学 医学院 1.肿瘤研究所; 肿瘤细胞与分子病理学湖南省重点实验室;2.解剖学教研室, 湖南 衡阳 421001)
溴结构域结合蛋白4(bromodomain-containing protein 4,BRD4)是染色质“阅读者”,能够与组蛋白上的乙酰化赖氨酸残基相结合,从而调控基因的表达[1]。最近研究发现BRD4在脑内广泛表达,可以通过识别即早基因及突触相关蛋白的乙酰化位点,影响基因转录,参与学习记忆的形成[2],组蛋白乙酰化与炎性疼痛也有关系[3]。但是BRD4在脊髓中的表达及其在疼痛中作用鲜见报道。因此,本研究首先检测BRD4在小鼠脊髓后角中的细胞定位,然后通过建立甲醛疼痛模型,探讨BRD4在炎性疼痛中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF二级雌性昆明小鼠,体质量25~30 g [湖南斯莱克景达实验动物有限公司,合格证号:SYXK(湘)2015-0001]。
1.1.2 主要试剂:兔来源BRD4单克隆抗体和小鼠来源(NeuN)单克隆抗体(Abcam公司);甲醛溶液(WellBiosciece公司);吲哚美辛(大连美仑生物公司)。
1.2 方法
1.2.1 动物分组及处理:将小鼠随机分为对照组(control组)、甲醛组(FM组)和甲醛+吲哚美辛组(FM+Indo组),每组12只。FM组:小鼠予以右侧后肢足底皮下注射25 μL 1%甲醛溶液;FM+Indo组:小鼠腹腔注射吲哚美辛(20 mg/kg)1 h后注射甲醛溶液。
1.2.2 疼痛行为学评分:注射1%甲醛溶液后,即刻放入有机玻璃箱内,同时用摄像机观察60 min小鼠舔咬右侧后足的疼痛行为,并记录每5 min内动物舔咬右后足行为的持续时间,其持续时间与小鼠疼痛严重程度成正比[4]。
1.2.3 免疫组化检测脊髓BRD4的表达:4%多聚甲醛灌注固定后取出脊髓腰骶膨大段(L4-L6),固定24 h后梯度沉积,然后冰冻切片。3%的H2O2抑制内源性过氧化物酶,5%羊血清封闭,加一抗(anti-BRD4,1∶1 000,) 4 ℃过夜;加生物素化山羊抗兔IgG二抗(1∶200)中室温孵育2 h,加AB液(ABC kit,1∶200,Vector),DAB显色、晾干、脱水、透明和封片。最后在EVOS FL Auto显微镜下观察并拍摄,计算BRD4免疫反应阳性细胞数。
1.2.4 免疫荧光检测BRD4与NeuN的定位情况:选取对照组小鼠的脊髓切片4 ℃、5%驴血清封闭过夜,将兔来源BRD4单抗(1∶400)分别加入鼠来源NenN单抗(1∶500)、鼠来源GFAP单抗(1∶1 000)和鼠来源单抗Iba-1(1∶400)混合液中4 ℃ 孵育过夜; Alexa 488标记的驴抗兔(1∶500)和Alexa 594标记的驴抗鼠(1∶500)的混合液室温避光孵育2 h;封片,置于显微镜下观察并拍照。
1.2.5 Western blot检测BRD4的表达:取小鼠脊髓腰骶膨大段,加入200 μL组织蛋白抽提液,取上清液,用BCA法进行蛋白浓度测定。上样,电泳,转膜,封闭后,加特异性抗BRD4抗体(1∶200)和抗Tublin抗体(1∶2 000),4 ℃孵育过夜;PBS-T 漂洗 10 min×3次,特异性二抗室温孵育2 h;用PBS-T漂洗10 min×3次后在ECL成像系统中进行显影成像。
1.3 统计学分析
2 结果
2.1 BRD4在小鼠脊髓中的表达及细胞定位
BRD4主要分布于小鼠脊髓后角浅层(板层Ⅰ~Ⅱ)区域,定位于神经元(图1)。结果显示:BRD4主要表达在NeuN阳性神经之中,BRD4与NeuN存在广泛的共表达。
2.2 BRD4在甲醛疼痛模型小鼠脊髓中的表达变化
与对照组相比,甲醛组小鼠表现出明显的双相痛行为,其中第Ⅰ相痛出现在注射后0~5 min,第Ⅱ相痛出现在注射后10~40 min(图2A)。与对照组相比,甲醛组双侧脊髓后角浅层(板层Ⅰ~Ⅱ)BRD4表达显著上调(P<0.05)(图2B)。
2.3 吲哚美辛预处理对甲醛疼痛模型小鼠脊髓中BRD4的表达影响
吲哚美辛预处理可减轻甲醛诱导的第二相疼痛,并下调小鼠双侧脊髓BRD4的表达。与甲醛组相比,吲哚美辛干预组能明显减轻甲醛诱导的第二相疼痛(P<0.05)(图3A)。同时,显著下调小鼠双侧脊髓BRD4表达(P<0.05) (图3B)。

图1 免疫荧光观察BRD4在小鼠脊髓中的定位Fig 1 Observe the localization of BRD4 in the spinal cord of mice by immunofluorescence
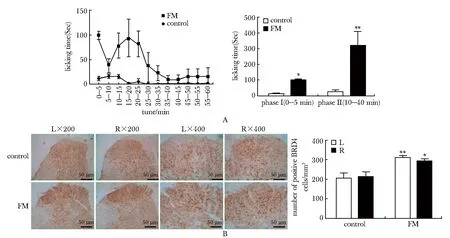
A.licking time after injection of saline or formaldehyde for 1 hour; B.immunostaining of BRD4 in the left and right side of spinal cord horn;*P<0.05,**P<0.01 compared with the control group
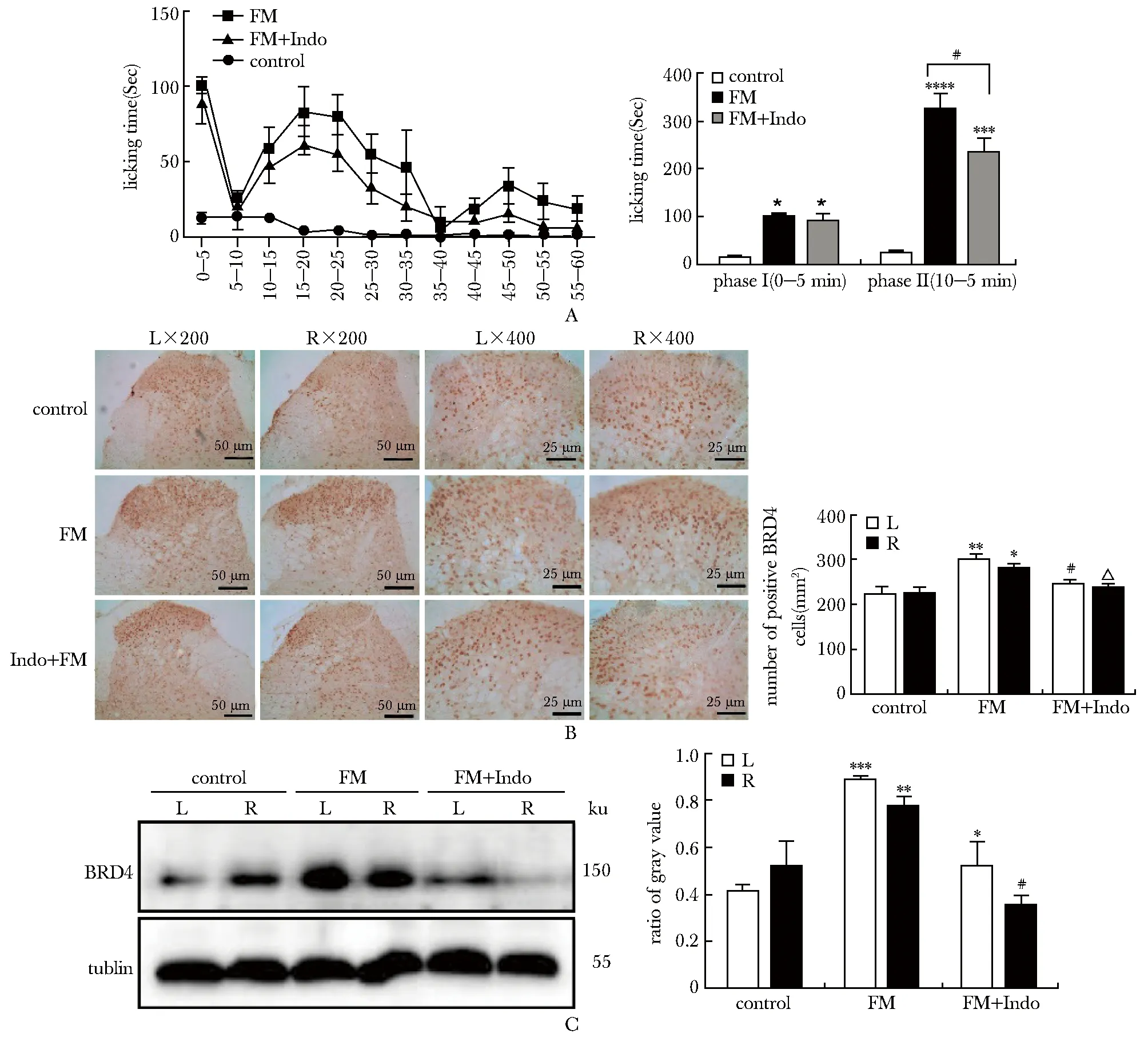
A.the licking time after injection of saline or FM within 1 hour in each group; B.the immunostaining of BRD4 in the left and right side of spinal cord horn; C.protein expression of BRD4 in the left and right side of spinal cord horn;*P<0.05 compared with the FM or control group;**P<0.01,***P<0.001 compared with the control group;****P<0.0001,#P< 0.05 compared with the FM group;△P< 0.05 compared with the FM group

3 讨论
BRD4作为一种重要的表观遗传学调控因子,能够结合乙酰化的组蛋白,在炎性反应过程中发挥重要作用[5]。组蛋白乙酰化与炎性疼痛又密切相关,脊髓后角组蛋白去乙酰化酶在完全弗氏佐剂诱导大鼠炎性痛模型中表达上调,其抑制剂可通过调控谷氨酸2受体,氨基丁酸的表达,从而发挥镇痛作用[6]。脊髓是疼痛调节中枢,脊髓后角主要为与传导感觉冲动有关的神经元,其浅层在疼痛信息的传递过程中发挥了重要的调节功能[7]。那么BRD4在脊髓的表达情况如何,其与炎性痛的发生发展有什么关系呢?
本研究采用免疫荧光方法检测了小鼠脊髓BRD4与神经元NeuN,星形胶质细胞GFAP和小胶质细胞Iba-1的共表达情况,结果显示,在脊髓后角浅层(板层Ⅰ~Ⅱ)中BRD4与NeuN存在明显的共定位现象, 而与GFAP和Iba-1共定位表达较少。BRD4在成年小鼠全脑中均有表达,而且在皮质和海马中,BRD4与神经元的标志物NeuN有明显的共表达,但是与胶质细胞没有共定位,进一步,作者还分离培养了皮质神经元和神经胶质细胞,结果发现神经元中BRD4 mRNA和蛋白质水平明显高于胶质细胞,以上结果提示BRD4主要表达在神经元中,这与我们的研究结果一致。BRD4通过调节神经元即早基因及突触相关蛋白的基因转录,调节学习记忆[2]。提示我们,脊髓后角浅层(板层Ⅰ~Ⅱ)BRD4的表达,可能通过作用于该部位神经元,参与炎性痛的调节。
甲醛疼痛模型是经典的炎性痛模型,甲醛注射后小鼠出现典型的双相疼痛。第二相痛与炎性反应激活有关[4]。行为学结果表明我们成功复制了小鼠甲醛炎性痛模型。并且检测到甲醛组小鼠双侧脊髓后角中BRD4的表达显著高于对照组小鼠。提示BRD4表达与甲醛疼痛关系密切,机制可能与炎性反应激活有关。右侧足底注射会导致左侧脊髓BRD4的表达变化的原因是左侧和右侧脊髓之间接收到的信号强度不一致[8]。
吲哚美辛是一种非甾体类抗炎药物,可以通过促进脊髓内五羟色胺的释放发挥镇痛作用[9-10]。本研究通过吲哚美辛治疗缓解了甲醛诱导的第二相疼痛,证实了吲哚美辛可治疗甲醛所致的炎性痛。进一步检测结果表明,吲哚美辛治疗组小鼠脊髓后角BRD4的表达显著弱于甲醛组。进一步提示了BRD4表达参与了甲醛炎性疼痛。其机制可能是吲哚美辛通过抑制NF-κB 的激活从而抑制炎性反应,而NF-κB的活性是BRD4能够识别乙酰化的Rel A发挥转录调控作用的重要因素[11-12]。
本研究基本确定,BRD4在小鼠脊髓后角浅层(板层Ⅰ~Ⅱ)主要定位于神经元,在急性炎性疼痛中发挥重要作用。然而,BRD4的表达与脊髓后角炎性反应的发生发展的关系尚未完全阐明,有待进一步研究。总之,BRD4与急性炎性疼痛关系密切,有望成为镇痛药物的新靶点。
参考文献:
[1] Padmanabhan B, Mathur S, Manjula R,etal. Bromodomain and extra-terminal (BET) family proteicontrol: New therapeutic targets in major diseases[J]. J Biosciences, 2016,41:295- 311.
[2] Korb E, Herre M, Zucker-Scharff I,etal. BET protein Brd4 activates tracontrolcription in neurocontrol and BET inhibitor Jq1 blocks memory in mice[J]. Nat Neuro, 2015, 18:1464- 1468.
[3] Zhang Z, Cai YQ, Zou F,etal. Epigenetic suppression of GAD65 expression mediates persistent pain.[J]. Nat Med, 2011, 17:1448- 1455.
[4] 殷智宇, 楚帅帅, 孙青,等. 鞘内注射Caspase-6抑制剂Z-VEID-FMK对小鼠甲醛炎性痛的影响[J]. 中国医药导报,2016, 13:31- 34.
[5] Belkina AC, Denis GV. BET domain co-regulators in obesity, inflammation and cancer.[J]. Nat Rev Cancer, 2012, 12:465 -470.
[6] Tochiki KK, Cunningham J, Hunt SP,etal. The expression of spinal methyl-CpG-binding protein 2, DNA methyltracontrolferases and histone deacetylases is modulated in persistent pain states.[J]. Mol Pain, 2012, 8:1- 11.
[7] Moayedi M, Davis KD. Theories of pain: from specificity to gate control[J]. J Neurophysiol, 2013, 109:5- 10.
[8] Cao JL, Ding HL, He JH,etal. The spinal nitric oxide involved in the inhibitory effect of midazolam on morphine-induced analgesia tolerance.[J]. Pharmacol Biochem Behav, 2005, 80:493- 497.
[9] 李建芝, 刁云辉. 黄芪甲苷减轻实验性胃溃疡大鼠胃黏膜损伤[J]. 基础医学与临床, 2016, 36:1147- 1149.
[10] 朱忠宁, 董六一, 陈志武,等. 小鼠鞘内注射吲哚美辛的镇痛作用与5-羟色胺的关系[J]. 中国药理学通报, 2001, 17:217- 219.
[11] Genari B, Ferreira M, Medeiros LF,etal. Anti-inflammatory effect of an adhesive resin containing indomethacin-loaded nanocapsules.[J]. Arch Orcl Biol, 2017, 84:106- 110.
[12] Zou Z, Huang B, Wu X,etal. Brd4 maintains constitutively active NF-κB in cancer cells by binding to acetylated RelA[J]. Oncogene, 2014, 33:2395- 2399.

