分泌型CTLA- 4融合恶性疟原虫核酸疫苗联合GM-CSF增强小鼠免疫反应
高宇辉,邓唯唯,魏春燕
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原学系, 北京 100005)
疟疾是由蚊媒传播疟原虫感染而引起的寄生虫病,目前仍然是威胁人类健康的3大传染病之一。2016年大约2.16亿人感染疟疾,共有44.5万人死于疟疾,99%死亡患者是受到恶性疟原虫(Plasmodiumfalciparum)感染,其中5岁以下儿童的病死率占到70%(WHO World Malaria Report 2017)。研发出安全有效的疟疾疫苗成为该公共健康领域的一项重要目标,然而目前还没有预防效果令人满意的疟疾疫苗上市。DNA疫苗是一种新型疫苗,可以激发机体产生体液免疫和细胞免疫,相比传统的蛋白质疫苗有诸多的优点,广泛用于病原体感染、肿瘤及自身免疫病等疾病研究。在疟疾疫苗研究方面,DNA疫苗也逐渐受到重视,两项针对恶性疟原虫子孢子/肝期的DNA疫苗已进入到临床研究阶段,显示了DNA疫苗在疟疾研究领域良好的应用前景[1- 2]。
恶性疟感染在红内期发育阶段导致临床症状的发生,严重者可致死亡。针对恶性疟红内期感染的疫苗可以抑制寄生虫血症,减轻临床症状,降低疟疾病死率。本研究室前期研究基于恶性疟原虫红内期多表位人工随机重组蛋白疫苗编码序列设计的核酸疫苗VR1012-ES312,在小鼠实验中显示,其可以激发一定水平的特异性体液免疫和细胞免疫反应[3]。本研究将抗原与靶向树突状细胞(DCs)的细胞毒性T淋巴细胞相关抗原- 4(cytotoxic T-lymphocyte-associated protein-4,CTLA- 4)胞外段融合表达,并在免疫时加入细胞因子佐剂,旨在探讨是否能够进一步加强疟疾DNA疫苗的免疫效力。
1 材料与方法
1.1 材料
HEK293细胞、DMEM高糖培养基、RPMI- 1640培养基、胎牛血清(FBS)和抗生素(中国医学科学院基础医学研究所细胞资源中心);DC2.4细胞(上海慧颖生物科技有限公司);引物合成和测序(Invitrogen公司);限制性内切酶(NEB公司);抗ES312- IgY抗体(本研究室制备);HRP标记的AntiChicken IgY(Promega公司);HRP或FITC标记的山羊抗小鼠IgG(中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 表达载体构建及质粒提取:人工合成两端带有PstⅠ和SalⅠ位点的分泌肽tPA leader编码序列连入VR1012质粒,进而与从质粒VR1012-ES312经SalⅠ/BglⅡ酶切得到的ES312表达框连接,构建分泌型表达质粒VR1012-sES312。使用引物sC4- 1/sC4- 2,以小鼠cDNA文库为模板扩增CTLA- 4胞外区,克隆入VR1012-sES312质粒,得到融合抗原表达载体VR1012-sES312-CTLA。小鼠粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimu-lating factor,GM-CSF)序列通过引物CSF- 1/CSF- 2扩增,克隆入VR1012载体,构建表达质粒VR1012-GMCSF(图1,表1)。
1.2.2 细胞转染及质粒表达的检测: 转染前24 h将HEK293细胞按1×105个/0.5 mL每孔接种于24孔板,转染过程参照VigoFect转染试剂盒(威格拉斯生物技术公司)说明书操作,转染后继续培养60 h。Western blot 检测转染细胞上清液蛋白表达水平。即取VR1012-sES312转染细胞培养上清,并以VR1012空载体转染的细胞蛋白抽提物以及VR1012-ES312转染细胞的上清液和细胞总蛋白抽提物为对照,行聚丙烯酰胺凝胶电泳。转膜,以Anti-M.RCAg- 1 IgY为一抗(1∶2 500稀释),HRP标记的Anti-Chicken IgY为二抗(1∶20 000)孵育,化学发光法(ECL)显影。
1.2.3 CTLA结合实验:参照文献[4]方法,分别收集VR1012、VR1012-sES312以及VR1012-sES312-CTLA转染HEK293细胞培养60 h上清液;DC2.4细胞使用2% FBS/PBS(胎牛血清/磷酸盐缓冲液)溶液洗涤2次,重悬于100 μL 2% FBS/PBS溶液中。加入100 μL HEK293细胞浓缩上清,室温孵育1 h后洗涤,加入100 μL抗ES312-IgY抗体(1∶1 000),室温孵育1 h后洗涤。加二抗(Abcam Goat Anti-Chicken IgY H&L Alexa Fluor®488) (1∶500),孵育30 min,洗涤后加入100 μL新鲜配制的2%甲醛/PBS固定5 min,流式细胞计量术(FACS)检测。
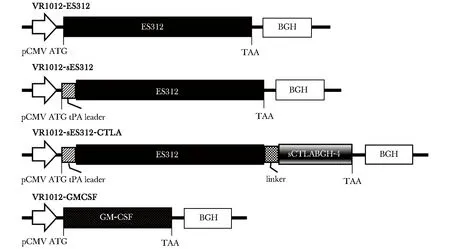
图1 疟疾DNA疫苗表达载体构建示意图Fig 1 Schematic representation of the constructed malaria DNA vaccines

primersequence(5'-3') sC4-1CCCggatccGCTAGCGGCGGCGGCGGCAGCGGAGGAGGAGGAGAAGCCATACAGGTGACCCAACsC4-2GGAagatctTCAAGAATCCGGGCATGGTTCCSF-1ACGCgtcgacGCCGCCACCATGTGGCTGCAGAATTTACTTTTCCCSF-2CGCggatccTCATTTTTGGCCTGGTTTTTTGCATTC
Lowercase letters in the sequence are restriction enzyme sites; (GS)-linker sequence is shown in underline.
1.2.4 活体电穿孔免疫:SPF级6~8周雌性Balb/c小鼠,体质量18~20 g(中国医学科学院实验动物研究所),随机分为6组:VR1012-ES312组、VR1012-sES312组、VR1012-sES312-CTLA组、VR1012-sES312+GM-CSF组、VR1012-sES312-CTLA+GM-CSF组,以空载体VR1012为对照免疫组。每组免疫5只小鼠。核酸疫苗电穿孔免疫方法参照文献[3]进行操作,每种质粒注射量50 μg/只小鼠,总共免疫4次,间隔两周。
1.2.5 特异性IgG抗体、细胞因子检测及间接免疫荧光实验(IFA):最后1次免疫结束后第10天收集小鼠血清和脾细胞。ELISA法测定血清抗体效价、ELISPOT法检测细胞因子表达以及IFA检测抗血清识别疟原虫天然蛋白等操作均参照文献[3]方法进行。
1.3 统计学分析

2 结果
2.1 VR1012-sES312-CTLA质粒分泌表达
VR1012-sES312-CTLA质粒转染细胞培养上清出现约90 ku的特异条带,与ES312-CTLA融合蛋白理论分子质量大小相符;对照未融合CTLA的非分泌型VR1012-ES312质粒转染细胞,在细胞总蛋白抽提物检测到约65 ku大小的ES312蛋白条带[5],而在细胞培养上清中未检测到ES312表达,表明VR1012-sES312-CTLA质粒可以在真核细胞中正确表达并分泌ES312-CTLA融合蛋白(图2)。

1.supernatant of VR1012-sES312-CTLA transfected cell culture; 2.extract from VR1012-ES312 transfected cell; 3.supernatant of VR1012-ES312 transfected cell culture; 4.extract from VR1012 transfected cell图2 免疫印记检测DNA疫苗载体转染HEK293细胞表达的蛋白Fig 2 Immunoblotting detection of protein expressed by HEK293 cells transfected with DNA vaccine vectors
2.2 CTLA融合蛋白与DC2.4细胞亲和性分析
与VR1012-sES312细胞培养上清相比,含有CTLA重组抗原蛋白的VR1012-sES312-CTLA细胞培养上清显著增强了DC2.4细胞平均荧光强度(MFI)的偏移,阳性细胞率由7.67%提高到31.64%(图3)。

图3 转染HEK293细胞培养上清的蛋白结合表达B7的DC细胞Fig 3 Protein in supernatant of transfected HEK293 cells binding to B7-expressing DC cells
2.3 免疫后各组IgG效价和细胞免疫应答检测
免疫小鼠血清IgG抗体ELISA结果(图4A)显示,VR1012-sES312免疫组、VR1012-sES312-CTLA免疫组以及VR1012-sES312+GM-CSF共免疫组较之原设计非分泌型VR1012-ES312免疫组的抗体滴度均显著提升,分别是VR1012-ES312免疫组的5倍、54.5倍和33倍(P<0.001);VR1012-sES312-CTLA+GM-CSF共免疫组相比单独VR1012-sES312-CTLA免疫组或者VR1012-sES312+GM-CSF共免疫组抗体滴度也有明显增加(P<0.01);VR1012-sES312-CTLA+GM-CSF共免疫组比VR1012-ES312免疫组抗体滴度提高190倍(P<0.001)。ELISPOT结果显示,与对照VR1012-sES312实验组比较,VR1012-sES312-CTLA组以及VR1012-sES312+GM-CSF基因佐剂共免疫组均能显著地促进脾细胞IFN-γ和IL- 4细胞因子的分泌(P<0.001) (图4B,C)。
2.4 免疫血清对疟原虫天然抗原的识别
优化设计改造后的DNA疫苗免疫血清仍然能够识别恶性疟原虫3D7株天然虫体抗原(图5),其中VR1012-sES312-CTLA+GM-CSF共免疫组识别天然抗原的IgG滴度高达1∶3 200,VR1012-sES312-CTLA免疫组识别滴度达1∶1 600,0.9%氯化钠溶液与空载体VR1012免疫组对照组不识别天然抗原。
3 讨论
DNA 疫苗是近年来发展起来的新型疫苗,导入机体后表达出抗原蛋白可通过MHC-Ⅰ以及MHC-Ⅱ途径呈递,激活CD4和CD8+T细胞,诱导产生体液免疫和细胞免疫反应[6]。DNA疫苗研究普遍采用导入肌肉组织中进行免疫,但肌肉细胞并不是专职的抗原呈递细胞(APCs),无法引起强烈的特异性免疫应答;由DCs将DNA编码抗原呈递给T细胞是DNA疫苗免疫反应中的关键事件[7]。然而,组织中DCs占有核细胞总数的比例不到1%,且DNA疫苗经普通的肌肉免疫途径免疫小鼠,只有大约0.4%的DCs能够被转染[8]。这些因素使得DNA疫苗免疫效果尚不能完全令人满意。
改善DNA疫苗的免疫效力的一种手段是直接将抗原靶向APCs。CTLA- 4表达在活化的T细胞表面,可以与抗原呈递细胞(APC)表面的B7分子高亲和力结合,将CTLA- 4编码序列与抗原连接构建的DNA疫苗免疫小鼠,在没有佐剂的情况下即可增强体液和细胞免疫[9]。只保留细胞外CTLA- 4结构域不影响其与受体分子结合的能力。抗原与CTLA- 4胞外区共表达, 尤其是在大动物的DNA免疫实验中,可显著增强DNA疫苗的免疫原性[10]。
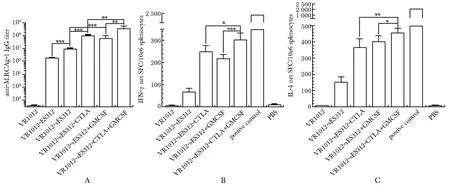
A.IgG antibody titers detected by ELISA; B.IFN-γ secreting splenocytes from immunized mice; C.IL- 4 secreting splenocytes from immunized mice;*P<0.05,**P<0.01,***P<0.001; SFC.spot forming cells


图5 间接免疫荧光分析(IFA)DNA疫苗小鼠免疫血清抗体(1∶200稀释)识别恶性疟原虫体抗原
增强机体对DNA疫苗免疫应答的另一种方法是加入分子佐剂,即在设计DNA疫苗时引入细胞因子、趋化因子或共刺激分子的编码序列,即所谓的基因佐剂(genetic adjuvant)。GM-CSF是DNA疫苗研究中使用较多的一种基因佐剂。GM-CSF可以将APC招募到抗原处理部位,刺激骨髓DCs成熟,加强抗原特异性的CD8+T细胞反应。GM-CSF在临床上的应用也已经证实是安全的,一项以GM-CSF为基因佐剂针对疟原虫肝期的五价DNA疫苗临床研究也表明,GM-CSF在人体应用是安全可靠的[2]。
疟疾感染者获得保护性与感染早期IFN-γ以及Th2细胞介导的IL- 12、IL- 4反应以及抗体类别向IgG转换密切相关[11]。前期工作中构建了胞内表达型恶性疟原虫红内期疟疾核酸疫苗[3],为了进一步提高DNA疟疾疫苗经肌肉途径的免疫效力,本研究将DNA疫苗载体改造为分泌型表达,同时采用CTLA- 4靶向DCs的融合表达设计。结果显示,分泌型DNA疫苗免疫小鼠明显增强了细胞因子IFN-γ和IL- 4的分泌,说明分泌型抗原增加了与APC细胞接触的概率,能更有效的刺激细胞免疫;且CTLA- 4融合表达增加了抗原分子对局部DCs表面吸附能力,促进了DCs摄取抗原的效率,进一步加强了体液和细胞免疫。另一方面, GM-CSF对DNA疫苗免疫有显著的刺激机体产生持久系统免疫反应的佐剂效应[12],本研究结果也显示,在GM-CSF的基因佐剂的参与下,可明显增强DNA疫苗的免疫应答,游离疟疾抗原在CTLA- 4靶向作用以及GM-CSF的基因佐剂共同作用下,抗体滴度提高了190倍。
本研究改造了原有疟疾DNA疫苗设计,使得抗原表达后分泌到细胞外并靶向DC细胞。同时采用基因佐剂GM-CSF共同免疫的策略,大大促进了体液和细胞免疫水平,显著增强了DNA疫苗的免疫效力,为研制有效的疟疾DNA疫苗提供了新的思路。
参考文献:
[1] Spearman P, Mulligan M, Anderson EJ,etal. A phase 1, randomized, controlled dose-escalation study of EP-1300 polyepitope DNA vaccine against Plasmodium falciparum malaria administered via electroporation [J]. Vaccine, 2016, 34: 5571- 5578.
[2] Richie TL, Charoenvit Y, Wang R,etal. Clinical trial in healthy malaria-naive adults to evaluate the safety, tolerability, immunogenicity and efficacy of MuStDO5, a five-gene, sporozoite/hepatic stage Plasmodium falciparum DNA vaccine combined with escalating dose human GM-CSF DNA [J]. Hum Vaccin Immunother, 2012, 8: 1564- 1584.
[3] 高宇辉, 邓唯唯, 张佳佳, 等. 活体电穿孔导入法增强恶性疟原虫核酸疫苗免疫反应研究 [J]. 医学研究杂志, 2016, 45: 19- 24.
[4] Gan L, Jia R, Zhou L,etal. Fusion of CTLA- 4 with HPV16 E7 and E6 enhanced the potency of therapeutic HPV DNA vaccine [J]. PLoS One, 2014, 9: e108892.doi:10.1371/journal.pone.0108892.
[5] Wang J, Lin Y, Cai P,etal. Effects of vector fusion peptides on the conformation and immune reactivity of epitope-shuffled, recombinant multi-epitope antigens [J]. Protein Pept Lett, 2011, 18: 73- 83.
[6] Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity [J]. Expert Rev Vaccines, 2015, 15: 1- 17.
[7] Steinman RM, Inaba K, Turley S,etal. Antigen capture, processing, and presentation by dendritic cells: recent cell biological studies [J]. Hum Immunol, 1999, 60: 562- 567.
[8] Casares S, Inaba K, Brumeanu TD,etal. Antigen presentation by dendritic cells after immunization with DNA encoding a major histocompatibility complex class II-restricted viral epitope [J]. J Exp Med, 1997, 186: 1481- 1486.
[9] Boyle JS, Brady JL, Lew AM. Enhanced responses to a DNA vaccine encoding a fusion antigen that is directed to sites of immune induction [J]. Nature, 1998, 392: 408- 411.
[10] Yin Y, Wu C, Song J,etal. DNA immunization with fusion of CTLA- 4 to hepatitis B virus (HBV) core protein enhanced Th2 type responses and cleared HBV with an accelerated kinetic [J]. PLoS One, 2011, 6: e22524.doi:10.1371/journal.pone.0022524.
[11] Crompton PD, Moebius J, Portugal S,etal. Malaria immunity in man and mosquito: insights into unsolved mysteries of a deadly infectious disease [J]. Annu Rev Immunol, 2014, 32: 157- 187.
[12] Tovey MG, Lallemand C. Adjuvant activity of cytokines [J]. Methods Mol Biol, 2010, 626: 287- 309.
——“零疟疾从我开始”

