普伐他汀预处理对香烟提取物诱导的小鼠血管平滑肌细胞凋亡的影响及可能机制研究
廖思聪,祁春雷,王大新
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病发生发展的主要病理基础,其特征性病理改变是AS斑块形成。血管平滑肌细胞(vascular smooth muscle cell,VSMCs)在维持血管稳态方面具有重要作用。既往研究结果显示,凋亡或坏死的VSMCs是构成AS斑块最重要的成分之一,但AS形成过程较为复杂,具体机制尚未完全阐明[1-4]。吸烟是心血管疾病明确的独立危险因素之一,但其确切作用机制至今尚未完全阐明[5-6]。他汀类药物是治疗心血管疾病的常用药物之一,具有调脂、抗炎、抗氧化、抗肿瘤等多重作用[7-8],其是否对吸烟引起的血管损伤具有保护作用目前尚不清楚。本研究旨在探讨普伐他汀预处理对香烟提取物(cigarette smoke extract,CSE)诱导的小鼠VSMCs凋亡的影响及可能机制,为临床有效防治AS提供参考。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂 Bcl-2抗体和Chop抗体购自美国Cell Signaling Technology公司,Bax抗体和GRP78抗体购自美国Santa Cruz公司,β-actin抗体、普伐他汀和4-苯基丁酸(4-PBA)购自美国Sigma Aldrich公司,胎牛血清、DMEM培养基购自美国Hyclone公司,聚偏二氟乙烯(PVDF)膜购自美国Merck Millipore公司,ECL显影试剂盒购自美国Thermo Scientific公司,红金龙香烟购自湖北中烟工业有限公司,辣根过氧化物酶标记山羊抗兔二抗和羊抗小鼠二抗购自北京中杉金桥生物公司,RIPA蛋白裂解液、BCA蛋白定量试剂盒购自北京索莱宝公司,Annexin V-FITC/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒购自北京康为世纪生物技术公司,RNA提取试剂盒、cDNA合成试剂盒及聚合酶链反应(PCR)扩增试剂盒购自北京天根生化科技公司。
1.1.2 主要仪器 BD FACSCalibur流式细胞仪购自美国Becton Dickinson公司;Tecan M2000多功能酶标仪购自美国Tecan公司;ChemiDoc XRS化学发光成像分析系统购自美国Bio-Rad公司,Step One Plus实时荧光定量PCR系统购自美国ABI公司。
1.2 方法
1.2.1 制备 CSE 2017年 6月—2018年 1月,参照DAMICO等[9]的实验方法制作负压吸引装置,制备本实验所需的CSE,具体如下:1支香烟包含焦油10.0 mg、尼古丁0.9 mg,使用50 ml针筒通过负压吸引装置将烟雾抽吸入盛有20 ml磷酸盐缓冲液(PBS)的密闭烧瓶内,持续抽吸3~5 min直至香烟燃尽。抽吸完毕后将溶液经0.22 μm孔径滤器过滤除菌,即得到浓度为100%的CSE原液,在CSE原液中加入DMEM培养基分别配制含1%、5%、10% CSE的DMEM培养基,配制好的培养基须在30 min内用于实验。
1.2.2 细胞培养 小鼠VSMCs由南京医科大学病理生理学系惠赠,使用含10%胎牛血清的DMEM培养基于37 ℃、含5%二氧化碳(CO2)的细胞培养箱中常规培养。采用0.25%胰酶消化传代,取10代以内生长状态良好的对数期细胞进行实验。
1.2.3 实验分组 (1)将实验细胞分为不同浓度CSE诱导组,其中空白组使用不含CSE的DMEM培养基培养12 h,低浓度组、中浓度组、高浓度组分别于含1%、5%、10% CSE的DMEM培养基培养12 h。(2)将实验细胞分为不同剂量普伐他汀预处理组,其中对照组使用不含普伐他汀的DMEM培养基培养12 h;低剂量组、中剂量组、高剂量组分别给予1 μM、10 μM、100 μM普伐他汀预处理2 h,然后使用含5% CSE的DMEM培养基培养12 h;部分实验设置阳性对照组,阳性对照组细胞给予4-PBA 2 mM预处理2 h,然后使用含5% CSE的DMEM培养基培养12 h。
1.3 流式细胞术 严格按照Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作,根据细胞凋亡时细胞膜内侧磷脂酰丝氨酸外翻于细胞膜外侧的原理分析细胞凋亡情况,具体如下:消化收集细胞后,调整细胞密度约为5×105个/ml,4℃、1 000 r/min离心5 min,预冷PBS漂洗细胞2次;弃上清,将细胞重悬于100 μl Binding Buffer,加入5 μl Annexin V-FITC和10 μl PI充分混匀,室温避光反应15 min,随后加入400 μl PBS,30 min内采用BD FACSCalibur流式细胞仪检测细胞凋亡率。
1.4 实时荧光定量 PCR 采用 Primer Premier 5.0 软件设计各目的基因及内参基因GAPDH的引物序列,由生工生物工程(上海)有限公司合成引物。各引物序列如下:Bcl-2正向引物:5'-CCAGGACGTCTCCTCTCAGG-3',反向引物:5'-AAGATGGTGATGGGCTTCCCG-3';Bax正向引物:5'-CGTGAGCG GCTGCTTGTCTG-3',反向引 物:5'-TGGTGAGCGAGGCGGTGAG-3';GRP78正向引物:5'-GCGTCGGTGTGTTCAAGAAC-3',反向引物:5'-AAGGGTCATTCCAAGTGCGT-3';Chop正向引物:5'-CCAACAGAGGTCACACGCACATC-3',反向引物:5'-TCGTTCTCCTGCTCCTTCTCCTTC-3';GAPDH正 向 引 物:5'-TGGCAAAGTGGAGATTGTTGCC-3',反向引物:5'-AAGATGGTGATGGGCTTCCCG-3'。参照总RNA提取试剂盒操作说明提取细胞总RNA,采用cDNA合成试剂盒合成cDNA,随后加入SYBR Green试剂并经Step One Plus实时荧光定量PCR系统检测分析,最后通过扩增曲线、溶解曲线及各目的基因CT值确认扩增反应。以GAPDH作为内参基因,采用2-∆∆CT法计算各目的基因mRNA相对表达量。
1.5 Western Blot 严格按照RIPA蛋白提取试剂盒说明书进行操作,每孔加入200 μl含1%蛋白酶抑制剂的RIPA蛋白裂解液,冰上充分裂解10 min后,4 ℃、12 000×g离心10 min,吸取上清。采用BCA蛋白定量试剂盒检测各目的蛋白浓度。将蛋白样本与5 X蛋白上样缓冲液混匀,煮沸10 min使蛋白充分变性,置于-20 ℃冰箱中保存。每孔总蛋白上样量为30 μg,使用10%聚丙烯酰胺凝胶电泳,蛋白电转至PVDF膜后5%脱脂奶粉封闭2 h。分别采用Bcl-2抗体(1:1 000)、Bax抗体(1:1 000)、GRP78抗体(1:1 000)、Chop抗体(1:1 000)和β-actin抗体(1:3 000)于4 ℃孵育过夜,次日用含0.1%吐温-20的PBS(简称PBST)溶液洗膜3次,对应的HRP标记二抗室温孵育1 h,PBST溶液洗膜3次后经ChemiDoc XRS化学发光成像分析系统检测各条带灰度值。以β-actin作为内参蛋白,各目的蛋白与内参蛋白灰度值比值即为目的蛋白相对表达量。
1.6 统计学方法 采用SPSS 20.0统计软件进行数据处理,计量资料以()表示,多组间比较采用单因素方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度CSE诱导组细胞凋亡率比较 流式细胞术检测结果显示,空白组细胞凋亡率为(6.13±1.71)%,低 浓 度 组 为(14.20±1.53)%, 中 浓 度 组 为(24.18±2.44)%,高浓度组为(30.64±2.52)%。不同浓度CSE诱导组细胞凋亡率比较,差异有统计学意义(F=80.11,P<0.05);低浓度组、中浓度组和高浓度组细胞凋亡率高于空白组,中浓度组和高浓度组细胞凋亡率高于低浓度组,高浓度组细胞凋亡率高于中浓度组,差异有统计学意义(P<0.05,见图1)。
矿粒在螺旋槽内分选主要受水流运动特性影响。在弱紊流作用下矿粒在螺旋溜槽内松散和分层。重颗粒集中在下层,并与槽体接触,在上部物料的压力下,其运动阻力大;而处在上部流动层的轻颗粒所受阻力较小,因此增大了上下层之间流动速度差。轻矿物颗粒位于纵向流速高的上层流中,所受离心力较大,同时受到横向环流给予的向外的流体动压力,这两种力的合力大于颗粒的重力分力和摩擦力,所以轻矿物颗粒向槽的外缘移动;与之相反重矿物颗粒富集于内缘。矿粒在螺旋面上的分带如图4所示[9]。
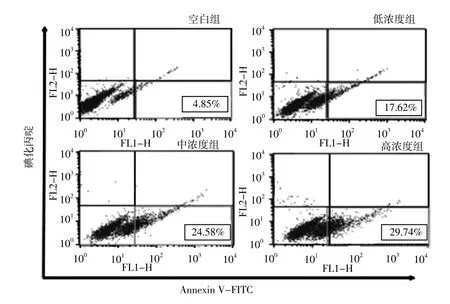
图1 不同浓度CSE诱导组流式细胞图Figure 1 Flow cytometry results of VSMCs with different induction concentrations of CSE
2.2 不同浓度CSE诱导组细胞凋亡相关蛋白表达情况比较 不同浓度CSE诱导组Bcl-2、Bax mRNA和蛋白相对表达量比较,差异有统计学意义(P<0.05)。低浓度组、中浓度组和高浓度组Bcl-2 mRNA和蛋白相对表达量低于空白组,中浓度组和高浓度组Bcl-2 mRNA和蛋白相对表达量低于低浓度组,高浓度组Bcl-2蛋白相对表达量低于中浓度组,差异有统计学意义(P<0.05);低浓度组、中浓度组和高浓度组Bax mRNA和蛋白相对表达量高于空白组,中浓度组和高浓度组Bax mRNA和蛋白相对表达量高于低浓度组,高浓度组Bax mRNA相对表达量高于中浓度组,差异有统计学意义(P<0.05,见表1)。
2.3 不同浓度CSE诱导组内质网应激(ERS)途径相关蛋白表达情况比较 不同浓度CSE诱导组GRP78、Chop mRNA和蛋白相对表达量比较,差异有统计学意义(P<0.05);低浓度组、中浓度组、高浓度组GRP78、Chop mRNA和蛋白相对表达量高于空白组,中浓度组、高浓度组GRP78、Chop mRNA和蛋白相对表达量高于低浓度组,高浓度组GRP78 mRNA、Chop蛋白相对表达量高于中浓度组,差异有统计学意义(P<0.05,见表 2)。
表1 不同浓度CSE诱导组细胞凋亡相关蛋白表达情况比较()Table 1 Comparisons of relative quantity expression of apoptosis-related protein of VSMCs with different induction concentration of CSE
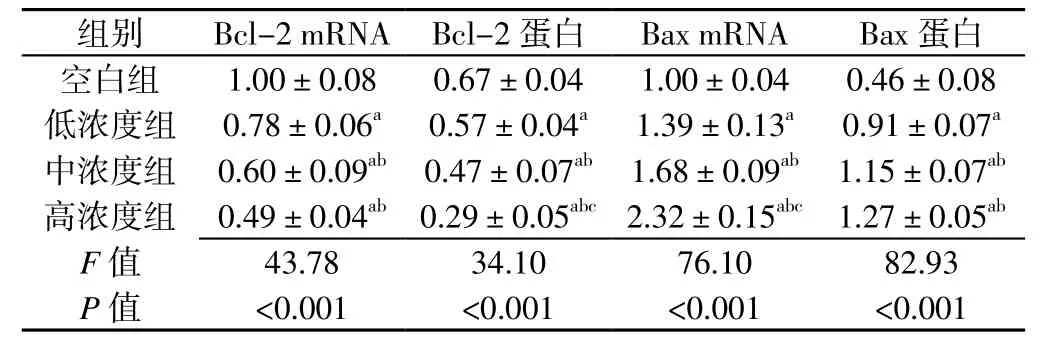
表1 不同浓度CSE诱导组细胞凋亡相关蛋白表达情况比较()Table 1 Comparisons of relative quantity expression of apoptosis-related protein of VSMCs with different induction concentration of CSE
注:与空白组比较,aP<0.05;与低浓度组比较,bP<0.05;与中浓度组比较,cP<0.05
?
表2 不同浓度CSE诱导组ERS途径相关蛋白表达情况比较()Table 2 Comparisons of relative quantity expression ERS pathway related proteins of VSMCs with different induction concentration of CSE
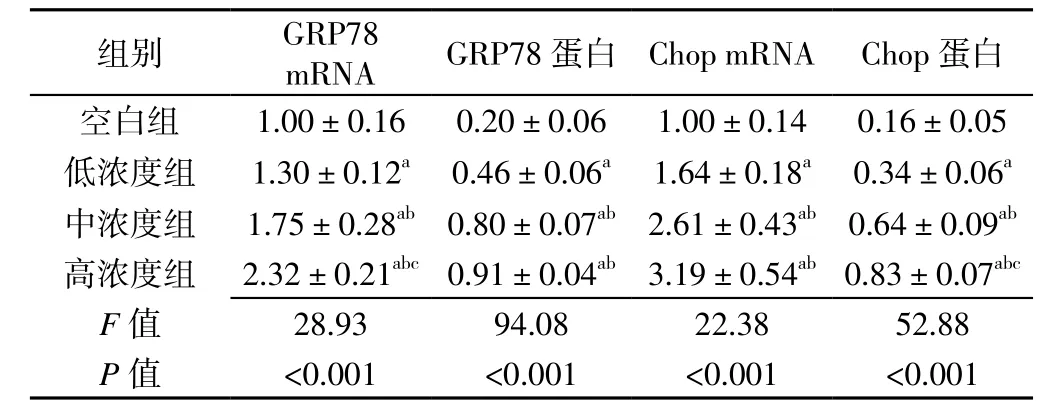
表2 不同浓度CSE诱导组ERS途径相关蛋白表达情况比较()Table 2 Comparisons of relative quantity expression ERS pathway related proteins of VSMCs with different induction concentration of CSE
注:与空白组比较,aP<0.05;与低浓度组比较,bP<0.05;与中浓度组比较,cP<0.05
?
2.4 不同剂量普伐他汀预处理组细胞凋亡率比较流式细胞术检测结果显示,对照组细胞凋亡率为(26.63±1.92)%,低剂量组为(21.31±2.25)%,中剂量组为(16.51±2.43)%,高剂量组为(22.67±1.37)%。不同浓度CSE诱导组细胞凋亡率比较,差异有统计学意义(F=80.11,P<0.05);低剂量组、中剂量组、高剂量组细胞凋亡率低于对照组,中剂量组细胞凋亡率低于低剂量组和高剂量组,差异有统计学意义(P<0.05,见图2)。
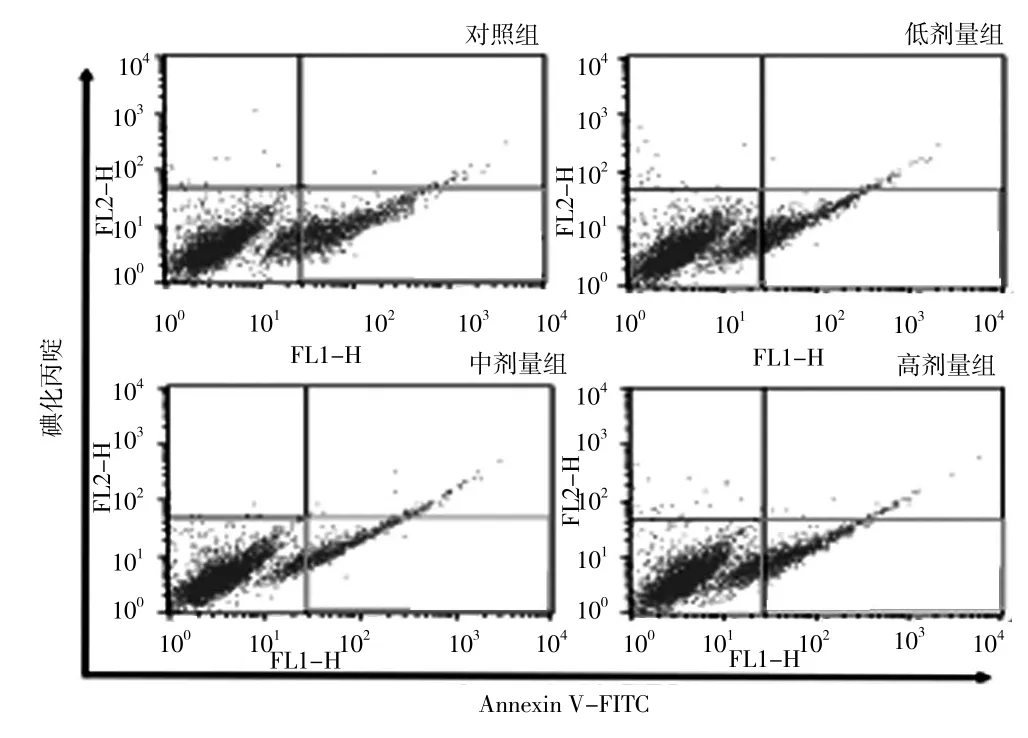
图2 不同剂量普伐他汀预处理组流式细胞图Figure 2 Flow cytometry results of VSMCs with different doses of prevastatin pretreatment
2.5 不同剂量普伐他汀预处理组细胞凋亡相关蛋白表达情况比较 不同剂量普伐他汀预处理组Bcl-2和Bax蛋白相对表达量比较,差异有统计学意义(P<0.05);低剂量组、中剂量组、高剂量组Bcl-2蛋白相对表达量高于对照组,Bax蛋白相对表达量低于对照组,差异有统计学意义(P<0.05);中剂量组Bax蛋白相对表达量低于低剂量组和高剂量组,差异有统计学意义(P<0.05,见表3)。
表3 不同剂量普伐他汀预处理组细胞凋亡相关蛋白表达情况比较()Table 3 Comparisons of relative quantity expression of apoptosis-related protein of VSMCs with different doses of prevastatin pretreatment
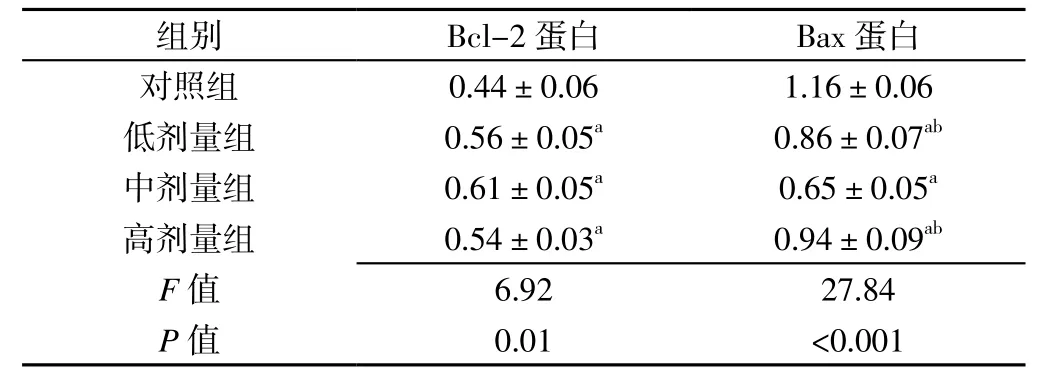
表3 不同剂量普伐他汀预处理组细胞凋亡相关蛋白表达情况比较()Table 3 Comparisons of relative quantity expression of apoptosis-related protein of VSMCs with different doses of prevastatin pretreatment
注:与对照组比较,aP<0.05;与中剂量组比较,bP<0.05
?
2.6 不同剂量普伐他汀预处理组ERS途径相关蛋白表达情况比较 不同剂量普伐他汀预处理组GRP78、Chop蛋白相对表达量比较,差异有统计学意义(P<0.05);阳性对照组、低剂量组、中剂量组、高剂量组GRP78和Chop蛋白相对表达量低于对照组,低剂量组、中剂量组、高剂量组GRP78蛋白相对表达量低于阳性对照组,中剂量组GRP78蛋白相对表达量低于低剂量组、Chop蛋白相对表达量低于阳性对照组,差异有统计学意义(P<0.05,见表 4)。
表4 不同剂量普伐他汀预处理组ERS途径相关蛋白表达情况比较()Table 4 Comparisons of relative quantity expression of ERS pathway related proteins of VSMCs with different doses of prevastatin pretreatment

表4 不同剂量普伐他汀预处理组ERS途径相关蛋白表达情况比较()Table 4 Comparisons of relative quantity expression of ERS pathway related proteins of VSMCs with different doses of prevastatin pretreatment
注:与对照组比较,aP<0.05;与阳性对照组比较,bP<0.05;与低剂量组比较,cP<0.05
?
3 讨论
VSMCs是维持血管稳态最主要的细胞,其功能异常可促进AS等慢性炎性疾病发生发展,但既往研究主要集中在VSMCs增殖、迁移及表型转化等病理生理机制。近年研究表明,VSMCs凋亡在心肌梗死、脑卒中、肺动脉高压等发生发展中均具有重要作用[10-12]。凋亡的VSMCs可在局部组织释放白介素1β(IL-1β)和白介素6(IL-6)等细胞因子,引发炎性反应,促进易损斑块和坏死核心形成,加速血管衰老及钙化形成[13-14],直接或间接导致血管稳态失衡,可能参与AS的发生发展[15-16]。
吸烟是公认的心血管疾病独立危险因素,也是肺部疾病的重要致病因素。香烟暴露能引起炎性反应、氧化应激和补体激活等病理生理改变,还可直接导致肺上皮细胞凋亡[9,17]。YANG等[18]研究发现,CSE可通过多种细胞机制促进AS形成、发展,包括氧化应激、脂质紊乱及血管炎症等。本研究通过CSE模拟香烟暴露对VSMCs凋亡的影响,结果显示,低浓度组、中浓度组和高浓度组细胞凋亡率及Bax mRNA、蛋白相对表达量高于空白组,Bcl-2 mRNA和蛋白相对表达量低于空白组;中浓度组和高浓度组细胞凋亡率及Bax mRNA、蛋白相对表达量高于低浓度组,Bcl-2 mRNA和蛋白相对表达量低于低浓度组;高浓度组细胞凋亡率和Bax mRNA相对表达量高于中浓度组,Bcl-2蛋白相对表达量低于中浓度组;提示CSE可诱导小鼠VSMCs凋亡,下调具有抗凋亡作用的Bcl-2 mRNA和蛋白表达,上调具有促凋亡作用的Bax mRNA和蛋白表达,且呈浓度依赖性。既往研究表明,各种原因所致细胞内外环境紊乱均可引发ERS,其中GRP78和Chop是ERS标志信号分子,Chop表达上调可激活Bcl-2蛋白家族,而后者能促进线粒体依赖细胞凋亡,进而参与AS形成[19]。本研究结果显示,低浓度组、中浓度组、高浓度组GRP78、Chop mRNA和蛋白相对表达量高于空白组,中浓度组、高浓度组GRP78、Chop mRNA和蛋白相对表达量高于低浓度组,高浓度组GRP78 mRNA、Chop蛋白相对表达量高于中浓度组,提示CSE作用于VSMCs后可上调ERS标志信号分子GRP78和Chop表达,且呈浓度依赖性,故笔者推测香烟暴露可能通过ERS途径诱导VSMCs凋亡。
他汀类药物除具有较强的调脂作用外,还具有抗炎、抗血栓、抗氧化应激等多重作用。LI等[20]研究发现,阿托伐他汀可降低小鼠血管组织中血管紧张素Ⅱ诱导的GRP78、Chop表达及TUNEL染色阳性凋亡细胞数量。体外实验结果显示,血管紧张素Ⅱ可介导ERS途径的VSMCs和巨噬细胞凋亡,而辛伐他汀可部分抑制上述过程,表现为Chop、Caspase 12、GRP78等蛋白表达降低。ZHANG等[21]研究结果显示,瑞舒伐他汀可有效降低移植到小鼠心脏的脂肪源性间充质干细胞凋亡率,上调Bcl-xL和Bcl-2等抗凋亡蛋白表达,并下调Bim和Bax等促凋亡蛋白表达,提示他汀类药物可能在多种组织细胞中具有抗凋亡作用。但也有研究显示,他汀类药物在肿瘤细胞中具有促凋亡作用[22-23],提示他汀类药物对细胞凋亡的保护作用可能与细胞凋亡诱导因素、他汀类药物种类及细胞类型等有关[24]。本研究结果显示,低剂量组、中剂量组、高剂量组细胞凋亡率低于对照组,中剂量组细胞凋亡率低于低剂量组和高剂量组;低剂量组、中剂量组、高剂量组Bcl-2蛋白相对表达量高于对照组,Bax蛋白相对表达量低于对照组;中剂量组Bax蛋白相对表达量低于低剂量组和高剂量组;提示普伐他汀预处理可有效降低CSE诱导的小鼠VSMCs凋亡率、上调抗凋亡蛋白Bcl-2表达及下调促凋亡蛋白Bax表达,且采用10 μM普伐他汀预处理的抗凋亡作用最佳。本研究结果还显示,阳性对照组、低剂量组、中剂量组、高剂量组GRP78和Chop蛋白相对表达量低于对照组,低剂量组、中剂量组、高剂量组GRP78蛋白相对表达量低于阳性对照组,中剂量组GRP78蛋白相对表达量低于低剂量组、Chop蛋白相对表达量低于阳性对照组;提示普伐他汀预处理可下调ERS标志信号分子GRP78和Chop蛋白的表达,推测他汀类药物抗细胞凋亡作用可能与调控ERS信号途径有关。
作者贡献:王大新进行实验设计,论文审校并对文章负责;廖思聪进行实验实施,资料收集整理,负责撰写论文;祁春雷进行实验评估,数据统计分析。
本文无利益冲突。
参考文献
[1]BENNETT M R,SINHA S,OWENS G K.Vascular Smooth Muscle Cells in Atherosclerosis[J].Circ Res,2016,118(4):692-702.
[2]KOJIMA Y,VOLKMER J P,MCKENNA K,et al.CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis[J].Nature,2016,536(7614):86-90.
[3]MARTINET W,SCHRIJVERS D M,DE MEYER G R.Necrotic cell death in atherosclerosis[J].Basic Res Cardiol,2011,106(5):749-760.DOI:10.1007/s00395-011-0192-x.
[4]TUCKA J,YU H,GRAY K,et al.Akt1 regulates vascular smooth muscle cell apoptosis through FoxO3a and Apaf1 and protects against arterial remodeling and atherosclerosis[J].Arterioscler Thromb Vasc Biol,2014,34(11):2421-2428.DOI:10.1161/ATVBAHA.114.304284.
[5]MESSNER B,BERNHARD D.Smoking and cardiovascular disease:mechanisms of endothelial dysfunction and early atherogenesis[J].Arterioscler Thromb Vasc Biol,2014,34(3):509-515.DOI:10.1161/ATVBAHA.113.300156.
[6]PROCHASKA J J,BENOWITZ N L.Smoking cessation and the cardiovascular patient[J].Curr Opin Cardiol,2015,30(5):506-511.DOI:10.1097/HCO.0000000000000204.
[7]OESTERLE A,LAUFS U,LIAO J K.Pleiotropic Effects of Statins on the Cardiovascular System[J].Circ Res,2017,120(1):229-243.DOI:10.1161/CIRCRESAHA.116.308537.
[8]周运东.不同剂量阿托伐他汀对高血压患者颈动脉硬化斑块的影响[J].实用心脑肺血管病杂志,2014,22(8):51-52.DOI:10.3969/j.issn.1008-5971.2014.08.020.
[9]DAMICO R,SIMMS T,KIM B S,et al.p53 mediates cigarette smoke-induced apoptosis of pulmonary endothelial cells:inhibitory effects of macrophage migration inhibitor factor[J].Am J Respir Cell Mol Biol,2011,44(3):323-332.DOI:10.1165/rcmb.2009-0379OC.
[10]LIU B,ZHANG Y H,JIANG Y,et al.Gadd45b is a novel mediator of neuronal apoptosis in ischemic stroke[J].Int J Biol Sci,2015,11(3):353-360.DOI:10.7150/ijbs.9813.
[11]DROMPARIS P,PAULIN R,STENSON T H,et al.Attenuating endoplasmic reticulum stress as a novel therapeutic strategy in pulmonary hypertension[J].Circulation,2013,127(1):115-125.DOI:10.1161/CIRCULATIONAHA.112.133413.
[12]LUO K Q,LONG H B,XU B C.Reduced apoptosis after acute myocardial infarction by simvastatin[J].Cell Biochem Biophys,2015,71(2):735-740.DOI:10.1007/s12013-014-0257-1.
[13]LACOLLEY P,REGNAULT V,NICOLETTI A,et al.The vascular smooth muscle cell in arterial pathology:a cell that can take on multiple roles[J].Cardiovasc Res,2012,95(2):194-204.DOI:10.1093/cvr/cvs135.
[14]ZHU Q,GUO R,LIU C,et al.Endoplasmic Reticulum Stress-Mediated Apoptosis Contributing to High Glucose-Induced Vascular Smooth Muscle Cell Calcification[J].J Vasc Res,2015,52(5):291-298.DOI:10.1159/000442980.
[15]LIBBY P,BORNFELDT K E,TALL A R.Atherosclerosis:Successes,Surprises,and Future Challenges[J].Circ Res,2016,118(4):531-534.DOI:10.1161/CIRCRESAHA.116.308334.
[16]景怡,蔡丹凤,林超,等.慢性内质网应激诱导的凋亡在动脉粥样硬化斑块形成中的作用[J].中国动脉硬化杂志,2017,25(9):957-962.DOI:10.3969/j.issn.1007-3949.2017.09.019.
[17]KUNCHITHAPAUTHAM K,ATKINSON C,ROHRER B.Smoke exposure causes endoplasmic reticulum stress and lipid accumulation in retinal pigment epithelium through oxidative stress and complement activation[J].J Biol Chem,2014,289(21):14534-14546.DOI:10.1074/jbc.M114.564674.
[18]YANG H L,KORIVI M,CHEN C H,et al.Antrodia camphorata attenuates cigarette smoke-induced ROS production,DNA damage,apoptosis,and inflammation in vascular smooth muscle cells,and atherosclerosis in ApoE-deficient mice[J].Environ Toxicol,2017,32(8):2070-2084.DOI:10.1002/tox.22422.
[19]THORP E,LI G,SEIMON T A,et al.Reduced apoptosis and plaque necrosis in advanced atherosclerotic lesions of Apoe-/- and Ldlr-/- mice lacking CHOP[J].Cell Metab,2009,9(5):474-481.DOI:10.1016/j.cmet.2009.03.003.
[20]LI Y,LU G,SUN D,et al.Inhibition of endoplasmic reticulum stress signaling pathway:A new mechanism of statins to suppress the development of abdominal aortic aneurysm[J].PLoS One,2017,12(4):e174821.DOI: 10.1371/journal.pone.0174821.
[21]ZHANG Z,LI S,CUI M,et al.Rosuvastatin enhances the therapeutic efficacy of adipose-derived mesenchymal stem cells for myocardial infarction via PI3K/Akt and MEK/ERK pathways[J].Basic Res Cardiol,2013,108(2):333.DOI:10.1007/s00395-013-0333-5.
[22]LEE S K,KIM Y S.Phosphorylation of eIF2alpha attenuates statininduced apoptosis by inhibiting the stabilization and translocation of p53 to the mitochondria[J].Int J Oncol,2013,42(3):810-816.
[23]LEE J,HONG E M,JANG J A,et al.Simvastatin Induces Apoptosis and Suppresses Insulin-Like Growth Factor 1 Receptor in Bile Duct Cancer Cells[J].Gut Liver,2016,10(2):310-317.DOI:10.5009/gnl15195.
[24]YOON J S,LEE H W.Diabetogenic effect of statins: a doubleedged sword?[J].Diabetes Metab J,2013,37(6):415-422.DOI:10.4093/dmj.2013.37.6.415.

