干扰MITF表达对恶性黑素瘤细胞B16F10增殖及黑素生成的影响*
陈恒君,田超群,杨钰兴,袁睿(重庆市渝北区人民医院:.皮肤科;.泌尿外科400)
恶性黑素瘤是由皮肤、黏膜、眼等色素沉着部位的黑素细胞产生的一种高度恶性肿瘤,其特点为生长隐匿、转移早且迅速,患者预后差及病死率高,致死率达79.0%[1⁃3]。目前,已确定小眼畸形相关转录因子(MITF)在黑素细胞和黑素瘤细胞核中高表达[4⁃5],是核蛋白最重要的转录因子,具有较强的诊断灵敏度和特异性[6⁃7],但相关机制研究较少。本研究采用RNA干扰技术,研究了MITF对恶性黑素瘤的生长及黑素生成能力的影响,试图为恶性黑素瘤的治疗提供新的思路和策略,现报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株 pLKO.1⁃短发夹RNA(shRNA)载体。
1.1.2 细胞系 B16F10黑素瘤细胞系购自KeyGen公司。细胞生长基质(培养液 1)为 RPMI⁃1640、10% 胎牛血清。细胞培养箱条件为37℃及5%二氧化碳。
1.1.3 主要试剂 RPMI⁃1640、10%胎牛血清均购自HyClone公司;mRNA提取试剂盒Trizol Reagent、逆转录试剂盒 PrimeScript™RT reagent Kit、扩增试剂盒SYBR Green RT⁃PCR Kit均购自 TaKaRa公司;蛋白抽提试剂盒、蛋白质印迹跑胶试剂盒、聚偏氟乙烯(PVDF)膜、蛋白质印迹显影ECL化学发光试剂盒、Tri⁃ton⁃X100、MTT细胞活性检测试剂盒均购自Beyotime公司;蛋白定量试剂盒采用Pierce®BCA Protein Assay Kit,购自Thermo Scientific公司;免疫组织化学试剂盒购自博士德公司;MITF、β⁃actin蛋白抗体均购自Santa公司;DNA Marker、RNA Marker、LipofectamineTM2000均购自Invitrogen公司;嘌呤霉素购自Sigma公司;MITF⁃shRNA质粒由KeyGen公司构建,并根据片段不同分别标注为 B16F10⁃NC(空白质粒对照)、B16F10⁃1、B16F10⁃2、B16F10⁃3,另建立未用任何质粒转染的阴性对照(B16F10组)。
1.2 方法
1.2.1 构建稳定干扰MITF表达的B16F10细胞系 将对数生长期B16F10细胞系传代并过夜(约24 h)培养,按标准流程,使用LipofectamineTM2000将扩增的shR⁃NA质粒中MITF沉默片段转染该细胞系。48 h后,使用添加嘌呤霉素(4µg/mL)的细胞培养液(培养液2)继续培养转染细胞系2周(每2~3天更换1次培养液2),将存活细胞单克隆移至96孔板中并使用培养液2继续培养,直至转染细胞系呈对数期生长并达90%以上的汇合率时将孔中细胞转移至培养瓶中使用培养液3(嘌呤霉素降至2µg/mL)继续培养并大规模传代以收集细胞系进行研究。每传代5~7次时再次使用培养液2进行筛选。
1.2.2 RNA提取及实时荧光定量聚合酶链反应(PCR)检测MITF基因表达 按说明书使用Trizol Reagent提取总RNA,用分光光度仪(A260/280)测定总RNA,并按说明书使用PrimeScript™RT reagent Kit制备cDNA。MITF上游引物:5′⁃CGGGTCTCTGCTCTCCAGA⁃3′,下游引物:5′⁃CCGGCTGCTTGTTTTGGAA⁃3′。按下述方法配置 25µL 反应液:(1)SYBR®Premix Ex TaqTM Ⅱ(2×)12.5 µL;(2)PCR 上游引物(10 µmol/L)1 µL;(3)PCR下游引物(10 µmol/L)1 µL;(4)DNA 模板 2 µL(<100 ng,且液体量不超过反应液总体积的10%);(5)dH2O 8.5µL。扩增反应条件:(1)预变性为 95℃、30 s,1次;(2)PCR 反应为 95 ℃、5 s,60 ℃、30 s,40 次;(3)溶解。1.2.3 蛋白提取及蛋白质印迹检测MITF蛋白表达 收集对数生长期细胞,在4℃条件下使用蛋白抽提试剂盒裂解细胞并收集蛋白;使用Pierce®BCA Protein Assay Kit按标准流程测定收集的总蛋白。根据测定结果按40µg的总蛋白量加样、检测、跑胶、转膜及显影。图像采集使用化学成像系统(ChemiDoc XRS+,Bio⁃Rad,USA)。图像分析采用Quantity One4.6软件。内参使用β⁃actin蛋白。
1.2.4 黑素含量测定 (1)细胞外分泌黑素含量测定:使用不含酚红的培养基在常规条件下培养细胞24 h并收集培养基(溶液1);(2)细胞内分泌黑素含量测定:收集上述去除培养基的细胞,使用蛋白抽提试剂盒提取蛋白,离心500 r/min,上清液(溶液3)进行总蛋白测定,收集下层黑色固体物质与1 mol/L的NaOH溶液在60℃条件下孵育2 h并充分溶解(溶液2)。使用分光光度计在405 nm处测定黑素溶液1及溶液2中黑素含量。按每种细胞蛋白浓度标准化每种细胞内外黑素含量[8]。
1.2.5 酪氨酸酶(TYR)活性及 TYR/TYR⁃1/TYR⁃2蛋白检测 按下述方法配置溶液:(1)溶液A,配制含2%N,N⁃二甲基甲酰胺的磷酸钠(100 mmol/L,pH 7.1);(2)溶液 B,配制含 5 mmol/LL⁃左旋多巴的磷酸钠(100 mmol/L,pH 7.1);(3)溶液 C,配制含 20 mmol/L 的酚试剂去离子水。在细胞中加入0.5%Triton⁃X100(含1%脱氧胆酸钠)并孵育2 h裂解细胞,再按2∶1∶1比例加入溶液A、B、C,在37℃条件下反应10 min,然后在分光光度计下测定505 nm处吸光度。与1.2.4项相同,按每种细胞蛋白浓度标准化每种细胞的蛋白含量。
1.2.6 细胞增殖活性检测(克隆形成实验、MTT实验) 取对数生长期细胞并计数,按每孔500个细胞接种于96孔板中(每种细胞重复5个孔),加入培养基并在细胞培养箱中培养48 h,加入MTT溶液(5 mg/mL)10µL,继续在细胞培养箱中孵育4 h,再加入甲臜溶解液100µL后继续在细胞培养箱中孵育,直至结晶全部溶解,最后使用分光光度计测定570 nm处吸光度。
1.3 统计学处理 应用SPSS18.0统计软件进行数据分析,组间和组内比较采用单因素方差分析(One⁃Way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 各组MITF基因及蛋白表达水平比较 与B16F10组比较,B16F10⁃1组MITF基因干扰效率最大(达82.7%),B16F10⁃2、B16F10⁃3 组 MITF 基因干扰效率分别为 62.3%、21.5%;B16F10⁃1、B16F10⁃2、B16F10⁃3 组基因表达水平与B16F10组比较,差异均有统计学意义(P<0.05)。见图1。与 B16F10 组比较,B16F10⁃1 组MITF蛋白表达水平最低,干扰效率最高(50.0%),B16F10⁃2、B16F10⁃3 组蛋白表达干扰率分别为 22.1%、11.6%;B16F10⁃1 、B16F10⁃2、B16F10⁃3 组基因表达水平与B16F10组比较,差异均有统计学意义(P<0.05),与MITF基因表达水平基本一致。见图2。表明B16F10⁃1为首选目标细胞系,其次为B16F10⁃2。

图1 各组MITF基因表达水平比较
2.2 各组增殖活性比较 与B16F10组比较,B16F10⁃NC组细胞增殖活性无明显改变,差异无统计学意义(P>0.05);B16F10⁃1组细胞增殖活性降低最明显(达49.5%),B16F10⁃2组细胞增殖活性也有所降低(达23.8%);B16F10⁃1、B16F10⁃2 组细胞增殖活性与 B16F10 组比较,差异均有统计学意义(P<0.05),见图3。
2.3 各组细胞内外黑素含量比较 B16F10⁃1组细胞内外黑素含量降低最明显(分别为49.7%、43.8%),B16F10⁃2组细胞内外黑素含量降低程度分别为21.4%、16.8%;B16F10⁃1、B16F10⁃2 组细胞内外黑素含量与B16F10组比较,差异均有统计学意义(P<0.05),但B16F10⁃NC组细胞内外黑素含量均无明显改变,与B16F10组比较,差异无统计学意义(P>0.05),与MITF基因和蛋白表达趋势一致,见图4。

图2 各组MITF蛋白表达水平比较
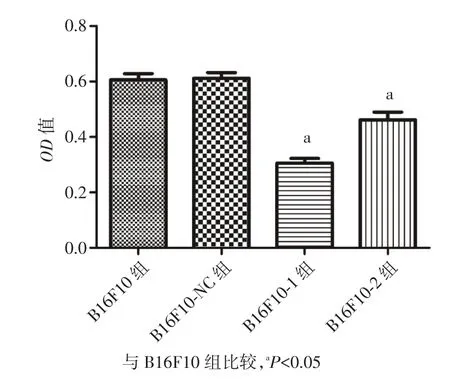
图3 各组增殖活性比较

图4 各组细胞内外黑素含量比较
2.4 各组TYR活性比较 与B16F10组比较,B16F10⁃1组TYR活性降低最明显(达48%),B16F10⁃2组TYR活性降低了 29.0%,B16F10⁃1、B16F10⁃2 组 TYR 活性与B16F10组比较,差异均有统计学意义(P<0.05),见图5。

图5 各组TYR活性比较
3 讨 论
目前,已确定MITF选择性表达于黑素细胞和黑素瘤细胞核,是黑素细胞的核蛋白和最重要的转录因子,在黑素细胞生成和活性方面具有关键性作用。目前,已证实该基因在黑素细胞起源细胞(如黑素母细胞、黑素细胞及黑素瘤细胞)中参与了形态、分化和生存的调节[7,9];而在黑素瘤患者中该基因处于失调状态[6],是一种诊断黑素瘤灵敏度和特异性均较强的免疫标记物[7]。
MITF在黑素细胞中特异表达,是调节黑素细胞发育的关键转录因子和总调控因子,参与了黑素细胞形态构成、黑素合成、转运和运输。MITF主要通过调控黑素细胞中特异表达基因TYR的转录活性调节黑素分泌,TYR参与并调控黑素合成,是黑素生成的关键酶[10]。
本研究以MITF为靶基因,利用RNA干扰技术特异性抑制该基因及蛋白表达,观察B16F10黑素瘤细胞增殖活性变化,进而探讨MITF对黑素瘤细胞内外黑素分泌水平的影响及与该分泌水平密切相关的TYR活性的影响,从而验证MITF高表达在黑素瘤细胞中的关键作用。结果显示,RNA干扰技术能在B16F10细胞中显著抑制MITF基因及蛋白表达,最高干扰率分别达82.7%、50.0%;MTT实验结果显示,干扰MITF表达能显著抑制B16F10细胞增殖活性,表明MITF对黑素瘤细胞增殖活性具有重要作用。与VACHTENHEIM等[11]研究结果一致。本研究B16F10细胞内外黑素含量测定结果显示,干扰MITF表达能显著抑制黑素瘤细胞内外黑素分泌水平;TYR活性测定结果显示,干扰MITF表达也抑制了与黑素分泌水平密切相关的TYR的活性,表明MITF对黑素瘤细胞中的TYR活性及黑素生成均具有重要作用,与黑素瘤细胞中的黑素功能密切相关。
目前,较一致的看法是MITF在黑素细胞的黑素生成和活性方面均具有关键性作用。本研究结果不仅证明了MITF对黑素瘤细胞的增殖具有重要作用,更进一步证明了MITF在黑素瘤细胞黑素生成及活性调节方面发挥了关键性作用。为了更深入的研究,包括MITF如何调节黑素瘤细胞的增殖活性及黑素生成的活性,以及上、下游基因和相关信号通路等研究奠定了重要的实验基础,从而为恶性黑素瘤的治疗提供了新的思路和策略。
参考文献
[1]VERRAS M,SUN Z.Roles and regulation of Wnt signaling and beta⁃catenin in prostate cancer[J].Cancer Lett,2006,237(1):22⁃32.
[2]CHUNG ES,SABEL MS,SONDAK VK.Current state of treatment for primary cutaneous melanoma[J].Clin Exp Med.2004.4(2):65⁃77.
[3]BALCHCM,BUZAIDAC,ATKINSMB,etal.A new American Joint Com⁃mittee on Cancer staging system for cutaneous melanoma[J].Cancer,2000,88(6):1484⁃1491.
[4]BUSAM KJ,KUCUKGÖL D,SATO E,et al.Immunohistochemical analy⁃sis of novel monoclonal antibody PNL2 and comparison with other mela⁃nocytedifferentiationmarkers[J].AmJSurgPathol,2005,29(3):400⁃406.
[5]O′REILLY FM,BRAT DJ,MCALPINE BE,et al.Microphthalmia tran⁃scription factor immunohistochemistry:a useful diagnostic marker in the diagnosis and detection of cutaneous melanoma,sentinel lymph node metastases,and extracutaneous melanocytic neoplasms[J].J Am Acad Dermatol,2001,45(3):414⁃419.
[6]CHELI Y,OHANNA M,BALLOTTI R,et al.Fifteen⁃year quest for mi⁃crophthalmia⁃associated transcription factor target genes[J].Pigment Cell Melanoma Res,2010,23(1):27⁃40.
[7]KING R,GOOGE PB,WEILBAECHER KN,et al.Microphthalmia tran⁃scription factor expression in cutaneous benign,malignant melanocytic,and nonmelanocytic tumors[J].Am J Surg Pathol,2001,25(1):51⁃57.
[8]KIM HJ,KIM JS,WOO JT,et al.Hyperpigmentation mechanism of methyl 3,5⁃di⁃caffeoylquinate through activation of p38 and MITF induc⁃tion of tyrosinase[J].Acta Biochim Biophys Sin(Shanghai),2015,47(7):548⁃456.
[9]DENAT L,LARUE L.Malignant melanoma and the role of the paradoxal protein Microphthalmia transcription factor[J].Bull Cancer,2007,94(1):81⁃92.
[10]BERTOLOTTO C,BUSCÀ R,ABBE P,et al.Different cis⁃acting ele⁃ments are involved in the regulation of TRP1 and TRP2 promoter activi⁃ties by cyclic AMP:pivotal role of M boxes(GTCATGTGCT)and of mi⁃crophthalmia[J].Mol Cell Biol,1998,18(2):694⁃702.
[11]VACHTENHEIM J,ONDRUŠOVÁ L.Microphthalmia⁃associated tran⁃scription factor expression levels in melanoma cells contribute to cell in⁃vasion and proliferation[J].Exp Dermatol,2015,24(7):481⁃484.

