Fonsecaea monophora黑素的理化性质及其合成途径的分析研究
陈映丹 陆春 李美荣 马寒 尹颂超 郑智心 李海仪 席丽艳 冯佩英
(1.广州市中山大学附属第三医院皮肤科,广州 510630;2.广州市中山大学孙逸仙纪念医院皮肤科,广州 510120)
Fonsecaea monophora黑素的理化性质及其合成途径的分析研究
目的 探讨Fonsecaeamonophora黑素的理化性质及其合成途径。方法 通过化学分析、紫外光谱、红外光谱和电子顺磁共振波谱等明确F.monophora黑素的理化性质;通过比对F.monophora菌株在基础培养基 (马铃薯葡萄糖琼脂 (PDA)培养基、L-DOPA PDA培养基)和含黑素抑制剂培养基 (DOPA黑素抑制剂培养基、DHN黑素抑制剂培养基)的菌落生长情况,采用BioTek酶标仪EON定量分析其黑素合成,以明确F.monophora的黑素合成途径。结果F.monophora黑素与合成L-DOPA黑素的理化性质相似;菌株在含L-DOPA培养基较PDA培养基产生更多的黑素,且在含DOPA黑素抑制剂叠氮化钠及DHN黑素抑制剂苯肽、三环唑培养基中其黑素合成均明显降低。结论F.monophora黑素主要为L-DOPA黑素,可能共同存在DOPA黑素和DHN黑素合成途径。
Fonsecaeamonophora;黑素;理化性质;合成途径
[Chin J Mycol,2017,12(3):129-134]
着色霉属是着色芽生菌病的主要致病菌属,主要包含4个致病菌种:裴氏着色霉、Fonsecaeamonophora、Fonsecaeanubica和Fonsecaeapugnacius[1]。分子流行病学显示[2],裴氏着色霉主要流行于中南美洲,而F.monophora和F.nubica分布于世界各地,而在我国南方地区着色芽生菌病病原菌F.monophora占75%,F.nubica占25%,尚未发现裴氏着色霉[3-4]。黑素是暗色真菌的重要毒力因子。Franzen等[5-6]研究发现裴氏着色霉分生孢子、菌丝和硬壳小体在体内、外均可合成黑素,主要为经DHN途径合成胞外可溶性和与胞壁结合的黑素。胞外的可溶性色素可刺激机体产生免疫保护性作用,增强中性粒细胞、巨噬细胞对菌体的吞噬能力及氧化杀伤效应[7],而胞壁上的黑素具有抵御H2O2及NO的氧化杀伤作用[8]。Fonsecaeamonophora与裴氏着色霉是否具有相同的黑素和功能?有研究显示同一菌属不同菌种间的黑素性质及合成途径存在差异,例如,黑曲霉、黄曲霉和溜曲霉 (Aspergillustamarii)经DOPA途径合成黑素,而土曲霉和塔宾曲霉 (Aspergillustubingensis)经DHN途径合成黑素[9]。本研究主要探讨F.monophora黑素性质及合成途径,将有助于阐明该菌在着色芽生菌病中的致病机制。
1 材料和方法
1.1 菌株和材料
本研究所用的F.monophora菌株CBS 122845分离自一男性着色芽生菌病患者手背皮损组织,经形态学和分子生物学鉴定[10],保存于中山大学孙逸仙医院医学真菌研究中心。
左旋多巴 (L-DOPA)、合成L-DOPA黑素、曲酸、苯肽、三环唑、叠氮化钠、二甲基亚砜 (DMSO)、吐温20均购自美国Sigma公司,硼酸、硼砂、一水柠檬酸和柠檬三钠均购自天津市大茂化学试剂厂,连二亚硫酸钠 (Na2S2O4)、30%过氧化氢 (H2O2)、次氯酸钠 (NAClO)等化学试剂均购自广州化学试剂厂。仪器有:DU-730紫外/可见分光光度计 (美国Beckman公司),连续波长酶标仪 (BioTek 酶标仪EON),傅里叶变换红外光谱仪 (美国FT-IR NICOLET 6700),电子顺磁共振 (electron paramagnetic resonance,EPR)波谱仪 (日本JEOL JES-FA200)。
1.2 方法
Fonsecaeamonophora黑素的提取与提纯 将F.monophora菌株转种于PDA平板培养基,培养7 d以活化。参考酵母细胞胞壁黑素粗提取方法[11]提取黑素。采用0.02 mol/L的柠檬酸盐缓冲液 (pH=7.0)重悬菌体,于121℃高温加热后,离心收集上清液,然后采用酸碱法进一步提纯黑素。
Fonsecaeamonophora黑素化学性质分析 参考Kumar等[12]研究方法分析黑素的化学性质,具体方法如下:
1)溶解试验:取提纯的F.monophora黑素、合成L-DOPA黑素各约2 mg分别放在盛有2 mL蒸馏水、1 mol/L盐酸、氢氧化钠、氢氧化钾、100 mmol/L硼酸盐缓冲液、DMSO和有机溶剂 (甲醇、乙醇、正丁醇、异戊醇、丙酮、乙腈、氯仿、乙酰乙酯、石油醚)中,充分混匀,观察溶液颜色及黑素溶解性。
2)氧化还原性:将提纯的F.monophora黑素按1∶9比例分别与10%NaClO、30%H2O2和5%Na2S2O4充分混匀,观察溶液的颜色变化。
Fonsecaeamonophora黑素光谱分析
1)紫外-可见光谱分析:参考Sajja等[13]研究方法,使用100 mmol/L的硼酸盐缓冲液配制提纯黑素为100 μg/mL的基础黑素溶液,分别按1∶1、1∶2、1∶3的比例稀释后在紫外分光光度计190~900 nm波长下进行连续扫描。
2)红外光谱分析:取干燥的F.monophora黑素、合成L-DOPA黑素分别与干燥溴化钾混匀研磨压片后,在波长4 000~400 cm-1进行红外光谱扫描。
3)EPR测定:参考Liu等[14]研究方法调制EPR波谱仪参数如下:调制频率,100.0 kHz;调制幅度,1.000 G;微波功率,9.874321 GHz;微波频率,4.95 mw;中心磁场强度,3 513.320 G,扫描宽度,100 G;扫描时间,81.44 s。
Fonsecaeamonophora黑素合成途径分析 真菌黑素主要通过DOPA黑素合成途径和DHN黑素合成途径进行,通过加入黑素合成前体 (L-DOPA)、DOPA黑素合成抑制剂 (曲酸和叠氮化钠)、DHN黑素合成抑制剂 (苯肽和三环唑),观察菌落、菌体色素改变和黑素含量变化,以明确F.monophora黑素合成途径。
1)培养基制备:将L-DOPA (1 mol/L盐酸溶解)、曲酸和叠氮化钠 (ddH2O溶解)、苯肽和三环唑 (0.5%无水乙醇溶解)分别加入高温灭菌后冷却至50℃的PDA培养基中,充分混匀,获取含浓度1 mmol/L L-DOPA、200 mg/L曲酸、0.05 mmol/L叠氮化钠、100 mg/L苯肽、100 mg/L三环唑的PDA培养基,静置冷却后4℃冰箱保存备用。PDA为L-DOPA、曲酸、叠氮化钠组和无水乙醇组的空白对照;含无水乙醇的PDA为苯肽组和三环唑组的空白对照。
2)培养:挑取约0.5 mg PDA斜面培养基上生长良好的菌落加入含0.1%吐温20的5 mL生理盐水中,充分混匀,采用无菌棉签将菌液均匀地涂布于上述制备的培养基,倒置于30℃恒温培养箱培养7 d,肉眼观察菌落和培养基颜色变化,光学显微镜下观察菌体结构和颜色改变。
3)Fonsecaeamonophora黑素的定量分析:同样采用上述细胞胞壁黑素粗提取方法提取各组培养基菌落黑素,以硼酸盐缓冲液配置100 μg/mL合成L-DOPA黑素溶液按比例稀释后酶标仪400 nm下制定标准曲线,然后根据各组标本的吸光度算出其含有的黑素总量,比较各组标本单位菌量的黑素含量。上述实验均重复3次。
统计学分析 应用SPSS 20.0统计软件进行分析,连续性变量符合正态分布的使用t检验,不符合的用Wilcoxon非参数检验,离散型变量采用卡方检验或Fisher精确概率检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 化学性质
提纯的F.monophora黑素与人工合成L-DOPA黑素理化性质相似。外观均为黑色颗粒,均不溶于水、酸及常见的有机溶液,但可溶于碱性溶液、硼酸盐缓冲液 (pH=8)及DMSO溶液,并均可被强氧化剂30%H2O2和10%NaClO漂白,还原剂Na2S2O4对黑素颜色无明显改变。
2.2Fonsecaeamonophora黑素光谱分析
紫外-可见分光光度计结果:按1∶1,1∶2,1∶3的比例稀释后F.monophora黑素溶液在紫外光区最大吸收峰分别为258 nm、231 nm、227 nm,在可见光区都有吸收,且随着波长的增大其吸收值逐渐降低 (见图1A)。三者在300~700 nm的吸光值取对数后对波长作图可以得到斜率分别为-0.003 20、-0.003 52、-0.003 38的拟合直线 (见图1B)。
红外光谱分析结果:F.monophora黑素与合成多巴黑素具有相似的红外光谱图 (见图1C、D)。二者均有黑素的两个特征吸收带:(1)在3 400~3 000 cm-1(3 μm)附近都存在强而宽的共轭吸收带,是由OH基团和吲哚的NH伸缩振动引起;(2)在1 660~1 600 cm-1(6 μm)附近有一强吸收带,是由芳香族的耦合双键C=C和C=O的伸缩振动引起,是定义黑素的特征性吸收峰。同时在1 750~1 700 cm-1、1 300~1 000 cm-1也有类似吸收带,前者是由游离羧基基团-COOH的C=O伸缩振动引起,后者是C-OH,OH变形振动及羧基振动所致。但是monophora着色霉黑素在2 913 cm-1、1 400 cm-1存在与合成多巴黑素不同的吸收峰,由CH2、CH3振动引起。
Fonsecaeamonophora黑素EPR分析F.monophora黑素的EPR图谱为对称的典型单线一次微商波谱 (见图1E)。
2.3Fonsecaeamonophora黑素的合成途径分析
如图2 (A~E (正面)/A1~E1 (反面))所示,肉眼观察F.monophora在含1 mmol/L L-DOPA培养基比在单纯PDA培养基中菌落及周围培养基产生更多的黑素;含0.05 mmol/L叠氮化钠培养基的菌落及周围培养基颜色变浅;含无水乙醇和200 mg/L曲酸的菌落及周围培养基颜色较空白对照PDA组未见明显变化。如图3 (A~C (正面)/A1~C1 (反面))在含100 mg/L苯肽和100 mg/L三环唑培养基的菌落及周围培养基颜色也较含无水乙醇的PDA明显变浅。
BioTek酶标仪EON定量分析各组黑素含量变化,结果显示L-DOPA组比单纯PDA组单位菌量黑素合成增多,叠氮化钠组较单纯PDA组单位菌量黑素合成明显减少,其含量差异均存在统计学意义 (P<0.05,见图4);苯肽组、三环唑组较其空白对照组单位菌量黑素合成减少,其差异存在统计学意义 (P<0.05,见图5)。无水乙醇组、曲酸组与空白对照组单位菌量黑素的含量差异无统计学意义 (P>0.05,见图4)。
3 讨 论
黑素是一类由多酚类或吲哚类异源多聚物聚合而成结构复杂的聚合体[15]。本研究结果显示,F.monophora色素与合成多巴黑素具有相似的理化性质,均为黑素颗粒,具有疏水性,可溶解于碱性溶液,耐酸,可被H2O2和NaClO等强氧化剂氧化脱色。紫外-可见光谱分析显示其在200~300 nm处有最大吸收峰,且在可见光区随着波长的增大其吸收值逐渐降低,这与黑素分子中含有很多复杂的共辄双键体系或芳环结构有关[13]。de Soares等[16]研究显示,裴氏着色霉菌丝和分生孢子的黑素在262 nm、271 nm、282 nm和293 nm紫外光谱处有高吸收峰。红外光谱分析显示F.monophora色素与合成多巴黑素在3 400~3 000 cm-1(3 μm)和1 660~1 600 cm-1(6 μm)附近都有特征性黑素吸收峰,且两者在860~650 cm-1范围内的吸收峰很弱,表明芳环被取代形成共轭体系[9]。但是F.monophora色素在2 913 cm-1与1 400 cm-1附近存在与合成多巴黑素不同的吸收峰,多由于脂肪族CH2、CH3振动引起[9],提示F.monophora黑素具有更多的脂肪族基团。该光谱结果与裴氏着色霉及其他临床暗色真菌 (例如疣状瓶霉、卡氏枝孢瓶霉和甄氏外瓶霉等)不一样。Corbellini等[17]研究发现裴氏着色霉的黑素在1 230~1 650 cm-1与2 800~3 000 cm-1附近出现高吸收峰。这可能与研究选择不同的培养基有关,研究者选用脂肪琼脂培养基,而本研究选用PDA培养基。黑素因含有稳定的自由基 (例如自由移动的π电子)而呈现有特征性EPR波谱,不同的真菌黑素具有半波长在4~7 eV和g值为2.003 6~2.004 2的信号[13,18]。裴氏着色霉和F.monophora黑素均具有对称的典型单线一次EPR微商波谱[8]。综合F.monophora提取黑素的化学性质、光谱分析等结果定性分析,证实F.monophora黑素具有黑素的一般共性,而从红外光谱分析结果可推断出所提取的黑素含有多巴黑素。
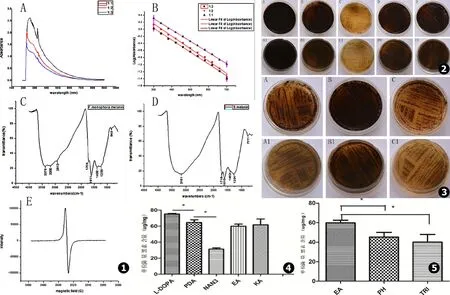
图1 A.F.monophora黑素的紫外可见光谱图 (3种浓度的黑素溶液在紫外光区200~300 nm之间均有最大吸收峰,随着波长的增大吸收值逐渐降低);B.3种浓度 (1∶3、1∶2、1∶1)的黑素溶液在300~700 nm的吸光值取对数后对波长作图可以得到3条斜率为负值的拟合直线,斜率分别为-0.003 38,-0.003 52,-0.003 20;C.F.monophora黑素红外光谱图;D.合成多巴黑素红外光谱图;E.F.monophora黑素的EPR图谱 图2 黑素的抑制试验结果 (A~E (正面)/A1~E1 (反面)依次为含1 mmol/L L-DOPA的PDA、空白对照PDA、含0.05 mmol/L叠氮化钠的PDA、含溶解DHN黑素抑制剂同等容量的无水乙醇的PDA和含200 mg/L曲酸的PDA) 图3 黑素的抑制试验结果 (A~C (正面)/A1~C1 (反面)依次为含100 mg/L苯肽的PDA、含溶解DHN黑素抑制剂同等容量的无水乙醇的PDA和含100 mg/L三环唑的PDA) 图4 黑素提取定量统计分析结果L-DOPA可使F.monophora黑素的合成增多;叠氮化钠可明显抑制F.monophora黑素的合成。“*”表示两组数值统计学有显著性差异 (P<0.05) 图5 黑素提取定量统计分析结果DHN黑素抑制剂苯肽 (PH)和三环唑 (TRI)均能抑制F.monophora黑素的合成。“*”表示两组数值统计学有显著性差异 (P<0.05)
Fig.1 A.UV-visible spectroscopic properties of melanin pigment.100 mg/L of melanin fromF.monophorawas diluted to 1∶1,1∶2 and 1∶3 dilutions,all of them show maximum absorption peak between 200 and 300 nm wavelength and the absorption value decreases gradually with the increase of the wavelength;B.Log absorbance of three different concentrations (1∶3,1∶2,1∶1) of melanin solution between 300 and 700nm wavelength VS wavelengths plot three fitted straight line negative slope and the slope present -0.003 38,-0.003 52 and -0.003 20;C.FT-IR spectrum of the melanin pigment fromF.monophora;D.FT-IR spectrum of the Synthetic DOPA-melanin;E.EPR spectral analysis of the melanin pigment fromF.monophoraFig.2 Results of melanin inhibited test (A-E and A1-E1 present the front and back of the medium respectively) present the cells cultured on the mediums consecutively PDA with 1 mmol/L of L-DOPA,the blank contrast PDA,PDA with 0.05 mmol/L of sodium azide,PDA with equivalent quantity ethanol dissolving the DHN melanin inhibitors and PDA with 200 mg/L of Kojic acid Fig.3 Results of melanin inhibited test (A-C and A1-C1 present the front and back of the medium respectively) present the cells cultured on the mediums consecutively PDA with 100 mg/L of Phthalide,PDA with equivalent quantity ethanol dissolving the DHN melanin inhibitors and PDA with 100 mg/L of tricyclazole Fig.4 Quantitative statistical analysis of extracted melanin shows that L-DOPA increase the production of melanin while the sodium azide obviously inhibit the synthesis of melanin inF.monophora.“*” Statistically significant difference were found between two groups (P<0.05) Fig.5 Quantitative Statistical analysis of extracted melanin shows that both the DHN melanin inhibitors Phthalide and tricyclazole inhibit the synthesis of melanin inF.monophora.“*” Statistically significant difference were found between two groups (P<0.05)
真菌黑素主要经DHN、DOPA和L-酪氨酸降解3种途径合成[19]。根据黑素合成途径和中间代谢产物的不同,又可分为真黑素、棕黑素、脓黑素和DHN黑素[20]。多数子囊菌通过DHN途径合成黑素,如裴氏着色霉、皮炎外瓶霉、甄氏外瓶霉、卡氏枝孢瓶霉、烟曲霉、黑曲霉等[21]。真黑素和棕黑素均经DOPA途径合成,统称DOPA黑素,漆酶 (多酚氧化酶)为该途径的主要催化酶。新生隐球菌、白念珠菌、荚膜组织胞浆菌等则通过DOPA途径合成黑素[15]。脓黑素主要经对羟苯丙酮酸羟化酶催化底物酪氨酸合成,可见于裴氏着色霉、申克孢子丝菌、巴西孢子丝菌、烟曲霉菌和新生隐球菌[9,22-24]。脓黑素具有可溶性,由真菌分泌至胞外,而其他两种黑素是疏水性且与胞壁结合[9]。裴氏着色霉同时具有通过DHN途径和脓黑素合成途径合成黑素,其胞外的可溶性色素和胞壁上的黑素诱发机体的免疫反应互不相同,前者可增强中性粒细胞、巨噬细胞对菌体的吞噬能力及氧化杀伤效应[7],而后者具有抵御H2O2及NO的氧化杀伤作用[8]。
本研究发现F.monophora可能共同存在DOPA黑素和DHN黑素合成途径,主要合成L-DOPA黑素。近年来发现不少真菌可联合两种或两种以上途径合成黑素。例如,申克孢子丝菌可通过DHN途径和DOPA途径合成黑素,还可通过酪氨酸降解途径合成脓黑素[25];马尔尼菲蓝状菌可通过DHN和DOPA两种途径合成黑素[14];新生隐球菌可通过DOPA途径及酪氨酸降解途径合成黑素[26]。烟曲霉菌和裴氏着色霉可合成DHN黑素及分泌至胞外的可溶性黑素[5-6,23]。三环唑和苯肽是特异的DHN黑素抑制剂。本研究首先在PDA培养基加入DHN黑素抑制剂观察F.monophora菌落及周围培养基颜色变化,虽然菌落黑素较其空白对照减少,但并未完全脱失。这与申克孢子丝菌、马尔尼菲蓝状菌、裴氏着色霉等相关研究结果类似,三环唑不能完全抑制这些真菌黑素合成[14,21,27],但可完全抑制马杜拉足菌肿黑素合成[28]。本研究进一步在PDA培养基加入黑素合成前体L-DOPA、漆酶抑制剂叠氮化钠和酪氨酸酶抑制剂曲酸观察F.monophora黑素合成变化,以明确该菌是否存在DOPA合成途径。结果显示,L-DOPA能增加菌落黑素产生,叠氮化钠有部分抑制黑素作用,而曲酸对菌落黑素无明显影响。新近对F.monophora转录组研究显示该菌同时存在DHN和DOPA两种黑素合成途径的关键酶,如聚酮合酶、多铜氧化酶、漆酶、酪氨酸酶和尿黑酸双加氧化酶等,其表达水平在野生株和白化株中存在明显差异[19]。F.monophora不同种类的黑素在着色芽生菌病发病机制毒力机制尚未阐明,随着基因组测序及蛋白质分析技术的快速发展,为黑素合成代谢及功能的研究提供更多基础,可望为着色芽生菌病治疗上的突破上提供帮助。
[1] Queiroz-Telles F,de Hoog S,Santos D W,et al.Chromoblastomycosis[J].Clin Microbiol Rev,2017,30(1):233-276.
[2] Najafzadeh M J,Vicente V A,Sun J,et al.Fonsecaeamultimorphosasp.nov,a new species of Chaetothyriales isolated from a feline cerebral abscess[J].Fungal Biol,2011,115(10):1066-1076.
[3] Xi L,Sun J,Lu C,et al.Molecular diversity ofFonsecaea(Chaetothyriales) causing chromoblastomycosis in southern China[J].Med Mycol,2009,47(1):27-33.
[4] Fransisca C,He Y,Chen Z,et al.Molecular identification of chromoblastomycosis clinical isolates in Guangdong[J].Med Mycol,2017.
[5] Franzen A J,de Souza W,Farina M,et al.Morphometric and densitometric study of the biogenesis of electron-dense granules inFonsecaeapedrosoi[J].FEMS Microbiol Lett,1999,173(2):395-402.
[6] Franzen AJ,Cunha MM,Miranda K,et al.Ultrastructural characterization of melanosomes of the human pathogenic fungusFonsecaeapedrosoi[J].J Struct Biol,2008,162(1):75-84.
[7] Alviano DS,Franzen AJ,Travassos LR,et al.Melanin fromFonsecaeapedrosoiinduces production of human antifungal antibodies and enhances the antimicrobial efficacy of phagocytes[J].Infection and Immunity,2004,72(1):229-237.
[8] Cunha MM,Franzen AJ,Seabra SH,et al.Melanin inFonsecaeapedrosoi:a trap for oxidative radicals[J].BMC Microbiol,2010,10(1):80.
[9] Pal AK,Gajjar DU,Vasavada AR.DOPA and DHN pathway orchestrate melanin synthesis inAspergillusspecies[J].Med Mycol,2014,52(1):10-18.
[10] Xi L,Lu C,Sun J,et al.Chromoblastomycosis caused by a meristematic mutant ofFonsecaeamonophora[J].Med Mycol,2009,47(1):77-80.
[11] Teixeira PA,De Castro RA,Ferreira FR,et al.L-DOPA accessibility in culture medium increases melanin expression and virulence ofSporothrixschenckiiyeast cells[J].Med Mycol,2010,48(5):687-695.
[12] Kumar CG,Mongolla P,Pombala S,et al.Physicochemical characterization and antioxidant activity of melanin from a novel strain ofAspergillusbridgeriICTF-201[J].Lett Appl Microbiol,2011,53(3):350-358.
[13] Sajjan S,Kulkarni G,Yaligara V,et al.Purification and physiochemical characterization of melanin pigment fromKlebsiellasp.GSK[J].J Microbiol Biotechnol,2010,20(11):1513-1520.
[14] Liu D,Wei L,Guo T,et al.Detection of DOPA-melanin in the dimorphic fungal pathogenPenicilliummarneffeiand its effect on macrophage phagocytosis in vitro[J].PLoS One,2014,9(3):e92610.
[15] 陈映丹,陆春,冯佩英.黑素与真菌抗药性的研究进展[J].中国真菌学杂志,2016,11(4):248-251.
[16] de A S R,Angluster J,de Souza W,et al.Carbohydrate and lipid components of hyphae and conidia of human pathogenFonsecaeapedrosoi[J].Mycopathologia,1995,132(2):71-77.
[17] Corbellini VA,Scroferneker ML,Carissimi M,et al.Lipolytic activity of chromoblastomycosis agents measured by infrared spectroscopy and chemometric methods[J].Med Mycol,2009,47(1):63-69.
[18] Gessler NN,Egorova AS,Belozerskaia TA.Melanin pigments of fungi under extreme environmental conditions (review)[J].Prikl Biokhim Mikrobiol,2014,50(2):125-134.
[19] Li XQ,Guo BL,Cai WY,et al.The role of melanin pathways in extremotolerance and virulence ofFonsecaearevealed by de novo assembly transcriptomics using illumina paired-end sequencing[J].Stud Mycol,2016,83:1-18.
[20] Langfelder K,Streibel M,Jahn B,et al.Biosynthesis of fungal melanins and their importance for human pathogenic fungi[J].Fungal Genet Biol,2003,38(2):143-158.
[21] Franzen AJ,Cunha MM,Batista EJ,et al.Effects of tricyclazole (5-methyl-1,2,4-triazol[3,4] benzothiazole),a specific DHN-melanin inhibitor,on the morphology ofFonsecaeapedrosoiconidia and sclerotic cells[J].Microsc Res Tech,2006,69(9):729-737.
[22] Revankar SG,Sutton DA.Melanized fungi in human disease[J].Clin Microbiol Rev,2010,23(4):884-928.
[23] Schmaler-Ripcke J,Sugareva V,Gebhardt P,et al.Production of pyomelanin,a second type of melanin,via the tyrosine degradation pathway inAspergillusfumigatus[J].Appl Environ Microbiol,2009,75(2):493-503.
[24] Alviano D S,Franzen A J,Travassos L R,et al.Melanin fromFonsecaeapedrosoiinduces production of human antifungal antibodies and enhances the antimicrobial efficacy of phagocytes[J].Infect Immun,2004,72(1):229-237.
[25] Almeida-Paes R,Frases S,Araujo G D S,et al.Biosynthesis and functions of a melanoid pigment produced by species of theSporothrixcomplex in the presence of L-tyrosine[J].Appl Environ Microbiol,2012,78(24):8623-8630.
[26] Frases S,Salazar A,Dadachova E,et al.Cryptococcusneoformanscan utilize the bacterial melanin precursor homogentisic acid for fungal melanogenesis[J].Appl Environ Microbiol,2007,73(2):615-621.
[27] Romero-Martinez R,Wheeler M,Guerrero-Plata A,et al.Biosynthesis and functions of melanin inSporothrixschenckii[J].Infect Immun,2000,68(6):3696-3703.
[28] van de Sande WW,de Kat J,Coppens J,et al.Melanin biosynthesis inMadurellamycetomatisand its effect on susceptibility to itraconazole and ketoconazole[J].Microbes Infect,2007,9(9):1114-1123.
[本文编辑] 卫凤莲
Detection of physiochemical characterization and synthesis pathway of melanin fromFonsecaeamonophora
CHEN Ying-dan1,LU Chun1,LI Mei-rong1,MA Han1,YING Song-chao1,ZHENG Zhi-xin1,LI Hai-yi1,XI Li-yan2,FENG Pei-ying1
(1.DepartmentofDermatology,ThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China;2.DepartmentofDermatology,SunYat-senmemorialHospitalofSunYat-senUniversity,Guangzhou510120,China)
Objective To study the melanin physiochemical characterization and melanin synthesis pathway ofFonsecaeamonophora.Methods Pure melanin mass was extracted from theF.monophoraisolate using the cell wall crude extract method.Then we used Ultravolet (Uv),Fourier transformed infrared (FT-IR) and electron paramagnetic resonance (EPR) spectra assay to evaluate the physiochemical characterization of melanin.Furthermore,we observed the pigment production of the colonies on different mediums (PDA,PDA with L-DOPA,PDA with DOPA-melanin inhibitors and PDA with DHN-melanin inhibitors),and the quantity of melanin produced on different above media were measured using BioTek Eon microplate reader.Results The melanin extracted fromF.monophorashared similar physiochemical and spectroscopic properties with the synthetic L-DOPA melanin.The formation of melanin pigment statistically significant increased on the L-DOPA medium,and decreased on the DOPA-melanin inhibitor medium (sodium azide) and DHN-melanin inhibitors medium (phthalide and tricyclazole) compare to their blank contrast medium.Conclusions The melanin produced byF.monophorais mainly DOPA melanin,and it may synthesize simultaneously by DOPA-melanin and DHN-melanin pathway.
Fonsecaeamonophora;melanin;physiochemical characterization;melanin synthesis pathway
国家自然科学基金 (81401650)
陈映丹,女 (汉族),硕士研究生在读.E-mail:chenyingdan89@163.com
陆春,E-mail:luliyuan@tom.com;冯佩英,E-mail:fengpeiying@medmail.com.cn
·论著·
陈映丹1陆春1李美荣1马寒1尹颂超1郑智心1李海仪1席丽艳2冯佩英1
(1.广州市中山大学附属第三医院皮肤科,广州 510630;2.广州市中山大学孙逸仙纪念医院皮肤科,广州 510120)
R 379.9
A
1673-3827(2017)12-0129-06
2017-02-13

