铜绿假单胞菌脂多糖对阿萨希毛孢子菌生物膜形成的影响
孙伟 邓娟 苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
·论著·
铜绿假单胞菌脂多糖对阿萨希毛孢子菌生物膜形成的影响
孙伟 邓娟 苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
目的 研究铜绿假单胞菌脂多糖 (LPS)对阿萨希毛孢子菌生物膜形成的影响。方法 将不同浓度 (100~0.1 μg/mL)铜绿假单胞菌脂多糖与阿萨希毛孢子菌共培养后,利用倒置显微镜观察生物膜的形态学变化,并利用甲基四氮盐 (XTT)减低法检测不同时间点生物膜生成量的变化。结果 与生长对照组相比,实验组铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜的生成具有菌株差异性和LPS浓度依赖性。其中,黏附阶段 (2 h),各浓度组铜绿假单胞菌LPS对生物膜形成的影响没有统计学差异。生物膜形成阶段 (24 h),与生长对照比,100 μg/mL、10 μg/mL、1 μg/mL的铜绿假单胞菌LPS对阿萨希毛孢子菌的生物膜形成的抑制作用均有统计学意义作用。而在生物膜成熟阶段 (48 h),只有100 μg/mL的铜绿假单胞菌LPS对阿萨希毛孢子菌的生物膜形成的抑制作用具有统计学意义。倒置显微镜下,实验组菌丝形成明显受到抑制,以孢子相为主。结论 铜绿假单胞菌脂多糖可以通过抑制阿萨希毛孢子菌菌丝的形成来减少生物膜的形成,并且抑制作用具有时间和浓度依赖性,以24 h时,100 μg/mL作用最为显著。
生物膜;脂多糖;阿萨希毛孢子菌;铜绿假单胞菌
[Chin J Mycol,2017,12(3):140-143]
阿萨希毛孢子菌 (Trichosporonasahii,T.asahii)是一种可以引起免疫缺陷患者机会性感染的酵母样真菌,是引起播散性毛孢子菌病的主要致病菌。近年来播散性毛孢子菌病的发病率呈明显上升的趋势,且病死率高,因而引发了越来越多的关注[1-5]。我们前期的研究表明,阿萨希毛孢子菌可以形成生物膜,且不同基因型别的阿萨希毛孢子菌形成生物膜的能力不同[6]。生物膜是阿萨希毛孢子菌重要的致病因子,因为生物膜的形成使其对常用抗真菌药物的敏感性急剧下降[6-9]。因此,抑制阿萨希毛孢子菌生物膜的形成是防治播散性毛孢子菌病的重要途径。日常工作中,我们时常发现阿萨希毛孢子菌与铜绿假单胞菌合并引发尿路感染的情况。而铜绿假单胞菌脂多糖 (LPS)作为铜绿假单胞菌重要的毒力因子,一方面被认为是造成全身性炎症综合征的主要原因,同时LPS又具有复杂的生物学活性,是一种免疫增强剂。
本研究拟从铜绿假单胞菌脂多糖对阿萨希毛孢子菌生物膜形成的影响的角度,探讨二者的关系,希望能够得出铜绿假单胞菌对阿萨希毛孢子菌生物膜的影响的实验室证据,并为后续深入研究寻找新的切入点。
1 材料与方法
1.1 材料和仪器
菌株 白念珠菌标准菌株SC5314;临床清洁中段尿培养分离18株阿萨希毛孢子菌,所有菌株使用前均于脱脂牛奶中-70℃保存。
培养基 沙堡弱培养基 (Oxiod);RPMI-1640 (Gibco);YPD培养基 (酵母蛋白胨葡萄糖肉汤)购自Difco公司。
主要试剂和仪器 铜绿假单胞菌LPS、甲基四氮盐 (XTT)及甲萘醌均购自Sigma公司,恒温摇床,酶标仪 (Bio-Rad),细胞计数板,倒置显微镜 (Olympus),VITEK2 COMPCT (生物梅里埃),MALDI-TOF-MS (生物梅里埃)。
1.2 试剂配制
YPD培养基 溶解10 g酵母膏,20 g蛋白胨于900 mL水中,高压灭菌121℃,20 min。之后加入100 mL 20 g葡萄糖溶液 (过滤除菌)。
LPS工作液 RPMI-1640溶液溶液,10倍梯度稀释配制成100~0.1 μg/mL浓度。
XTT 用无菌PBS缓冲液溶解配制成0.5 mg/mL溶液,0.22 μm微孔滤器过滤除菌,分装后-20℃冻存备用。
甲萘醌 用丙酮 (北京化学试剂厂,分析纯)新鲜配制成浓度为10 mmol/L的溶液。
1.3 方法
阿萨希毛孢子菌的分离与鉴定 收集临床尿培养可疑为阿萨希毛孢子菌的菌株,取单个菌落转种沙堡弱培养基,并将纯培养物制备菌悬液通过VITEK2 COMPACT仪器鉴定,同时将单个纯菌落涂布靶板,经MALDI-TOF-MS鉴定。将两种方法均鉴定为阿萨希毛孢子菌的菌株收集冻存,作为试验菌株备用。
阿萨希毛孢子菌生物膜的制备 将-70℃冻存的阿萨希毛孢子菌复苏,沙堡弱培养基转种2次。取纯菌落于YPD培养基中振荡培养过夜 (37℃,75 r/min)。离心、收集菌体,PBS洗涤2次 (4 000 r/min,5 min)。将菌体重悬于预先制备的含有或不含有铜绿假单胞菌LPS (100~0.1 μg/mL)的RPMI-1640溶液中,稀释成106CFU/mL菌悬液。将1.0 mL该菌悬液加入预先放置0.8 cm×0.8 cm无菌圆形玻片的48孔培养板中,37℃培养72 h。2 h时PBS缓冲液洗涤2次,重新加入400 μL相应的含不同浓度LPS的RPMI-1640培养液。每隔24 h更换1次培养液。设置不加阿萨希毛孢子菌的空白对照组,不含LPS的RPMI-1640溶液为阴性对照组,加入阿萨希毛孢子菌但不加入LPS的生长对照组。不同时间点重复试验3次。
XTT减低法对形成的生物膜进行定量分析在2 h、24 h、48 h时间点,弃去96孔板中培养液,每孔用400 μL PBS缓冲液洗涤2遍,然后每孔加入80 μL XTT、4 μL甲萘醌、316 μL PBS缓冲液,37℃避光孵育3 h后,用酶标仪测定490 nm处的吸光度值 (OD值)。
倒置相差显微镜观察生物膜形态 按上述方法进行阿萨希毛孢子菌生物被膜的制备,培养24 h后用400 μL无菌PBS缓冲液轻轻冲洗48孔板,于倒置显微镜下观察。
1.4 统计学分析
2 结 果
2.1 体外不同浓度铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的影响
本研究考察不同时间段,100~0.1 μg/mL (10倍梯度稀释)的铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的影响。结果显示:与生长对照组相比,实验组铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜的生成具有菌株差异性和LPS浓度依赖性。其中,黏附阶段 (2 h),浓度为100 μg/mL的铜绿假单胞菌LPS对阿萨希毛孢子菌的生物膜形成抑制作用最显著 (12/18,66.7%)。生物膜形成阶段 (24 h),100 μg/mL铜绿假单胞菌LPS对阿萨希毛孢子菌的生物膜形成抑制率最高 (16/18,88.9%)。而在生物膜成熟阶段 (48 h),100 μg/mL和10 μg/mL的铜绿假单胞菌LPS对阿萨希毛孢子菌的生物膜形成抑制作用相当,均为55.6% (10/18)(见表1)。具体而言,铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜的影响见XTT结果分析 (见表2)。黏附阶段 (2 h),与生长对照相比,铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜的形成的抑制作用没有统计学意义。而形成阶段 (24 h),与生长对照相比,100 μg/mL、10 μg/mL、1 μg/mL的铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的抑制作用具有统计学意义。成熟阶段 (48 h),与生长对照相比,只有100 μg/mL的的铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的抑制作用具有统计学意义。
2.2 铜绿假单胞菌脂多糖对阿萨希毛孢子菌生物膜形态的影响
表1 不同浓度铜绿假单胞菌LPS影响阿萨希毛孢子菌形成生物膜的菌株数
Tab.1 The effect of different concentrations ofPseudomonasaeruginosaLPS influenceTrichosporonasahiibiofilms formation (strains)
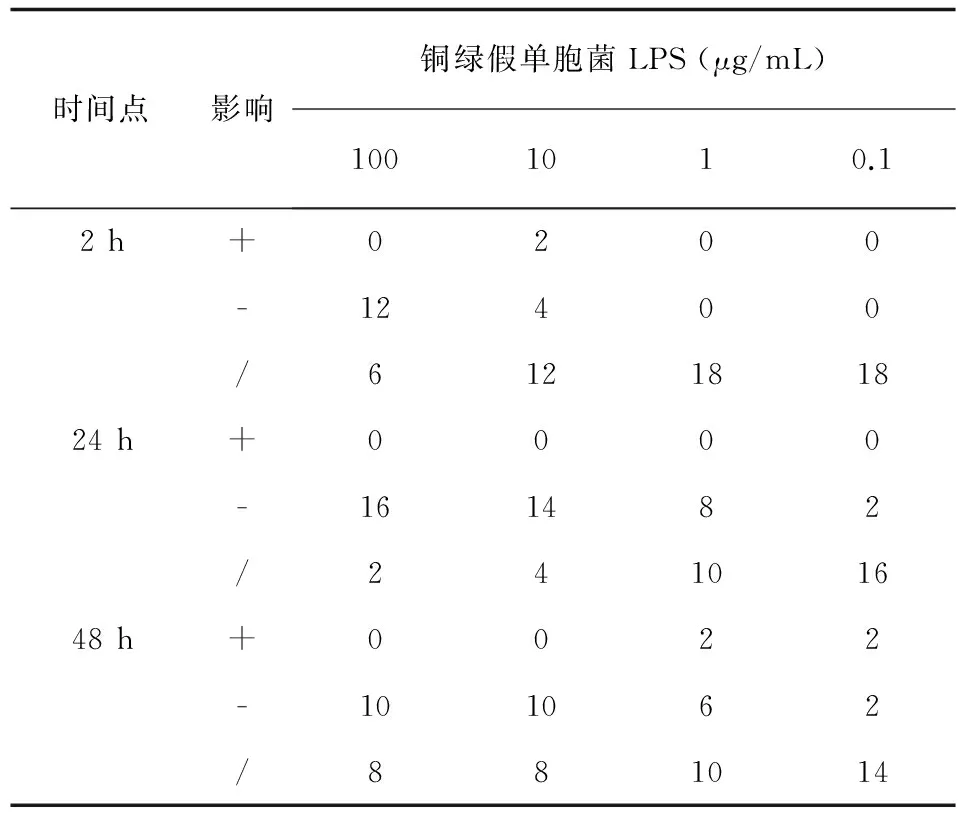
时间点影响铜绿假单胞菌LPS(μg/mL)1001010.12h+0200-12400/612181824h+0000-161482/24101648h+0022-101062/881014
注:+.刺激,-.抑制,/.无影响
表2 不同浓度的铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜影响的XTT结果分析
Tab.2 XTT results analysis ofPseudomonasaeruginosaLPS againstTrichosporonasahiibiofilms formation

组别剂量(μg/mL)吸收度(OD值)2h24h48hNS-0.224±0.0701.156±0.2861.227±0.188LPS1000.172±0.0510.321±0.202*0.763±0.388*LPS100.197±0.0480.530±0.352*1.021±0.427LPS10.212±0.0680.742±0.329*1.099±0.367LPS0.10.248±0.0391.020±0.2751.220±0.224
注:NS组为生长对照组;*.与NS组比较P<0.01
将含有不同浓度铜绿假单胞菌LPS的RPMI-1640溶液培养的阿萨希毛孢子菌培养24 h后,于倒置显微镜下观察。发现阿萨希毛孢子菌生长对照组菌落缠绕聚集生长并有大量交织生长的菌丝,而实验组菌丝抑制现象明显,镜下多见菌体为酵母相,偶见少量菌丝形成。其中实验组浓度为100 μg/mL时,抑制作用最显著,如图1。
3 讨 论
阿萨希毛孢子菌是引起播散性毛孢子菌病的主要病原菌,死亡率极高。本课题组前期研究发现,阿萨希毛孢子菌能形成生物膜,且不同基因型别的阿萨希毛孢子菌形成生物膜的能力不同。生物膜形成后,该菌对临床常用抗真菌药物敏感性显著降低,甚至耐药。因而,抑制阿萨希毛孢子菌的生物膜形成,可能是防治播散性毛孢子菌病的重要有效途径。
在临床菌株收集过程中,尤其是尿路感染来源的菌株,经常遇到阿萨希毛孢子菌与铜绿假单胞菌共同感染的情况。二者的伴生感染是基于什么样的相互作用和分子机理值得我们深入研究。本研究从最基本的现象入手,考虑到LPS是革兰阴性细菌细胞壁的主要成分,也是重要的毒力因子,其在革兰阴性细菌的识别、黏附、增殖以及炎症和免疫应答等过程中都发挥着重要作用。虽然有铜绿假单胞菌的体内抗真菌的相关研究[10]。并且,Bandara等[11]通过共聚焦荧光显微镜和扫描电镜观察到铜绿假单胞菌LPS抑制白念珠菌菌丝的形成从而影响白念珠菌生物膜的形成。但是,铜绿假单胞菌LPS对阿萨希毛孢子菌的作用未见报道。

图1 24 h时,不同浓度铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的形态学影响:A.阴性对照 (LPS=0 μg/mL);B.实验组1 (LPS=0.1 μg/mL);C.实验组2 (LPS=1 μg/mL);D.实验组3 (LPS=10 μg/mL);E.实验组4 (LPS=100 μg/mL)
Fig.1 The effect ofPseudomonasaeruginosalipopolysaccharide on the biofilm morphology ofTrichosporonasahii:A.Group NS (LPS=0 μg/mL);B.Group 1 (LPS=0.1 μg/mL);C.Group 2 (LPS=1 μg/mL);D.Group 3 (LPS=10 μg/mL);E.Group 4 (LPS=100 μg/mL)
本研究将不同浓度的铜绿假单胞菌LPS与阿萨希毛孢子菌共培养,XTT法分析不同时间点,铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的影响 (如表2),并取抑制作用最显著的第24 h,观察生物膜形态学的变化 (如图1)(由于条件所限,该实验关于形态学的扫描电镜结果将在后续试验中加以补充)。结果显示,铜绿假单胞菌LPS对阿萨希毛孢子菌生物膜形成的抑制作用具有时间差异及浓度依赖性。与生长对照组相比,实验组菌丝相明显减少,以孢子相为主,可能是由于LPS主要通过抑制菌丝起作用,而黏附阶段,生物膜以孢子相为主,菌丝形成尚少,所以对生物膜的形成抑制作用不显著。为了验证阿萨希毛孢子菌的菌丝是铜绿假单胞菌LPS的主要作用靶点,后续试验将对铜绿假单胞菌LPS作用前后,阿萨希毛孢子菌特定菌丝基因的表达进行实时定量检测,找出主要相关基因。另外,成熟阶段 (48 h),虽然有大量致密的菌丝形成,可以作为靶点,但是由于LPS自身也存在降解的问题,所以只有100 μg/mL的LPS显示出显著的生物膜抑制作用。可能适时向实验体系中补加适量的LPS会有一定的改善,这有待后续试验进一步验证。
总之,本研究初步显示铜绿假单胞菌LPS通过抑制菌丝的形成来影响阿萨希毛孢子菌生物的膜形成,且抑制作用具有时间和浓度依赖性。后续研究将会深入探讨相关分子机制,以期发现有效的抑制阿萨希毛孢子菌生物膜形成的靶点,并验证去毒性的铜绿假单胞菌脂多糖是否可以成为抗真菌药物,为减少播散性毛孢子菌病的发生提供新思路。
[1] Karapinar DY,KaradaN,Yazici P,et al.Trichosporonasahii,sepsis,and secondary hemophagocytic lymphohistiocytosis in children with hematologic malignancy[J].Pediatr Hematol Oncol,2014,31(3):282-284.
[2] Miura Y,Kaneko M,Nishizawa M,et al.Breakthrough infection ofTrichosporonasahiiin a patient with chronic lymphocytic leukemia[J].Int J Hematol,2007,85(2):177-178.
[3] Ozkaya-Parlakay A,Karadag-Oncel E,Cengiz AB,et al.Trichosporonasahiisepsis in a patient with pediatric malignancy[J].Wei mian yu gan ran za zhi,2016,49(1):146-149.
[4] Takamura S,Oono T,Kanzaki H,et al.Disseminated trichosporonosis withTrichosporonasahii[J].Eur J Dermatol,1999,9(7):577-579.
[5] Yildiran A,Kücüködük S,Saniç A,et al.DisseminatedTrichosporonasahiiinfection in a preterm[J].Am J Perinatol,2003,20(5):269-271.
[6] Sun W,Su J,Xu S,et al.Trichosporonasahiicausing nosocomial urinary tract infections in intensive care unit patients:genotypes,virulence factors and antifungal susceptibility testing[J].J Med Microbiol,2012,61(Pt 12):1750-1757.
[7] Almeida AA,Crispim Bdo A,Grisolia AB,et al.Genotype,antifungal susceptibility,and biofilm formation ofTrichosporonasahiiisolated from the urine of hospitalized patients[J].Rev Argent Microbiol,2016,48(1):62-66.
[8] Liao Y,Yang S,Cong L,et al.Invitroactivities of antifungal combinations against biofilms and planktonic forms of clinicalTrichosporonasahiiisolates[J].Antimicrob Agents Chemother,2014,58(12):7615-7616.
[9] Xia Z,Yang R,Wang W,et al.Genotyping and antifungal drug susceptibility ofTrichosporonasahiiisolated from Chinese patients[J].Mycopathologia,2012,173(2-3):127-133.
[10] Kerr JR.Suppression of fungal growth exhibited byPseudomonasaeruginosa[J].J Clin Microbiol,1994,32(2):525-527.
[11] Bandara HM,K Cheung BP,Watt RM,et al.Pseudomonasaeruginosalipopolysaccharide inhibitsCandidaalbicanshyphae formation and alters gene expression during biofilm development[J].Molecular Oral Microbiology,2012,28(1):54-69.
[本文编辑] 施 慧
Effect ofPseudomonasaeruginosalipopolysaccharide on the biofilm formation ofTrichosporonasahii
SUN Wei,DENG Juan,SU Jian-rong
(ClinicalLaboratoryCenter,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050)
Objective To explore the effect ofPseudomonasaeruginosalipopolysaccharide on the biofilm formation ofTrichosporonasahii.Methods Morphological changes of the cells were observed by inverted microscope.And XTT reduction assay was used to elucidate the effect ofPseudomonasaeruginosalipopolysaccharide (LPS)(100-0.1 μg/mL) on biofilm formation ofTrichosporonasahii.Results Compared with the growth group,the biofilm formation ofTrichosporonasahiiwas modulated by thePseudomonasaeruginosaLPS (the experimental group) in a time and concentration dependent manner.During the adhesion stage (2 h),the difference between the growth group and all experimental groups was not statistically significant.While during the biofilm formation stage (24 h),the biofilm formation could be inhibited statistically significant when the concentration of LPS was 100 μg/mL,10 μg/mL and 1 μg/mL.And under the biofilm maturation stage,only when the LPS was 100 μg/mL,the difference between the growth group and the experimental group was significantly different.Meanwhile,when the inhibition exhibited,the hyphal formation was obviously inhibited,mainly in the spore phase under the inverted microscope.ConclusionsPseudomonasaeruginosaLPS could inhibit theTrichosporonasahiibiofilm formation in a time and concentration dependent manner.And the inhibitory effect was achieved through reducing the hyphal formation,especially in 24 h,100 μg/mL.
biofilm;lipopolysaccharide;Trichosporonasahii;Pseudomonasaeruginosa
北京市优秀人才资助基金 (2014000021469G267),首都医科大学基础临床合作基金 (15JL27)
孙伟,女 (汉族),博士,主管技师.E-mail:sunwei010512@163.com
苏建荣,E-mail:sujr2012@163.com
R 379.9
A
1673-3827(2017)12-0140-04
2016-12-22

