丙泊酚和七氟醚对行腹腔镜子宫切除术宫颈癌患者围手术期免疫反应的影响
陈 锴 张兆伟 秦妮娜
宫颈癌是严重威胁女性生命健康的恶性肿瘤之一。目前宫颈癌的病因尚不明确,没有特定的治疗药物,为此子宫切除术是宫颈癌的主要治疗方法[1]。子宫切除术的广泛应用,能对宫颈癌患者的盆腔自主神经结构进行精细解剖并保留,以达到改善患者预后的目的[2]。围术期患者免疫功能保护对改善预后、预防肿瘤扩散具有重要意义[3]。不过宫颈癌患者自身免疫功能较正常人低下,手术创伤、疼痛刺激、麻醉等因素均可进一步降低患者的免疫功能[4-6]。本文具体探讨了丙泊酚和七氟醚对行腹腔镜子宫切除术治疗宫颈癌患者围手术期免疫反应的影响,现报告如下。
1 资料与方法
1.1 研究对象
2015年2月到2017年1月选择在我院诊治的宫颈癌患者120例作为研究对象,纳入标准:患者知情同意本研究;年龄35~65岁;患者均行腹腔镜手术,病理诊断为宫颈癌;研究得到医院伦理委员会的批准。排除标准:妊娠与哺乳期妇女;有严重合并症影响手术;肝肾功能障碍患者;高血压及心脏病患者。根据随机数字表法把患者分为观察组与对照组各60例,两组患者的年龄、FIGO分期、体重指数、病理类型、病程等资料对比差异无统计学意义(P>0.05),见表1。

表1 两组一般资料对比
1.2 治疗与麻醉方法
所有患者都在腹腔镜下行保留盆腔自主神经的子宫切除手术,患者膀胱截石位,常规消毒铺巾后,建立四孔气腹,行双侧盆腔淋巴结清扫术,将膀胱与宫颈前壁及阴道上段分离,通过淋巴清扫使髂血管轮廓化。将输尿管及其下方的系膜与阔韧带后叶分离,整保留韧带外侧的输尿管系膜及其内的腹下神经束结构由根部切断宫骶韧带。在起始端切断子宫动脉,输尿管顶部切断浅层膀胱宫颈韧带,保留其下方的盆腔内脏神经结构,在膀胱支内侧切断深层膀胱宫颈韧带的静脉丛,将膀胱下推,在切断阴道直肠韧带及阴道旁组织,最后切除子宫。
所有患者入手术室后开放外周静脉通道,监测生命体征,采用气管内插管全凭静脉全身麻醉。对照组:麻醉诱导采用静脉注射咪达唑仑0.05 mg/kg,舒芬太尼0.5 μg/kg、丙泊酚1mg/kg, 罗库溴铵0.6 mg/kg,选择瑞芬太尼0.1~0.3 μg/kg/min丙泊酚2~4 mg/kg/h持继泵注,间断推注罗库溴铵进行麻醉维持。观察组:在对照组麻醉的基础上加用七氟醚吸入麻醉,麻醉诱导开始吸入5.0%七氟醚与4 L/min氧气混合气体,面罩给氧,诱导完成后七氟醚吸入浓度逐步下降并控制在2.0%,氧流量调节至1~2 L/min。如出现低血压静注间羟胺0.5~1 mg。
1.3 观察指标
围手术指标:观察两组的手术时间、术中出血量、淋巴结清扫总数、术后恢复排气时间与术后住院时间。并发症:观察两组术后盆腔器官损伤、尿失禁、尿瘘、淋巴囊肿、血栓等并发症发生情况。麻醉效果:观察两组患者苏醒时间、拔管时间、丙泊酚用量。免疫功能测定:所有患者在术前与术后48 h空腹采集静脉血4 ml,肝素钠抗凝,3 h内送检,分离外周血单个核细胞后选择流式细胞仪检测CD4+CD25+T和CD4+OX40+T含量。
1.4 统计学处理
应用SPSS 21.00软件进行分析,计数资料以百分比与率表示,计量资料以均数±标准差(±s)或者中位数(四分位间距)表示,计数数据与计量数据的对比采用配对t检验、样本t检验与卡方χ2检验等,P<0.05代表差异有统计学意义。
2 结果
2.1 围手术指标比较
两组手术时间、术中出血量、淋巴结清扫总数对比差异无统计学意义(P>0.05),观察组的术后恢复排气时间与术后住院时间明显少于对照组(P<0.05),见表2。
2.2 并发症发生情况对比
观察组术后盆腔器官损伤、尿失禁、尿瘘、淋巴囊肿、血栓等并发症发生率为6.7%,对照组为10%,两组对比差异无统计学意义(P>0.05),见表3。
表2 两组围手术指标比较(±s)
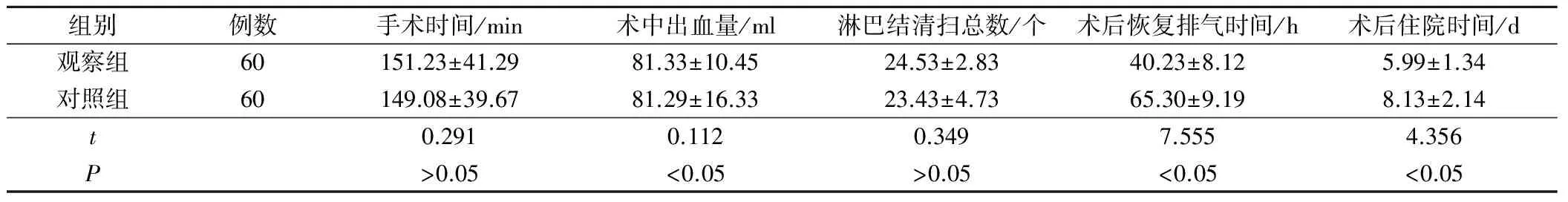
表2 两组围手术指标比较(±s)
组别例数手术时间/min术中出血量/ml淋巴结清扫总数/个术后恢复排气时间/h术后住院时间/d观察组60151.23±41.2981.33±10.4524.53±2.8340.23±8.125.99±1.34对照组60149.08±39.6781.29±16.3323.43±4.7365.30±9.198.13±2.14t0.2910.1120.3497.5554.356P>0.05<0.05>0.05<0.05<0.05

表3 两组术后并发症发生情况对比/例
2.3 麻醉效果对比
观察组的苏醒时间、拔管时间明显少于对照组(P<0.05),两组丙泊酚用量对比差异无统计学意义(P>0.05)。见表4。
2.4 免疫功能变化对比
观察组术后48 d的CD4+CD25+T和CD4+OX40+T分别为(5.85±1.33)%和(8.52±3.17)%,对照组为(7.14±1.04)%和(10.43±2.85)%,组间对比差异明显(P<0.05),也都明显低于术前(P<0.05)。见表5。
表4 两组麻醉效果对比(±s)

表4 两组麻醉效果对比(±s)
组别例数苏醒时间/min拔管时间/min丙泊酚用量/mg观察组6013.2±2.620.2±2.2533.2±29.6对照组605.6±2.17.0±1.1528.4±29.8t8.1368.9640.311P<0.05<0.05>0.05
3 讨论
宫颈癌是最常见的妇科恶性肿瘤疾病之一,随着我国防癌普查工作的进行,宫颈癌的发病人数在增加,
表5 两组手术前后免疫功能指标变化对比(±s,%)
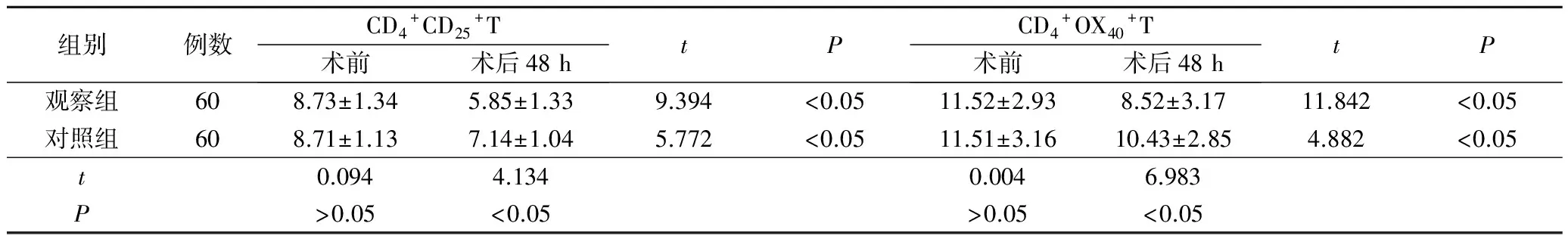
表5 两组手术前后免疫功能指标变化对比(±s,%)
组别例数CD4+CD25+T术前术后48htPCD4+OX40+T术前术后48htP观察组608.73±1.345.85±1.339.394<0.0511.52±2.938.52±3.1711.842<0.05对照组608.71±1.137.14±1.045.772<0.0511.51±3.1610.43±2.854.882<0.05t0.0944.1340.0046.983P>0.05<0.05>0.05<0.05
但是宫颈癌的死亡率明显下降[7]。子宫切除术为宫颈癌的主要治疗方法,能根除病灶,延长患者的生存时间,但是在术后常伴有切口痛和痉挛痛,严重影响患者的预后恢复[8]。
在腹腔镜保留盆腔自主神经的子宫切除手术中,需要切断子宫膀胧浅层韧带的内侧缘断端,将子宫膀胧深层韧带切断,保留在其内走向的盆腔自主神经,具有更好的微创性,但是对于麻醉的要求比较高[9]。
丙泊酚为全身麻醉的常用药物,是血药浓度达到高峰的时间明显延长,肝脏的首过代谢率很高,容易发生术后躁动[10]。而当丙泊酚使用剂量较高时,临床表现为痛觉丧失的同时又表现出某些拟精神病症状,从而影响麻醉效果。七氟醚作为一种新型的吸入性麻醉药已广泛应用于临床麻醉中,七氟醚吸入能保持患者术中生命体征平稳,保留自主呼吸[11];特别是七氟醚的血气分配系数低,能促使患者苏醒迅速[12]。本研究显示两组手术时间、术中出血量、淋巴结清扫总数对比差异无统计学意义(P>0.05),观察组的术后恢复排气时间与术后住院时间明显少于对照组(P<0.05);观察组术后盆腔器官损伤、尿失禁、尿瘘、淋巴囊肿、血栓等并发症发生率为6.7%,对照组为10.0%,但是组间对比差异统计学意义(P>0.05)。
手术切除是治疗宫颈癌的重要手段,然而宫颈癌手术本身可引起机体免疫功能抑制,且术后易复发转移[13]。并且宫颈癌患者由于营养不良、心理应激、自身疾病等因素,常存在不同程度的免疫功能紊乱[14]。有研究表明,较好的麻醉方法可通过降低患者围术期的应激反应来保护患者的免疫功能,改善患者的预后,不过不同的麻醉药物对机体免疫功能保护不尽相同[15]。T淋巴细胞亚群对于稳定机体免疫系统功能具有重要作用阴,其中调节性T细胞亚群变化是反映细胞免疫功能的重要指标之一[16]。基础研究发现Th1/Th2亚群比例和功能失衡是前列腺癌的主要免疫学发病机制,表现为Th2细胞数目增多和功能亢进[11]。本研究显示观察组的苏醒时间、拔管时间明显少于对照组(P<0.05),两组丙泊酚用量对比差异无统计学意义(P>0.05);观察组术后48d的CD4+CD25+T和CD4+OX40+T分别为(5.85±1.33)%和(8.52±3.17)%,对照组为(7.14±1.04)%和(10.43±2.85)%,组间对比差异明显(P<0.05),也都明显低于术前(P<0.05)。表明两组患者在麻醉手术后,机体免疫功能都受到不同程度的抑制,丙泊酚联合七氟醚麻醉对患者的免疫功能抑制相对较小,从而达到更好的麻醉效果。
综上所述,丙泊酚和七氟醚在腹腔镜子宫切除术治疗宫颈癌患者中的应用能降低围手术期免疫反应,提高麻醉效果,从而促进患者的康复。
[1] 王春玲,于 江,俸 珊,等.无气腹腹腔镜手术在妇科子宫肌瘤切除术中的应用〔J〕.中国生育健康杂志,2017,28(2):168-170.
[2] Terukina J,Takamatsu M,Enomoto T,et al.Anesthetic ma-
nagement of abdominal radical trachelectomy for uterine cervical cancer during pregnancy〔J〕.J Anesth,2017,31(3):467-471.
[3] 孙国林.右美托咪定辅助全麻下非脱垂大子宫患者行腹腔镜全子宫切除术对患者的影响及麻醉效果评价〔J〕.河北医药,2017,39(2):217-220.
[4] Li H,Lu Y,Pang Y,et al.Propofol enhances the cisplatin-induced apoptosis on cervical cancer cells via EGFR/JAK2/STAT3 pathway〔J〕.Biomed Pharmacother,2017,2(86):324-333.
[5] Liu S,Gu X,Zhu L,et al.Effects of propofol and sevoflurane on perioperative immune response in patients undergoing laparoscopic radical hysterectomy for cervical cancer〔J〕.Medicine (Baltimore),2016,95(49):e5479.
[6] 马玉清,宁红久.腰-硬联合麻醉在腹式全子宫切除术中的麻醉效果及安全性〔J〕.中国实用医药,2017,12(7):118-119.
[7] Zhang F,Wang C,Cui Y,et al.Effects of Propofol on Several Membrane Characteristics of Cervical Cancer Cell Lines〔J〕.Cell Physiol Biochem,2016,40(1-2):172-182.
[8] Li NL,Yu BL,Hung CF.Paravertebral Block Plus Thoracic Wall Block versus Paravertebral Block Alone for Analgesia of Modified Radical Mastectomy:A Retrospective Cohort Study〔J〕.PLoS One,2016,11(11):e0166227.
[9] 李盛楠.开腹子宫全切除术与腹腔镜辅助阴式全子宫切除术的疗效比较〔J〕.临床医学,2017,37(3):93-95.
[10] 张 敏.全联合硬膜外麻醉对腹腔镜全子宫切除术患者应激反应的抑制〔J〕.牡丹江医学院学报,2017,38(2):93-94,90.
[11] Masamoto C,Onishi H,Doi Y,et al.A Case of EXIT (Ex-utero Intrapartum Treatment) in a Fetus with Prenatal Diagnosis of a Giant Cervical Tumor:Successful Airway Management but without Indication of Treatment for a Tumor〔J〕.Masui,2016,65(6):610-613.
[12] 钟宝军.不同麻醉方法对腹腔镜子宫切除术患者的效果对比分析〔J〕.临床医学研究与实践,2017,2(11):44-45.
[13] Terukina J,Takamatsu M,Enomoto T,et al.Anesthetic ma-
nagement of abdominal radical trachelectomy for uterine cervical cancer during pregnancy〔J〕.J Anesth,2017,31(3):467-471.
[14] 王益兵,金丽萍.右美托咪定对瑞芬太尼麻醉患者痛觉过敏缓解的有效性〔J〕.中国生化药物杂志,2017,3(4):255-257.
[15] Zhang D,Zhou XH,Zhang J,et al.Propofol promotes cell apoptosis via inhibiting HOTAIR mediated mTOR pathway in cervical cancer〔J〕.Biochem Biophys Res Commun,2015,468(4):561-567.
[16] Ghai B,Jain K,Bansal D,et al.End-tidal concentrations of sevoflurane and desflurane for ProSeal laryngeal mask airway removal in anaesthetised adults:a randomised double-blind study〔J〕.Eur J Anaesthesiol,2014,31(5):274-279.

