腹腔镜胃癌根治术对患者的疗效及对CEA、CA199的影响
崔恒锋 夏盛成 王爱坤 王立胜 程海燕
胃癌在我国肿瘤临床上是1种发病率位居前列位置的恶性肿瘤,其对患者的机体健康及生命安全均具有较大挑战。往常规使用的开腹手术对患者造成的创伤较大,且患者术后恢复较慢,寻找更具疗效及安全性的手术治疗方案逐渐引起临床医务工作者及患者自身的重视[1]。伴随微创外科手术的应用推广,腹腔镜胃癌根治术(laparoscopic radical gastrectomy,LRG)已成为了近年来逐渐兴起的手术方式[2]。本文通过比较LRG术式以及传统的开腹手术针对胃癌患者的疗效及安全性,旨在为胃癌患者的临床手术治疗提供更好的方案选择参考,现报告如下。
1 材料与方法
1.1 临床资料
选择从2015年1月至2016年9月在医院接受手术治疗的胃癌患者185例进行研究。男性103例,女性82例;年龄32~78岁,平均(54.87±1.25)岁。入选标准:①所有患者均经过病理检查确诊;②TNM分期为Ⅰ~Ⅲ期;③均有手术适应证;④患者家属均已签署了知情同意书。排除标准:①其他类型肿瘤;②有血液疾病;③病历数据丢失。根据手术方案的不同将患者分成观察组(LRG术式)95例及对照组(传统的开腹术式)90例,其中观察组男性56例,女性39例;年龄32~75岁,平均(53.99±2.04)岁。TNM分期:Ⅰ期15例,Ⅱ期38例,Ⅲ期42例。分化程度:高分化40例,中分化42例,低分化8例。对照组男性47例,女性43例;年龄35~78岁,平均(54.29±2.16)岁。TNM分期:Ⅰ期14例,Ⅱ期40例,Ⅲ期36例。分化程度:高分化41例,中分化45例,低分化4例。比较两组的上述数据,差异无统计学意义(P>0.05)。本次研究已经过医院伦理委员会的审核批准。
1.2 研究方法
对照组给予常规的开腹手术治疗,其中远端切除79例,全胃切除8例,近端切除3例。观察组给予LRG术式,全麻后选择五孔法,将CO2气腹维持于12~14 mmHg,取患者的脐下切口并放置腹腔镜,切除大网膜并切断其胃网膜的右血管。而后显露出结肠系膜的血管,将肝下缘的小网膜和胃右及左动脉一并切除,再依次游离其肝总动脉和固有动脉,以及门静脉和胆总管,最后行淋巴结清扫。其中远端切除80例,全胃切除10例,近端切除5例。
1.3 观察指标
分别在术前及术后5 d为患者采集其晨间空腹静脉血4 ml,行5 min的3 000 r/min离心之后将血清分离,取2 ml应用罗氏Cobas e601分析系统对CEA及CA199实施定量检测,其中试剂盒均为仪器配套试剂,另2 ml通过酶联免疫吸附(ELISA)法对IL-2及IL-6进行检测,相关试剂盒产自美国的Biosource公司,严格根据说明书的步骤进行相应的操作。对比两组手术疗效指标,不同时期的IL-2及IL-6炎症因子水平,CEA及CA199水平,以及术后并发症的发生情况。
1.4 统计学方法
应用SPSS 21.0统计软件分析,计数数据的比较采用χ2检验,计量数据利用(±s)表示,实施t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组手术疗效指标的对比
观察组除淋巴结清扫数目较对照组无明显差异外,其切口长度和手术时间,及术中出血量和排气时间,以及住院时间均明显优于对照组,差异均有统计学意义(P<0.05),见表1。
表1 2组手术疗效指标的对比(±s)
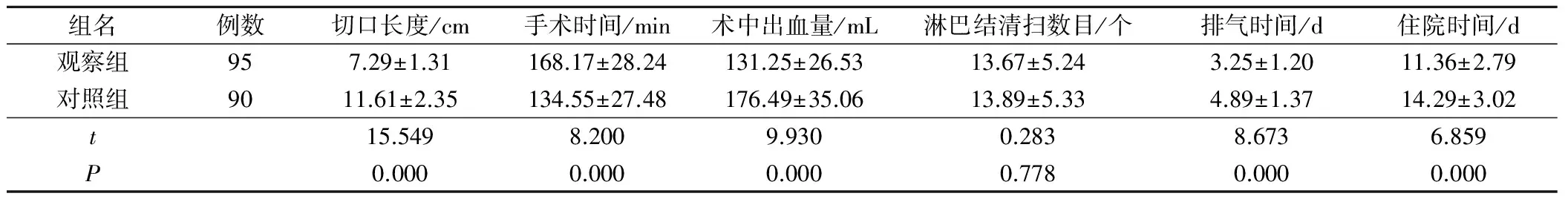
表1 2组手术疗效指标的对比(±s)
组名例数切口长度/cm手术时间/min术中出血量/mL淋巴结清扫数目/个排气时间/d住院时间/d观察组957.29±1.31168.17±28.24131.25±26.5313.67±5.243.25±1.2011.36±2.79对照组9011.61±2.35134.55±27.48176.49±35.0613.89±5.334.89±1.3714.29±3.02t15.5498.2009.9300.2838.6736.859P0.0000.0000.0000.7780.0000.000
2.2 两组不同时期IL-2及IL-6炎症因子水平的对比
两组术前IL-2及IL-6水平相比,差异无统计学意义(P>0.05)。术后5 d两组的IL-2及IL-6水平明显高于术前,但观察组的IL-2及IL-6水平仍明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组不同时期IL-2及IL-6炎症因子水平的对比[(±s),(ng·L-1)]
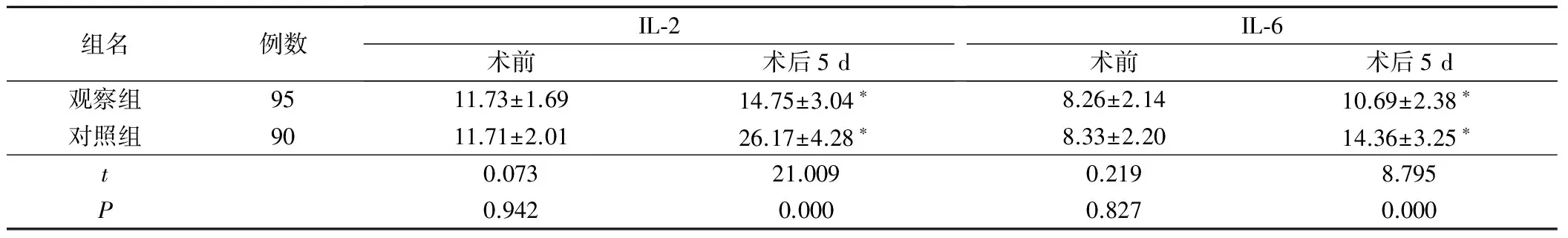
表2 两组不同时期IL-2及IL-6炎症因子水平的对比[(±s),(ng·L-1)]
组名例数IL⁃2术前术后5dIL⁃6术前术后5d观察组9511.73±1.6914.75±3.04∗8.26±2.1410.69±2.38∗对照组9011.71±2.0126.17±4.28∗8.33±2.2014.36±3.25∗t0.07321.0090.2198.795P0.9420.0000.8270.000
注:与术前相比,*为P<0.05。
2.3 两组不同时期CEA及CA199水平的对比
两组术前CEA及CA199水平的相比,差异无统计学意义(P>0.05)。两组术后5 d CEA及CA199水平相比差异不显著(P>0.05),但均明显低于术前,差异有统计学意义(P<0.05),见表3。
表3 两组不同时期CEA及CA199水平对比(±s)

表3 两组不同时期CEA及CA199水平对比(±s)
组名例数CEA/(ng·mL-1)术前术后5dCA199/(U·mL-1)术前术后5d观察组952.84±0.371.94±0.32∗9.27±2.585.23±1.04∗对照组902.91±0.291.98±0.26∗9.25±2.615.18±1.23∗t1.4270.9300.0520.299P0.1550.3540.9580.765
注:与术前相比,*为P<0.05。
2.4 两组术后并发症的发生情况对比
观察组术后并发症总发生率为2.11%,明显低于对照组的8.89%,差异有统计学意义(P<0.05),见表4。
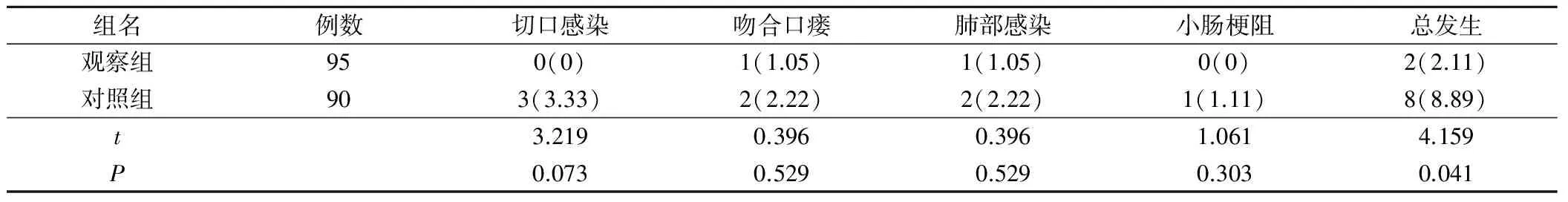
表4 两组术后并发症发生情况比较(例,%)
3 讨论
胃癌属于临床上比较常见的发生于消化系统的恶性肿瘤,其发病率在整个消化系统癌症中大约占50%~63%,并因其导致的死亡率长期位居癌症首位[3-4]。传统的开腹胃癌根治术在过去很长一段时间以来均是早期胃癌患者的重要治疗措施,但伴随腹腔镜技术的推广,当前很多患者更倾向接受腹腔镜辅助下的胃癌根治术。
本文通过对比研究后发现,观察组除淋巴结清扫数目较对照组无明显差异外,其切口长度和手术时间,及术中出血量和排气时间,以及住院时间均分别明显少于对照组,符合张浩等[5-6]的报道结果,提示观察组应用的术式可减少对患者的损伤,同时促进其康复。分析原因,可能是与腹腔镜辅助下的胃癌根治术是1种微创术式,对患者机体造成的创伤相对较小等因素有关。同时,术后5 d两组的IL-2及IL-6水平明显高于术前,但观察组的IL-2及IL-6水平仍明显低于对照组,这提示观察组应用的LRG术式造成的炎症症状更加轻微。IL-2及IL-6均是炎症因子,二者的表达与患者在术后的出血量及手术创伤,以及疼痛症状均具有紧密联系,而观察组所用的LRG术式相比与对照组在上述方面更具优势,因此产生的炎症症状也较小[7-8]。而在肿瘤标记物方面,两组术后5 d的CEA及CA199水平相比差异不显著,但均明显低于术前,提示两组所用术式均可以较好地改善患者机体中CEA及CA199的含量水平,我们考虑原因可能是因为不论是LRG术式还是传统的开腹手术,均是以根治胃癌瘤灶为治疗目的,而肿瘤标记物在机体内的含量水平主要通过肿瘤的情况而呈现,当术后两组患者的肿瘤灶被切除后,CEA及CA199均共同表现出明显下降的趋势,但由于仅仅是手术方式的不同,手术造成的瘤灶根治结果基本相似,因此两组患者术后组间的CEA及CA199水平比较差异均不显著[9-10]。
在手术的安全性方面,本文结果表明,观察组术后并发症的总发生率是2.11%,明显低于对照组的8.89%,提示观察组应用的LRG术式具有更好的安全性及预后效果。这与刘忠伟等[11-13]的报道结果基本相符,其在报道中指出,LRG术式治疗胃癌产生的术后并发症几率较开腹手术可能低5%以上。究其原因,LRG术式在手术操作中具有较好的放大作用,可在镜下清晰地分辨解剖平面和病灶位置,及血管走行,这有助于更加彻底地切除瘤灶并清扫淋巴结,同时还可防止因开腹手术而引起的副损伤,因此较传统的开放性手术方案更加安全。这在Ma等[14-15]的报道结果中也可发现类似结论。
综上所述,利用LRG术式治疗胃癌患者可获得较好的疗效,同时还可有效降低CEA及CA199的水平,安全性较高,值得推广。
[1] 杨少辉,赵逸斌.腹腔镜胃癌根治术的疗效及对调节性T细胞的影响〔J〕.中国现代医生,2016,54(8):15-17.
[2] 谢有志,林宗伟,蓝光会,等.腹腔镜辅助胃癌根治术在进展期胃癌中的应用研究〔J〕.中国现代普通外科进展,2015,18(7):552-553.
[3] 马 飞,赵二江,姬社青,等.SiewertⅡ型、Ⅲ型胃食管结合部癌腹腔镜辅助根治性切除术后乳糜漏的影响因素探讨〔J〕.中华实验外科杂志,2016,33(3):775-777.
[4] Caruso S,Patriti A,Roviello F,et al.Laparoscopic and robot-assisted gastrectomy for gastric cancer:Current considerations〔J〕.World J Gastroenterol,2016,22(25):5694-5717.
[5] 张 浩,汤雪峰,刘 岗,等.局部晚期胃癌应用开腹与腹腔镜手术治疗的临床疗效分析〔J〕.中国医刊,2016,51(5):58-61.
[6] Hao Y,Yu P,Qian F,et al.Comparison of laparoscopy-assisted and open radical gastrectomy for advanced gastric cancer:A retrospective study in a single minimally invasive surgery center〔J〕.Medicine(Baltimore),2016,95(25):3936-3938.
[7] 邹瞭南,杨 双,莫德龙,等.腹腔镜 D2胃癌根治术术中出血原因与防治〔J〕.中华普外科手术学杂志(电子版),2016,10(1):41-43.
[8] Zhang X,Sun F,Li S,et al.A propensity score-matched case-control comparative study of laparoscopic and open gastrectomy for locally advanced gastric carcinoma〔J〕.J BUON,2016,21(1):118-124.
[9] 吉国锋,季福建,马 冲,等.腹腔镜辅助胃癌根治术治疗老年人胃癌临床疗效分析〔J〕.中华老年医学杂志,2016,35(3):292-295.
[10] Abdikarim I,Cao XY,Li SZ,et al.Enhanced recovery after surgery with laparoscopic radical gastrectomy for stomach carcinomas〔J〕.World J Gastroenterol,2015,21(47):13339-13344.
[11] 刘忠伟,张美华,邹瞭南,等.腹腔镜与开腹手术对胃癌根治术患者β-ep、TNF-α及IL-6水平的影响〔J〕.中国现代普通外科进展,2015,18(10):818-820.
[12] 夏亚斌,窦 千,黄晓旭,等.反穿刺技术在腹腔镜胃癌根治术中的应用〔J〕.中国微创外科杂志,2016,16(4):304-307.
[13] 史宏志,韩承新,武金虎,等.腹腔镜辅助与开腹胃癌根治术疗效的配对临床对照研究〔J〕.中国医药,2016,11(6):857-860.
[14] Ma Z,Bao X,Gu J,et al.Effects of laparoscopic radical gastrectomy and the influence on immune function and inflammatory factors〔J〕.Exp Ther Med,2016,12(2):983-986.
[15] Li HZ,Chen JX,Zheng Y,et al.Laparoscopic-assisted versus open radical gastrectomy for resectable gastric cancer:Systematic review,meta-analysis,and trial sequential analysis of randomized controlled trials〔J〕.J Surg Oncol,2016,113(7):756-767.

