DP2拮抗剂抑制哮喘模型小鼠气道炎症的作用机制及与激素的比较
董樑 龚益 朱柠 张媛媛 夏敬文 陈小东
支气管哮喘(简称哮喘)是最常见的慢性疾病之一,目前全球至少有3亿哮喘患者,在中国哮喘患者约有3 000万[1-3]。随着近年来空气污染的加重,哮喘的平均患病率也呈逐步上升趋势[4]。2006年第二期亚太地区哮喘认知和现状(Phase 2 of the asthma insights and reality in Asia-pacific)调查结果显示,亚太地区的哮喘患者只有2.5%达到了哮喘控制[5]。因此,如何更有效地控制哮喘已成为迫在眉睫的任务。
近来的研究发现哮喘的发生是固有免疫与适应性免疫相互作用、循环放大的结果,2型固有淋巴样细胞(type 2 innate lymphoid cells, ILC2) 是将两者连接在一起的纽带[6]。前列腺素D2(prostaglandin D2, PGD2) 是一种重要的前列腺素类物质,由肥大细胞等炎症细胞释放,可引起血管扩张、支气管强烈收缩,是过敏性疾病的重要调节介质[7-8]。PGD2通过三个G 蛋白偶联受体起效,分别为:DP1(PGD2receptor 1)、DP2(PGD2 receptor 2)/Th2细胞上表达的化学趋向性受体同种分子( the chemoattractant receptor homologous molecule expressed on Th2cells receptor, CRTH2)和血栓素A2受体(thromboxane A2receptor, TP)。相关文献报道PGD2可以通过结合ILC2表面受体促进它的迁移和细胞因子的分泌;而抑制PGD2的结合可以有效地限制ILC2的功能[9-10]。Fajt等[11]发现在重症或未控制的哮喘患者中PGD2和CRTH2(即DP2)的表达明显增多,说明DP2是PGD2的主要效应受体。因此,针对DP2拮抗剂的研究能帮助我们对哮喘患者进行更有效的治疗,是十分必要的。
我们既往的研究已成功构建哮喘小鼠模型,并发现DP2拮抗剂能抑制哮喘小鼠IL-4和IL-5的水平[12-14]。本研究拟通过检测哮喘小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)细胞分类计数和肺组织DP1、DP2蛋白的表达情况,进一步了解DP2拮抗剂抑制哮喘小鼠气道炎症的作用机制并比较其同吸入激素作用的差异。
资料与方法
一、主要试剂与设备
WH-2000 台式超声雾化器,卵白蛋白(Sigma公司),ProCyteDxTM全自动血细胞分析仪(IDEXX公司),CRTH2抗体(ProSci公司),DP1抗体(Abcam公司),辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jackson公司),BCA 蛋白定量试剂盒、NC膜(Millipore公司),BAYu3405( Cayman公司)。
二、实验方法
1. 动物模型构建: 24只SPF级BALB/c小鼠,雄性(复旦大学医学院实验动物中心提供),4~6周龄。随机分为四组,每组 6 只:正常对照组(A组)、哮喘组( B 组)、吸入激素干预组(应用普米克令舒雾化, C组)、DP2 拮抗剂干预组(应用DP2拮抗剂BAYu3405干预,D 组)。B、C、D组小鼠分别于第0天、第7天、第14天腹腔注射卵白蛋白(OVA)与佐剂氢氧化铝(AL(OH)3)致敏,于第 27至第29天以2% OVA生理盐水20 ml雾化30 min;A组以生理盐水代替OVA进行相同操作。C、D组在哮喘诱发的第27天起,予以给药干预,C组每次激发前20 min均行普米克令舒雾化,雾化浓度为0.8 mg/L,雾化时间10 min,D组诱喘后2 h予以BAYu3405,5 mg/kg口服。所有动物在最后一次诱喘18~24 h后(第30天)处死。
2. 样品采集: BALB/c小鼠用水和氯醛溶液麻醉后,剖开腹腔,显露气管后插管,在右肺门处钳夹,行左肺支气管肺泡灌洗,每次用生理盐水0.1 ml,共2~3次,回收BALF,使用ProCyteDxTM全自动血细胞分析仪进行分析。
3. 肺组织的DP1和DP2western检测: 小鼠处死后取右肺组织剪碎匀浆,冰上裂解30 min,4 ℃ 以离心半径8 cm,12 000 r/min离心10 min取上清,采用BCA法测定蛋白浓度。取10 μg蛋白质样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,蛋白转移至NC膜上。以5%封闭液封闭1 h,加入一抗(DP1抗体,1︰1 000,CRTH2抗体,1︰1 000)4 ℃过夜,辣根过氧化物酶(HRP)标记的羊抗兔二抗(1︰8 000)室温孵育1 h,采用ECL法显影。扫描蛋白条带,以β-actin为内参照进行半定量图像分析,用灰度比值表示各组蛋白相对含量,实验重复3次。
三、统计学方法
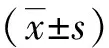
结 果
一、小鼠BALF中细胞分类变化
使用ProCyteDxTM全自动血细胞分析仪检测A、B、C、D四组小鼠BALF的细胞分类。结果发现,与A组相比,B、C、D三组的白细胞(white blood cell,WBC)计数,中性粒细胞(neutrophils, NEU)计数和嗜酸性粒细胞(eosinophils , EOS)计数均有明显增高(P<0.05);EOS计数C、D两组分别为(640±105)×103/ml和(580±149)×103/ml,较B组的(1 037±46)×103/ml均显著降低(P<0.01);C组的WBC计数为(1 187±160)×103/ml,低于B组的(1 797±150)×103/ml(P<0.01),D组的WBC计数为(1 250±161)×103/ml,与B组有统计学差异(P<0.05); B、C、D三组的NEU计数并未出现有统计学意义的变化,见图1。
二、小鼠肺组织DP1和DP2 蛋白表达情况
Western blot 结果显示A、C、D三组的DP1和DP2蛋白水平均显著低于B组(P<0.01);与A组相比,C组的DP2蛋白水平降低(P<0.05),D组的DP2蛋白水平显著下降(P<0.01),C、D两组之间亦有统计学上的差异(P<0.05);A、C、D三组的DP1蛋白表达未出现有统计学意义的变化,见图2。
讨 论
2016年GINA指南指出哮喘是一种异质性疾病[15],异质性是指同一疾病不同患者在个体上存在差异,这种个体差异是由不同的发病原因所致。哮喘的异质性通常包括哮喘表型和内型。表型主要包括患者的临床和病理生理学特征等,其中一个非常重要的类型就是嗜酸性粒细胞型哮喘。有研究通过建立哮喘和变应性皮炎的动物模型证实在体内激活CRTH2受体能够促进嗜酸性细胞浸润并会加重疾病的病理生理改变[16],而敲除CRTH2的小鼠出现气道嗜酸性粒细胞减少和其他慢性过敏性炎症反应的减轻[17]。本研究实验亦有相同发现,使用OVA诱发后的各组小鼠EOS计数均高于对照组(P<0.05),应用DP2拮抗剂干预后EOS计数较哮喘组显著下降(P<0.01)。以上这些结果表明,PGD2通过其受体参与了以嗜酸性粒细胞募集为特点的过敏性疾病。
DP2又称为CRTH2、GPCR44( G Protein Coupled Recptor 44),主要表达在Th2细胞,嗜酸细胞和嗜碱细胞表面。BAYu3405是一种DP2和TXA2双重受体拮抗剂[18]。Sugimoto等[19]表明口服BAYu3405(Ramatroban)能抑制PGD2诱导的体外EOS 迁移, 降低人类哮喘的气道高反应性和小鼠、大鼠、豚鼠抗原诱导的早发相和迟发相免疫炎症反应。Uller等[20]发现,用特异性受体拮抗剂TM30089,产生的效应与BAYu3405相同,推测BAYu3405是通过拮抗CRTH2受体而抑制嗜酸性粒细胞功能,并非通过TXA2受体作用所致。在本研究中,应用BAYu3405干预后,D组的DP2蛋白水平显著下降,低于正常对照组水平(P<0.01),这说明DP2拮抗剂通过抑制其蛋白表达水平发挥作用。
吸入激素是目前指南推荐治疗哮喘的首选药物,但事实上规律用药的患者仍有20%难以控制症状。在本研究中发现,与哮喘组相比,激素干预与DP2拮抗剂均能显著减少哮喘小鼠EOS计数、DP1和DP2蛋白含量(P<0.01)。但DP2拮抗剂较激素干预能更明显地抑制DP2的蛋白表达(P<0.05)。因此我们猜想是否在将来可以将DP2检测结果纳入哮喘的个体化治疗方案,使DP2拮抗剂成为哮喘治疗的新选择,这有待于进一步的临床研究。

图1 哮喘模型小鼠BALF细胞分类计数;注:A为白细胞计数;B中性粒细胞计数;C为嗜酸性粒细胞计数;图中A组为正常对照组,B组为哮喘组,C组为哮喘干预1组(应用普米克令舒雾化);D组为哮喘干预2组(应用DP2拮抗剂BAYu3405干预)。*与哮喘组比较,P<0.05,**与哮喘组比较,P<0.01

图2 哮喘模型小鼠肺组织DP1和DP2蛋白表达;注:A为DP1的Western blot结果;B为DP2的Western blot结果;C为DP1与β-actin灰度比的统计条图;D为DP2与β-actin灰度比值的统计条图;图中A组为正常对照组,B 组为哮喘组,C组为哮喘干预1组(应用普米克令舒雾化),D 组为哮喘干预2组(应用DP2拮抗剂BAYu3405干预)。*两组比较,P<0.05,**两组比较,P<0.01
总之,本研究表明DP2作为PGD2的主要效应受体,参与以嗜酸性粒细胞募集为特点过敏性疾病。DP2拮抗剂能抑制哮喘模型小鼠气道DP2蛋白表达水平,从而达到减少嗜酸性粒细胞浸润,控制哮喘的作用。DP2拮抗剂对DP2蛋白表达的抑制作用强于吸入激素,或可作为新的药物用于支气管哮喘的治疗。
参 考 文 献
1 王长征. 改善支气管哮喘控制现状,需要重视患者的长期管理[J/CD]. 中华肺部疾病杂志(电子版), 2013, 6 (4): 296-298.
2 史文花, 李少军, 刘璐, 等. 老年性支气管哮喘的研究进展[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(4): 489-492.
3 Song WJ, Kang MG, Chang YS, et al. Epidemiology of adult asthma in Asia: toward a better understanding[J]. Asia Pac Allergy, 2014, 4(2): 75-85.
4 Guan WJ, Zheng XY, Chung KF, et al. Impact of air pollution on the burden of chronic respiratory diseases in China: time for urgent action[J]. Lancet, 2016, 388(10054): 1939-1951.
5 Wong GW, Kwon N, Hong J G, et al. Pediatric asthma control in Asia: phase 2 of the Asthma Insights and Reality in Asia-Pacific (AIRIAP 2) survey[J]. Allergy, 2013, 68(4): 524-530.
6 Martinez-Gonzalez I, Steer CA,Takei F. Lung ILC2s link innate and adaptive responses in allergic inflammation[J]. Trends Immunol, 2015, 36(3): 189-195.
7 陈亚娟, 文富强, 刘代顺. PGD2/DP信号级联调控哮喘气道炎症及重构的研究进展[J]. 临床肺科杂志, 2007, 12(1): 59-61.
8 陈灵修, 冉丹华, 黄华萍, 等. 前列腺素D2受体调节PGD2诱导的人气道黏液高分泌[J]. 基础医学与临床, 2016, 36(1): 24-29.
9 Xue L, Salimi M, Panse I, et al. Prostaglandin D2activates group 2 innate lymphoid cells through chemoattractant receptor-homologous molecule expressed on TH2 cells[J]. J Allergy Clin Immunol, 2014, 133(4): 1184-1194.
10 Chang JE, Doherty TA, Baum R, et al. Prostaglandin D2regulates human type 2 innate lymphoid cell chemotaxis[J]. J Allergy Clin Immunol, 2014, 133(3): 899-901.
11 Fajt ML, Gelhaus SL, Freeman B, et al. Prostaglandin D(2) pathway upregulation: relation to asthma severity, control, and TH2 inflammation[J]. J Allergy Clin Immunol, 2013, 131(6): 1504-1512.
12 龚益, 董樑, 陈小东, 等. DP2拮抗剂对哮喘模型气道炎症的影响及与激素的比较[J]. 临床肺科杂志, 2015, 20(5): 841-845.
13 刘海霞, 金先桥. 前列腺素D2及其受体CRTH2与支气管哮喘的最新研究进展[J]. 国际呼吸杂志, 2014, 34(5): 354-359.
14 应延风, 李睿淳, 毛宇飞, 等. 大鼠支气管哮喘模型中前列腺素D2水平和嗜酸粒细胞上受体改变研究[J]. 国际呼吸杂志, 2010, 30(23): 1417-1420.
15 Global Initiative for Asthma (GINA). GINA Report, Global Strategy for Asthma Management and Prevention. 2016. Available from: http://ginasthma.org/2016-gina-report-global-strategy -for-asthma-management-and-prevention/.Accessed June 2016.
16 Spik I, Brenuchon C, Angeli V, et al. Activation of the prostaglandin D2receptor DP2/CRTH2increases allergic inflammation in mouse[J]. J Immunol, 2005, 174(6): 3703-3708.
17 Satoh T, Moroi R, Aritake K, et al. Prostaglandin D2plays an essential role in chronic allergic inflammation of the skin via CRTH2receptor[J]. J Immunol, 2006, 177(4): 2621-2629.
18 Ishizuka T, Matsui T, Okamoto Y, et al. Ramatroban (BAY u 3405): a novel dual antagonist of TXA2 receptor and CRTh2, a newly identified prostaglandin D2receptor[J]. Cardiovasc Drug Rev, 2004, 22(2): 71-90.
19 Sugimoto H, Shichijo M, Iino T, et al. An orally bioavailable small molecule antagonist of CRTH2, ramatroban (BAY u3405), inhibits prostaglandin D2-induced eosinophil migration in vitro[J]. J Pharmacol Exp Ther, 2003, 305(1): 347-352.
20 Uller L, Mathiesen JM, Alenmyr L, et al. Antagonism of the prostaglandin D2receptor CRTH2attenuates asthma pathology in mouse eosinophilic airway inflammation[J]. Respir Res, 2007, 8: 16.

