晚期非小细胞肺癌EML4-ALK融合变异体与克唑替尼治疗的临床分析
张鹤 宋正波 吕镗烽 陆志伟 吴娟 宋勇
肺癌是全球发生率和病死率最高的恶性肿瘤之一,其中85%肺癌为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1-3],而且50%~60%在就诊时已处于晚期[4],而晚期NSCLC患者已失去了手术根治的机会。近几年由于分子检测的发展,晚期NSCLC的治疗从以往基于组织病理学的细胞毒化疗,转变为以分子分型为基础的分子靶向治疗与放化疗、抗血管和免疫治疗相结合的治疗新模式。在2007年,Soda等[5]发现间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因重排或融合是NSCLC另一种较为常见的分子亚型,ALK重排患者约占NSCLC的5%,其中棘皮动物微管相关类蛋白4(EML4)基因与ALK融合(EML4-ALK)为最常见类型[6-8]。克唑替尼作为第一代靶向药用于ALK阳性的NSCLC患者,由于临床研究结果表明其客观有效率(objective response rate, ORR)高达约60%[9],因此克唑替尼在ALK融合基因阳性晚期NSCLC患者的一线治疗中占有首选地位[10]。 但是关于EML4-ALK融合基因,已有报道发现存在多种变异体,包括变异体1,2,3a,3b,4,5a和5b等[11]。根据目前的研究,ALK变异体之间是否与克唑替尼疗效相关仍然存在争议[11-14]。 因此,本研究收集来自皖南医学院弋矶山医院、南京大学医学院临床学院南京军区南京总医院自2013年9月至2017年5月收治的68例ALK阳性晚期NSCLC患者的临床病理特征及服用克唑替尼的近期疗效和不良反应进行分析,同时对于有足够初治标本的患者进行二代测序,分析其EML4-ALK变异体的发生率和与克唑替尼疗效的相关性,从而为克唑替尼的临床进一步应用提供依据。
资料与方法
一、一般资料
本研究共纳入68例患者,其中男性32例,女性36例,年龄28~62岁,中位年龄49岁;43例(63.2%)患者无吸烟史;美国东部肿瘤协作组体能状况(Eastern Cooperative Oncology Group performance status, ECOG PS)评分为0~1分的患者有57例(83.8%)。60例(88.2%)患者的病理类型为腺癌;临床分期包括ⅢB期4例,Ⅵ期64例。68例患者中,54例用Ventana ALK(罗氏,D5F3)融合蛋白IHC诊断ALK基因融合阳性,4例用FISH法检测ALK阳性,10例用RT-PCR法检测ALK阳性。38例患者既往接受过化疗,30例患者一线服用克唑替尼。初治时伴有脑转移患者有13例(19.1%),见表1。

表1 68例患者的一般特征
二、病例纳入标准和排除标准
1. 纳入标准: ①经组织学或细胞学证实的ⅢB~Ⅵ期NSCLC;②经Ventana ALK免疫组化法(immunohistochemistry, IHC)或荧光原位杂交法(fluorescence in situ hybridization, FISH)或RT-PCR检测ALK基因融合阳性;③至少有1个可测量的临床病灶;④ECOG PS评分≤3分;⑤骨髓造血功能和肝肾功能基本正常。
2. 排除标准: ①患者任何可证实的严重心肺疾病;②患有严重的习惯性腹泻或便秘,以及其他影响药物吸收的消化系统疾病。
三、 治疗方案及评估
1. 药物治疗: 患者口服克唑替尼胶囊250 mg/次,2次/d,直至出现任何疾病进展(progressive disease, PD)的客观证据,或发生不可耐受的不良事件。
2. 二代测序: 收集肺癌患者甲醛固定石蜡包埋(FFPE)组织,从甲醛固定的石蜡切片中提取肿瘤DNA,并将其打断,扩增,从而建立含目标基因的全基因组文库。然后采用Illumina Hiseq 4000 (Illumina, San Diego, USA) 测序平台进行测序,将得到的原始数据进行过滤并行生物信息学分析。
3. 近期疗效: 根据实体瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumours1.1, RECIST 1.1)评价疗效,分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。客观有效率(objective response rate, ORR)包括CR和PR; 疾病控制率(disease control rate, DCR)包括CR、PR、SD。
4. 不良反应评估: 按照美国国立癌症研究所制定的通用毒性标准4.0(common toxicity criteria 4.0,CTC 4.0)评价不良反应,分为0~Ⅵ度共5个等级。
5. 随访: 68例患者均获得随访。患者无进展生存期通过门诊或电话随访获得,末次随访时间为2017年10月30日。总生存期(overall survival, OS)指患者自首次治疗起到患者死亡或末次随访的时间。无进展生存期(progression free survival, PFS)定义为患者自服用克唑替尼开始到明确疾病进展的时间。
四、统计学方法
应用SPSS19.0软件进行统计学分析。对于不同亚组间疗效比较应用χ2检验;对生存时间分析应用Kaplan-Meier、Log-rank和Cox回归进行检验和多因素分析;P<0.05为差异具有统计学意义。
结 果
一、 NGS检测结果
42例ALK阳性患者可获取初治标本进行NGS检测,其中35例(83.3%)检测出ALK融合,7例患者未检测出ALK阳性结果。35例EML4-ALK融合患者中,15例(42.9%)为变异体1(EX13︰EX20),7例(20.0%)为变异体2(EX20︰EX20),6例(17.1%)为变异体3(EX6︰EX20),3例为变异体5(EX2:EX20),1例为变异体7(EX14︰EX20),3例为新变异体(EX13︰EX19;EX18︰EX17;EX21︰EX20)。
二、 临床疗效评价
68例患者治疗28 d后评价疗效,其中CR 4例,PR 38例,SD 16例,PD 10例。ORR达61.8%,DCR为85.3%。68例患者中位PFS为10.5个月(95% CI: 7.47 ~13.5个月),中位OS为33.9个月 (95% CI: 25.85~42.08个月)。单因素和COX多因素回归分析表明是否吸烟、性别、年龄、PS评分、是否脑转移、是否一线使用克唑替尼是否影响PFS的独立因素,结果显示均没有统计学差异(P>0.05)。
三、变异体与临床疗效分析
将35例EML4-ALK融合二代测序检测结果分为变异体1(15例)和非变异体1(20例)两组,其中两组在性别、年龄、吸烟、PS评分、既往化疗、是否脑转移均没有差异(P>0.05),见表 2。35例患者中位PFS为10.7个月(95% CI: 8.22~13.23个月),中位OS为27.3个月(95% CI: 17.40~37.25个月)。变异体1和非变异体1两组的中位PFS分别是10.7个月和9.8个月,无统计学差异(P=0.647),见图1。两组的中位OS无统计学差异(27.33个月vs. 22.40个月,P=0.831)。

图1 35例EML4-ALK变异体1和非变异体1患者的中位PFS比较(10.7vs. 9.8个月,P=0.647)
四、不良反应
克唑替尼治疗的主要不良反应是视觉影响和消化道反应;共25例(36.8%)患者发生视觉闪烁;恶心呕吐发生率为30.9%(21/68),腹泻发生率为26.5%(18/68);共17例(25.0%)患者有轻度肝功能异常;6例患者出现双下肢浮肿。2例患者出现骨髓抑制;3例患者出现窦性心动过缓,但未观察到Q-T间期延长。1例患者因Ⅱ度食管溃疡减量至200 mg/次,2次/d。Ⅲ~Ⅳ度不良反应发生率较低,3例患者出现了Ⅲ~Ⅳ度肝功能异常。1例患者因间质性肺炎而停药,见表3。
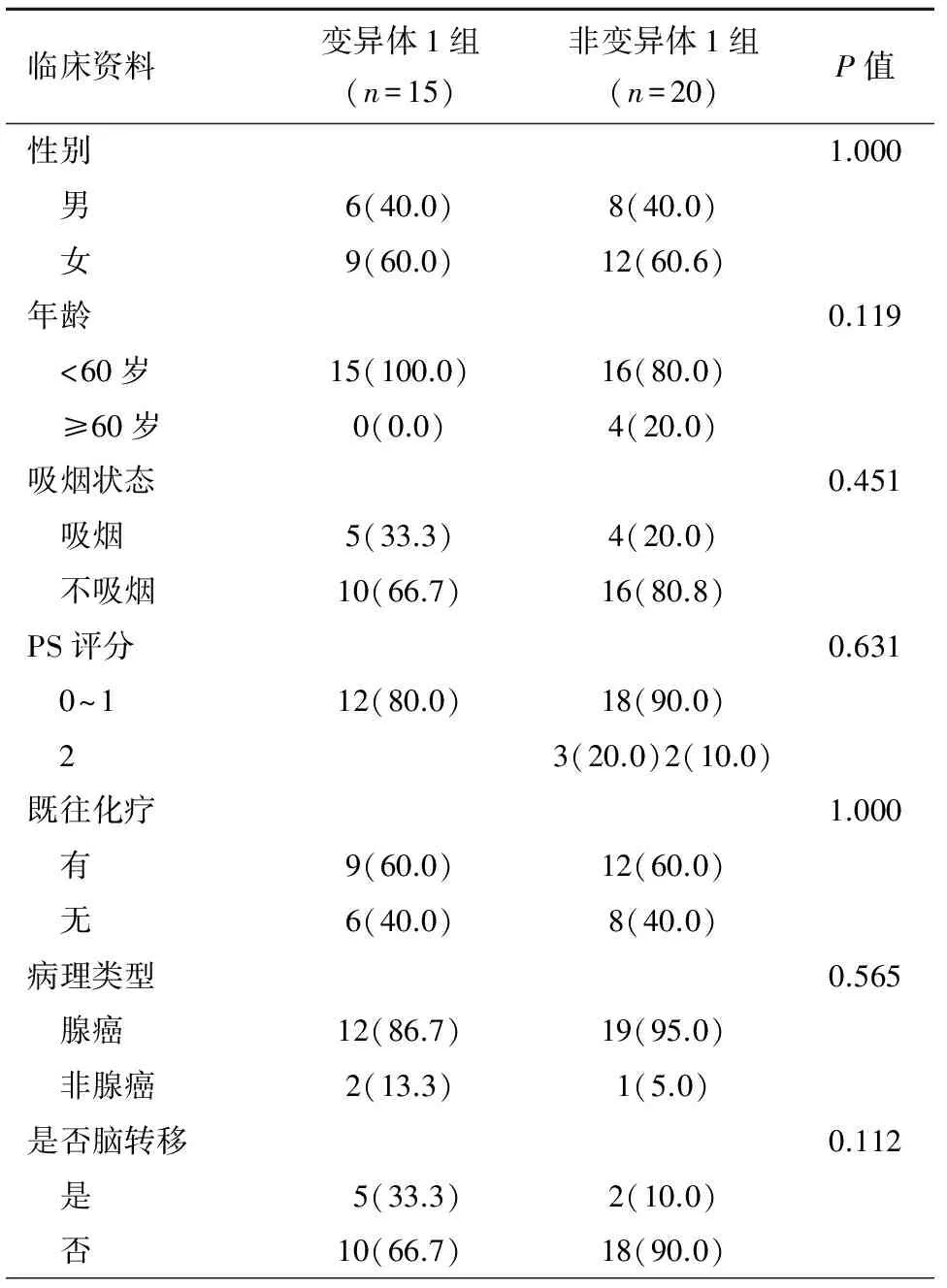
表2 35例患者EML4-ALK变异体的一般特征[n(%)]

表3 68例患者克唑替尼治疗后的不良反应
讨 论
目前,精准个体化治疗已经成为肺癌治疗的研究热点,对于有驱动基因阳性的患者,相对应的靶向药物成为治疗的首选。EML4-ALK基因融合继EGFR基因突变之后常见于非小细胞肺癌的患者,而针对EML4-ALK重排的第一代靶向药物就是克唑替尼[15]。克唑替尼是口服的小分子多靶点酪氨酸激酶抑制剂,是全球首个针对ALK融合基因开发的分子靶向药物,也是第一代ALK-TKI,对ALK和c-MET具有高选择性抑制作用[16]。PROFILE1029的研究是对比培美曲塞联合顺铂化疗一线治疗ALK阳性患者,该研究约90%受试者来自中国,研究结果显示克唑替尼的PFS比化疗明显延长(11.1个月vs. 6.8个月,P<0.001),两组的ORR分别是88%和46%。但是,在ALK阳性的患者中疗效不尽相同,存在个体化差异,探索疗效差异也是目前临床的热点。其中一个方面,已经发现EML4-ALK融合基因存在多种变异体,至少有15种变异体的存在[17],根据研究表明不同变异体的表达对疗效可能有一定的影响,但是何种变异体对克唑替尼的治疗有影响仍然存在争议。因此,本研究在分析克唑替尼治疗ALK阳性患者的疗效和安全性的同时,利用二代测序技术进一步探究EML4-ALK变异体对克唑替尼的疗效是否存在影响。
本研究中,克唑替尼治疗ALK阳性患者的ORR是61.8%,中位PFS为10.5个月,以及中位OS为33.9个月。克唑替尼作为二线治疗的随机Ⅲ期临床研究PROFILE1007显示克唑替尼的中位PFS为7.7个月[18],ORR达65%。作为一线治疗的随机Ⅲ期临床研究PROFILE1014和PROFILE1029分别显示克唑替尼治疗的中位PFS为10.9个月和11.1个月,ORR分别是74%和88%。本研究中38例患者既往接受过化疗,但其临床疗效仍与既往报道类似,克唑替尼与传统化疗治疗的方案在ALK阳性晚期NSCLC治疗上具有明显优势。
在2010年第一次有文献报道有关在ALK变异体患者中采用克唑替尼治疗的疗效分析[19],但发现了1例变异体2的患者。随后有几项回顾性的研究探索了变异体与克唑替尼之间的疗效。Yoshida等[14]用RT-PCR的方法对35例使用克唑替尼治疗的患者进行检测,发现ALK变异体1最常发生(54%),然后是变异体2(14%)和变异体3(12%),在疗效分析中显示变异体1与非变异体1相比,不仅ORR更高(74%vs. 63%),中位PFS也明显延长,并且有统计学差异(11.0个月vs. 4.2个月,P<0.05)。Lei等[16]的研究发现克唑替尼的疗效与变异体之间没有相关性,他们将61例患者分成3组,变异体1、变异体3和其他变异体,3组的中位PFS分别是11.0个月、10.9个月和7.4个月(P=0.795)。Cha等[20]的研究纳入52例ALK阳性患者,发现变异体1最常见(19.2%),其次是变异体3a/b占19.2%,变异体2占5.8%。上述研究表明变异体之间与克唑替尼的疗效没有差异。此外,在Woo等[13]研究中,他们利用RT-PCR方法检测54例晚期ALK阳性患者,变异体3a/b是最常见类型(44.4%),其次是变异体1(33.3%)和变异体2(11.1%),而在ALK-TKI(克唑替尼、色瑞替尼、艾乐替尼)治疗的2年生存率(26.4%vs. 76.0%,P=0.034)和2年PFS率(32.7%vs. 69.0%,P=0.108)均是变异体3a/b低于变异体1/2/其他,这提示变异体3可能和ALK抑制剂的耐药相关。在本研究中,变异体1和非变异体1两组的中位PFS(10.7个月和9.8个月,P=0.647)和两组的中位OS(27.33个月vs. 22.40个月,P=0.831)均没有差异。因此,我们认为ALK抑制剂与EML4-ALK融合基因中的疗效相关性仍未有定论,也可能与不同研究纳入的患者接受ALK抑制剂治疗的线数不同影响结果有关。在将来可以采用扩大样本量进行前瞻性研究,同时采用高通量测序,进一步了解是否变异体之间的不同会伴有不同的其他基因突变影响抑制剂的疗效,尚值得进一步探索。
在不良反应方面,本研究中克唑替尼主要是视觉影响(36.8%)和消化道的不良反应,包括恶心呕吐(30.9%)和腹泻(26.5%),且均为轻度,与之前的一些研究报道的常见不良反应类似[9-10,18]。此外,在克唑替尼治疗过程中出现少数患者(25.0%)肝功能异常,主要体现在转氨酶升高,但转氨酶升高通常是可逆的,经对症治疗后仍能以同样剂量继续治疗,但需要在治疗中关注。报道表明应用克唑替尼可发生Q-T间期延长和心动过缓等心律失常,但本研究中未有Q-T间期延长发生,仅3例出现心动过缓,且在未出现不能耐受的情况仍继续治疗。另一方面,仅1例患者出现Ⅱ度食管溃疡在减量200 mg bid后能继续接受治疗。1例患者因间质性肺炎而停药。因此,克唑替尼的治疗是具有较好的安全性,大多数患者均能耐受。
本研究尚存在一定的局限性,对于二代测序的例数仍较小样本,尚需要更大样本量的研究探索。此外利用二代测序中有7例患者未检测出ALK融合,这可能与肿瘤异质性相关。今后,可以选择合适的病例、搜集足够的大样本并利用高通量测序,设计研究来进一步证实ALK阳性在我国患者中变异体的最常见类型以及与ALK抑制剂的相关性。
总之,对于ALK阳性晚期NSCLC患者可选择克唑替尼作为首选治疗,其疗效明显,不良反应可耐受。EML4-ALK变异体之间与克唑替尼的相关性不明显,尚需要大样本的研究进一步验证。
参 考 文 献
1 钱桂生. 肺癌不同病程类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志: 电子版, 2011, 4(1): 1-6.
2 李羲, 钱桂生. 肺癌临床的罕见表现[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(1): 4-7.
3 Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
4 Ettinger D, Bepler G, Bueno R, et al. Non-small cell lung cancer clinical practice guidelines in oncology [J]. J Natl Compr Canc Netw, 2006, 4(6): 548-582.
5 Soda M, Choi Y, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer [J]. Nature, 2007, 448(7153): 561-566.
6 Hong M, Kim RN, Song JY, et al. HIP1-ALK, a novel fusion protein identified in lung adenocarcinoma[J]. J Thorac Oncol, 2014, 9(3): 419-422.
7 Ou SH, Bartlett CH, Mino-Kenudson M, et al. Crizotinib for the treatment of ALK-rearranged non-small cell lung cancer: a success story to usher in the second decade of molecular targeted therapy in oncology[J]. Oncologist, 2012, 17(11): 1351-1375.
8 Takeuchi K, Choi YL, Togashi Y, et al. KIF5B-ALK, a novel fusion onco-kinase identified by an immunohistochemistry-based diagnostic system for ALK-positive lung cancer [J]. Clin Cancer Res, 2009, 15(9): 3143-3149.
9 Crino L, Kim D, Riely GJ, et al. Initial phase Ⅱ results with crizotinib in advanced ALK-positive non-small cell lung cancer (NSCLC): PROFILE 1005[J]. J Clin Oncol, 2011, 29(suppl 1): 7514-7514.
10 Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J]. N Engl J Med, 2014, 371(23): 2167-2177.
11 Takeuchi K, Choi Y L, Soda M, et al. Multiplex reverse transcription-PCR screening for EML4-ALK fusion transcripts[J]. Clin Cancer Res, 2008, 14(20): 6618-6624.
12 Lei YY, Yang JJ, Zhang XC, et al. Anaplastic lymphoma kinase variants and the percentage of ALK-Positive tumor cells and the efficacy of crizotinib in advanced NSCLC[J]. Clin Lung Cancer, 2016, 17(3): 223-231.
13 Woo CG, Seo S, Kim SW, et al. Differential protein stability and clinical responses of EML4-ALKfusion variants to various ALK inhibitors in advanced ALK-rearranged non-small cell lung cancer[J]. Ann Oncol, 2016, 28(4): 791-797.
14 Yoshida T, Oya Y, Tanaka K, et al. Differential Crizotinib response duration among ALK fusion variants in ALK-Positive Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2016, 34(28): 3383-3389.
15 刘春花, 宋勇. 克里唑替尼在非小细胞肺癌治疗中的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(1): 91-93.
16 Christensen J, Zou H, Arango M, et al. Cytoreductive antitumor activity of PF-2341066, a novel inhibitor of anaplastic lymphoma kinase and c-Met, in experimental models of anaplastic large-cell lymphoma[J]. Mol Cancer Ther, 2007, 6(12): 3314-3322.
17 Horn L, Pao W. EML4-ALK: Honing in on a new target in non-small-cell lung cancer[J]. J Clin Oncol, 2009, 27(26): 4232-4235.
18 Shaw A, Kim D, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer[J]. N Engl J Med, 2013, 368(25): 2385-2394.
19 Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer[J]. N Engl J Med, 2010, 363(18): 1693-1703.
20 Cha YJ, Kim HR, Shim HS. Clinical outcomes in ALK-rearranged lung adenocarcinomas according to ALK fusion variants[J]. J Transl Med, 2016, 14(1): 296.

