晚发型老年抑郁症发病相关因素分析
王静华,李伟,岳玲,洪波,安娜,李冠军,肖世富
1.背景
随着人口的老龄化,老年人的各种精神疾病倍受关注。老年抑郁症是老年人最常见且危害性大的精神疾病之一,国外报道≥65岁的老年人抑郁症的患病率为3.7%~10%[1]。而我国相关研究报告老年抑郁患病率高达39.86%[2],给家庭和社会带来沉重的心理和经济负担,也是严峻公共卫生问题之一。老年期首发的抑郁障碍,即晚发型老年抑郁症(late-onset depression,LOD)作为抑郁障碍的一种特殊亚型,其特征为多种情绪症状合并认知功能受损[3]。最新的研究指出,LOD常合并有多种与痴呆相关的病理改变,是阿尔茨海默病(Alzheimer’s disease, AD)恶化的风险因素之一[4]。目前对于LOD这个亚型研究较少,临床上没有专门用于治疗LOD的药物,更没有用于诊断LOD的生物标志物[5]。前期的研究发现,LOD患者常出现额叶白质病变和基底节损伤[6]。但也有研究指出,脑白质高信号(white matter hyperintensity ,WMH)是LOD发病的核心机制[7]。与早发型抑郁症(early onset depression, EOD)相比,LOD患者呈现出更严重的WMH与认知功能障碍[8]。鉴于研究结论的不一致,且前期的研究并未全面的纳入与抑郁相关的社会及心理学因素,因此,本研究将着重探讨LOD患者的抑郁症状与脑结构(包括脑白质高信号及内侧颞叶萎缩)之间的内在联系,并试图寻找影响LOD患者预后及转归的相关因素。
2.方法
2.1 研究对象
研究流程表见图1。选取2014-2016年间在上海市精神卫生中心住院的晚发型老年抑郁患者作为研究对象。入组标准:(a)符合《国际疾病分类(第10版)》(International Classification of Diseases,tenth edition,ICD-10)抑郁症的诊断标准;(b)首发年龄>60岁;(c)17项汉密尔顿抑郁量表评分(Hamilton Depression Rating Scale, HAMD-17)评分≥20分;(d)简易智力状态检查(Mini-Mental State Examination, MMSE)评分:文盲≥17分;小学教育程度者≥20分,中学及以上文化程度者≥24分;(e)既往无轻躁狂、躁狂表现。排除标准:(i)精神活性物质、躯体疾病、痴呆及其他精神疾病所导致的抑郁障碍;(ii)早发型抑郁障碍及双相情感障碍;(iii)合并有严重器质性疾病、糖尿病、内分泌疾病、烟酒物质依赖者;(iiii)体内有金属移植物不能完成MRI检查者。所有病例需由2名副主任医师以上的精神科医师确诊。共入组32例,其中5例首发年龄小于60岁,2例影像检查分别为双侧顶叶软化灶和左额叶软化灶,另1例诊断更改为器质性心境障碍(多系统萎缩)而排除,最终符合入组排除标准的共有24例。同时通过招募,纳入了23名正常对照(healthy control, HC)作为研究对象,两组间的性别(X2=1.705, p=0.244)、年龄(t=0.419, p=0.678)、文化程度(t=1.478, p=0.146),躯体疾病(脑血管高危因素X2=0.171, p=0.766;高血压X2=1.733, p=0.248;心脏病X2=0.865, p=0.416;糖尿病X2=3.179, p=0.137;高血脂X2=0.865, p=0.416;脑卒中X2=0.001, p=1;恶性肿瘤X2=0.979, p=1)无统计学差异。研究前已由患者或监护人签署知情同意书,本课题已获上海市精神卫生中心伦理委员会的批准。
2.2 研究方法
2.2.1 头颅MRI检查
采用德国西门子公司3.0 Tesla高场强MRI检测仪对受试者进行MRI扫描。扫描线圈为12 通道线圈。MRI 检测时包括T1,T2 加权及FLAIR加权像扫描,观察受试者脑形态学表现,排除有明显脑器质性疾病的患者。参数如下:自旋回波(spin-echo,SE)序列横断面T2加权像(T2WI):重复时间(repetition time,TR)/回波时间 ( time of echo,TE)=4000/117 ms,层厚5.0 mm,层间隙1.5 mm,视野(Field of view,FOV)=230 mm,矩阵(Matrix)=320;FLAIR加权像:重复时间(TR)/回波时间(TE)=8500/94 ms,层厚5.0 mm,层间隙1.5 mm,视野(Field of view,FOV)=230 mm,矩阵(Matrix)=256。
2.2.2 脑白质变性分级
根据T2WI及FLAIR序列行视觉量表评估,选择Fazekas量表作为评估脑白质变性程度的方法,国内外的研究结果显示该量表信效度较好,适用于临床[9]。Fazekas量表将脑室旁高信号(Periventricular white matte rhyperintensity,PWMH)和深部白质高信号(Deep white matter hyperintensity, DWMH)病变分开评分。评分标准如下:脑室旁高信号评分:(a) 0分:无病变;(b) 1分:帽状或者铅笔样薄层病变;(c) 2分:病变呈光滑的晕圈;(d) 3分:不规则的脑室旁高信号,延伸到深部白质;深部白质信号:(a) 0分:无病变;(b) 1分:点状病变;(c) 2分:病变开始融合;(d) 3分:病变大面积融合。Fazekas评分:0级:没有或一个WMH病变信号斑点;1级:多个病变信号;2级:病灶开始相互融合(桥形成);3级:融合成大的病灶。多数研究认为Fazekas 2和3级是病理性的,有残疾的高风险。按照国外对脑白质研究的方法[9],认为Fazekas0-1分为正常;2-3分认为存在脑白质高信号。

图1.流程图
2.2.3 颞叶萎缩分级
根据T1W1层面行视觉量表评估,以内侧颞叶萎缩评定量表[10](Medial temporal lobes Atrophy, MTA-scale)作为评估颞叶萎缩的方法:在脑桥前面水平选择一层通过海马体部的冠状位层面,评分标准:0级:无萎缩;1级:仅有脉络膜裂的增宽;2级:同时伴有侧脑室颞角的扩大;3级:海马高度下降;4级:海马体积重度缩小。
2.2.4 抑郁症状的评估及相关因素的调查
两组受试者均需完成抑郁症状的评估,所采用的评估工具为汉密尔顿抑郁量表(HAMD)[11]。除此以外,我们还调查了可能与抑郁相关的影响因素,如日常生活方式(是否饮酒、吸烟等)、宗教信仰、家庭收入、家庭是否和睦等。调查的方式为标准化的问卷调查,包括性别(男性、女性),年龄(年),受教育程度(年),职业(体力劳动、脑力劳动),宗教信仰(有、无),婚姻状况(已婚、离异、丧偶),人格类型(外向型、内向型、混合型),吸烟(是、否),饮酒(是、否),固定收入(是、否),居住地(农村、城市)以及家庭是否和睦(是、否)。
2.3 统计方法
采用描述性的分析方法,连续变量以均值(标准差)的形式进行表达,分类变量表以百分比(%)的形式进行表达。所采用的统计工具为SPSS 20。两组间的连续变量采用独立样本t检验进行分析,分类变量以Pearson x2或者Fisher精确检验进行分析,p<0.05被认为具有统计学差异。当筛选出两组有差异的变量后,我们以HAMD总分作为因变量,采用逐步线性回归分析来筛选有抑郁相关的影响因素,同样p<0.05被认为具有统计学差异。
3.结果
两组间的性别、年龄、职业性质、婚姻状况、病前性格、吸烟、饮酒、固定收入和居住地之间无统计学差异;与LOD组相比,正常对照组中有更多的人具有宗教信仰(Fisher精确检验:p=0.002),而且家庭也更和睦(Fisher精确检验:p=0.050),差异具有统计学意义;同时,正常对照组的HAMD总分要显著的低于LOD组(t=17.381, p<0.001)。其统计学结果如表1所示。
如表2 所示。两组在脑室旁高信号(PWMH)评分和脑白质高信号(WMH)评级上存在统计学意义(Fisher精确检验:p=0.031;X2=7.817,p=0.008),而其深部脑白质高信号(DWMH)和内侧颞叶萎缩的评分则无统计学意义(Fisher精确检验:p=0.265;p=0.253)。两组典型病例Fazekas评分见图2,图3。对LOD组脑室旁高信号(PWMH)评分和脑白质高信号(WMH)评级与发病年龄作进一步Pearson相关分析,统计结果显示无相关性(t= -0.035,p=0.881;t= -0.342,p= 0.129),见表3。
如表4所示。逐步线性回归(因变量为HAMD量表总分,自变量为宗教信仰、家庭和睦和白质异常评分总分)的结果显示宗教信仰、家庭是否和睦和脑白质异常评分是抑郁症状的影响因素(t=3.347,p=0.002;t=3.164,p=0.003;t=3.404,p=0.001)。
4.讨论
4.1 主要发现
LOD与早发型抑郁症既有一些相同的发病因素,但前者还包括了老年人本身器质性因素(脑退行性变与脑血管病变等)以及这个年龄阶段相关的特殊社会心理因素。本研究通过LOD组和相匹配的正常组的比较,发现LOD组中有更多的个体存在着严重的脑白质损伤(72.9%),同时逐步线性回归的结果表明脑白质评级异常是抑郁症状的相关因素。前期研究指出,脑白质高信号是LOD的影响因素[12],甚至在排除年龄、高血压、糖尿病和缺血性心脏病等因素后,LOD患者额叶白质损害体积仍显著高于对照组[13];弥散张量成像(di ff usion tensor imaging,DTI)也显示LOD在额叶、颞叶和中脑区的白质纤维完整性受损,发病过程中边缘-眶额网络破坏,其白质异常比早发型抑郁症(EOD)更常见、更明显[14]。而Maillard[15]等进一步的研究发现脑白质高信号可以导致LOD患者认知功能下降。老年人小血管和微小血管累积损伤是普遍的神经病理过程,导致抑郁和认知功能下降。深部白质高信号是LOD发作的一个重要的风险因素。本结论与我们以前的发现脑室旁白质高信号是影响LOD的因素不一致。可能源于我们的研究样本量比较小的原因。
脑白质损伤对抑郁的影响机制可能包括以下两个方面:1)首先,脑白质病变多提示小血管病变,血供差从而抑制轴突的功能(影响某些神经递质的产生及释放)[15];2)其次,脑白质内有很多神经纤维穿过,这些神经纤维可构成某些神经环路,一旦脑白质受损,这些神经纤维也可能受到损伤,从而导致神经环路的中断,进而促进抑郁发病[16]。在本研究中,尽管LOD组与正常组的年龄、性别相匹配,但我们仍发现正常老人中有部分人群存在脑白质的重度受损。Vonetta[17]等认为一方面由于老年人本身WMH的变异较大,另一方面认为LOD与活动性缺血引起的脑白质损伤关系更大,而不是单纯的WMH的负累程度;而“血管性抑郁假说”机制更是提出,LOD除了脑血管疾病和WMH的核心作用外,只有在与年龄,躯体疾病和社会心理因素共同作用达到一定严重程度时,才能导致情绪调节环路的异常和认知改变[18]。所以脑白质损伤是否为LOD的病理机制,还需要做进一步的研究和探讨。
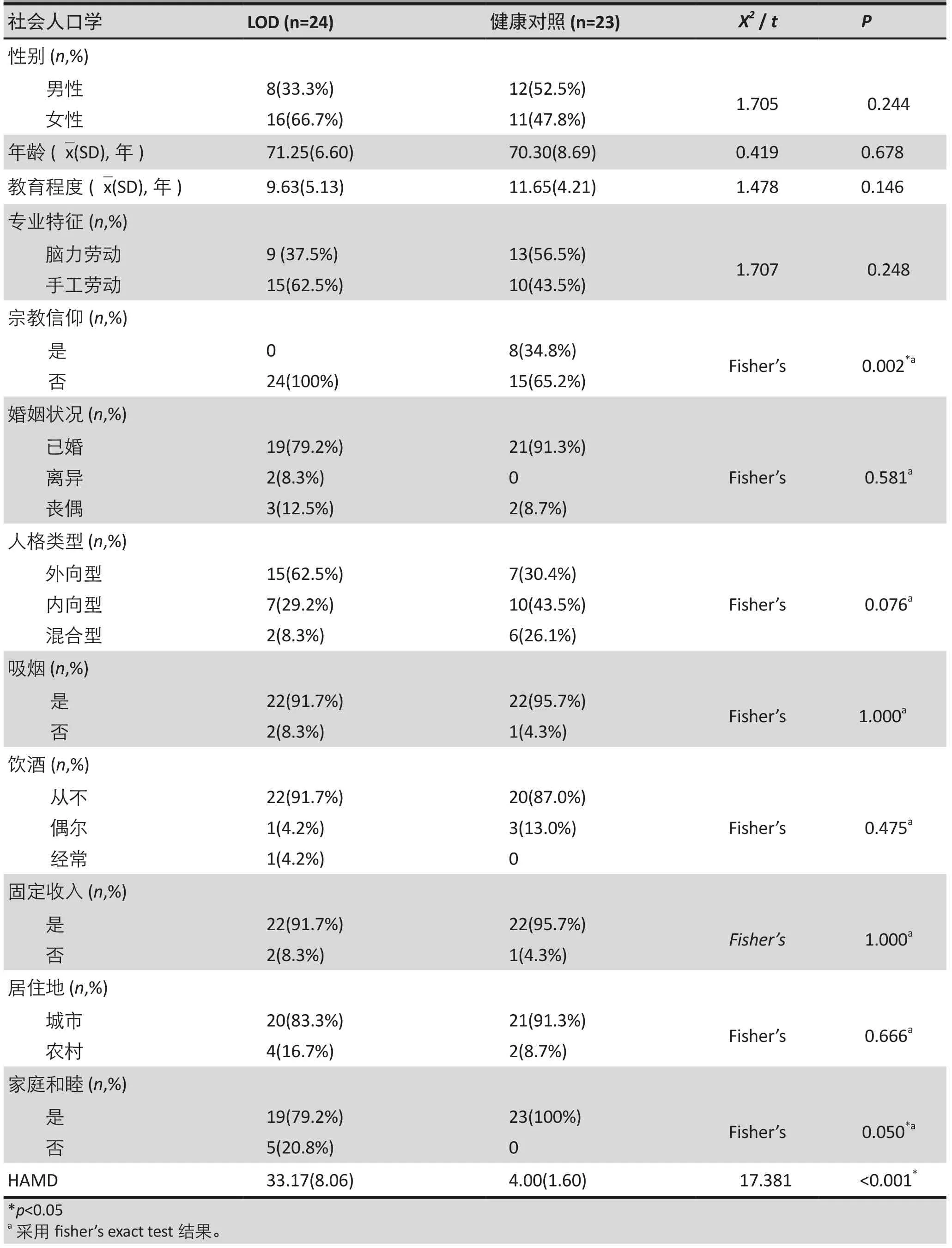
表1.两组间的人口学及社会学资料

表2.两评分比较组间脑白质高信号及颞叶萎缩视觉

图2.一例健康老人,71岁,女,高血压,Fazekas量表评分:脑室周围帽状薄层病变(PWMH=1);深部白质点状病变(DWMH=1)

图3.一例晚发型老年抑郁症,70岁,女,高血压,Fazekas量表评分: 不规则的脑室旁高信号,延伸到深部白质(PWMH=3);皮质下白质点状病变开始融合(DWMH=2)

表3.PWMH评分及WMH 评级与发病年龄的相关性分析

表4.可能与抑郁症状相关的因素
相比较本研究验证脑器质性因素,即脑白质高信号对LOD的影响,本研究发现的社会心理因素更值得我们关注,即宗教信仰和家庭和睦是LOD的保护性因素。有研究指出,宗教信仰有助于预防抑郁的复发,其效果甚至可媲美某些抗抑郁药。这可能与宗教信仰能够增加大脑默认模式网络(DMN)的功能连接相关[19]。本课题组对这批患者的后续脑功能磁共振的数据(如静息态、DTI等)分析或许能揭示有宗教信仰者在DMN及其他功能连接上的特征[19]。此外,家庭和睦也被证实是抑郁的保护性因素。这反映了老年抑郁症的生活事件特点,老年人生活和社交范围缩窄,家庭成为老年人生活的重心,家庭问题往往会对老年人产生重要影响,成为老年抑郁症发病的重要影响因素之一。有研究指出[20,21],良好的身体状况及家庭的支持将有助于提升LOD患者的幸福感,并有助于减少抗抑郁药的使用量及抑郁症状的复发。因此,与我们的研究结论相一致。
4.2 研究局限
本研究考虑的影响因素较少,无法对晚发型老年抑郁症影响因素进行总体分析。由于受收集样本时间和空间的限制,老年首发抑郁症患者的入组来源较少,导致本研究样本量相对较小,特别是深部白质高信号(DWMH)在老年抑郁症和健康对照之间的差异分析,且研究组仅为住院患者,因此在今后的研究中进一步扩大样本量,规范入排标准,全面考虑可能的影响因素,做进一步的研究和探索。
4.3 研究意义
本研究发现脑白质损伤与晚发型老年抑郁症状相关,但脑白质损伤是LOD的风险因素还是LOD的发病机制之一尚不清楚,还需要做进一步的研究和探讨。而宗教信仰和家庭支持则可能是抑郁的保护性因素,因此在老年社会工作中,发挥宗教在老年抑郁的积极作用,同时提高家庭支持水平,维持和睦家庭关系对促进老年人的心理卫生,预防老年抑郁至关重要。
参考文献
1.Hybels CF, Blazer DG.Epidemiology of late-life mental disorders.Clin Geriatr Med.2003; 19(4): 663-696
2.Yu J, Li J, Cuijpers P, Wu S, Wu Z.Prevalence and correlates of depressive symptoms in Chinese older adults: a population based study.Int J Geriatr Psychiatry.2012; 27(3): 305–312.doi: http://dx.doi.org/10.1002/gps.2721
3.Sheline YI, Barch DM, Garcia K, Gersing K, Pieper C, Welsh-Bohmer K, et al.Cognitive function in late life depression:relationships to depression severity, cerebro vascular risk factors and processing speed.Biol Psychiatry.2006; 60(1): 58-65.doi: http://dx.doi.org/10.1016/j.biopsych.2005.09.019
4.Sierksma AS1, van den Hove DL, Steinbusch HW, Prickaerts J.Major depression, cognitive dysfuncti on and Alzheimer’s disease: is there a link? Eur J Pharmacol.2010; 626(1): 72-82.doi: http://dx.doi.org/10.1016/j.ejphar.2009.10.021
5.Hou Z, Sui Y, Song X, Yuan Y.Disrupted Inter hemispheric Synchrony in Default Mode Network Underlying the Impairment of Cognitive Flexibility in Late-Onset Depression.Front Aging Neurosci.2016; 8: 230.doi: http://dx.doi.org/10.3389/fnagi.2016.00230
6.Krishnan KR.Organic bases of depression in the elderly.Annu Rev Med.1991; 42(42): 261.doi: http://dx.doi.org/10.1146/annurev.me.42.020191.001401
7.Leaper SA, Murray AD, Lemmon HA, Staff RT, Deary IJ,Crawford JR, et al.Neuropsychologic correlates of brain white matter lesions depicted on MR images: 1921 Aberdeen Birth Cohort.Radiology.2001; 221(1): 51-55.doi:http://dx.doi.org/10.1148/radiol.2211010086
8.Salloway S, Malloy P, Kohn R, Gillard E, Du ff y J, Rogg J, et al.MRI and neuropsy chological differences in early- and latelife-onset geriatric depression.Neurology.1996; 46(6): 1567-1574
9.Fazekas F, Chawluk JB, Alavi A, Hurtig HI, Zimmerman RA.MR signal abnormalities at 1.5 T in Alzheimer’s dementia and normal aging.AJR Am J Roentgenol.1987; 149(2): 351-356.
10.Scheltens P, van de Pol L.Impact commentaries.Atrophy of medial temporal lobes on MRI in “probable”Alzheimer’s disease and normal ageing: diagnostic value and neuro psychological correlates.J Neurol Neurosurg Psychiatry.2012; 83(11): 1038-1040.doi: http://dx.doi.org/10.1136/jnnp-2012-302562
11.Hamilton M.A rating scale for depression.J Neurol Neurosurg & Psychiatry.1960; 23(1): 56
12.Aizenstein HJ, Andreescu C, Edelman KL, Cochran JL,Price J, Butters MA, et al.fMRI correlates of white matter hyperintensities in late-life depression.Am J Psychiatry.2011; 168(168): 1075-1082.doi: http://dx.doi.org/10.1176/appi.ajp.2011.10060853
13.Awad IA, Spetzler RF, Hodak JA, Awad CA, Carey R.Incidental subcortical lesions identified on magnetic resonance imaging in the elderly.I.Correlation with age and cerebrovascular risk factors.Stroke.1986; 17(6): 1084
14.Colloby SJ, Firbank MJ, Thomas AJ, Vasudev A, Parry SW,O’Brien JT.White matter changes in late-life depression:a diffusion tensor imaging study.J Affect Disord.2011;135(1–3): 216-220.doi: http://dx.doi.org/10.1016/j.jad.2011.07.025
15.Maillard P, Carmichael O, Fletcher E, Reed B, Mungas D,DeCarli C.Coevoluti on of white matter hyperintensities and cognition in the elderly.Neurology.2012; 79(5): 442-448.doi: http://dx.doi.org/10.1212/WNL.0b013e3182617136
16.FRISONI G B, GALLUZZI S, PANTONI L, et al.The effect of white matter lesions on cognition in the elderly--small but detectable.Nat Clin Pract Neurol.2007; 3(11): 620.doi:http://dx.doi.org/10.1038/ncpneuro0638
17.Dotson VM, Zonderman AB, Kraut MA, Resnick SM.Temporal relationships between depressive symptoms and white matter hy perintensities in older men and women.Int J Geriatr Psychiatry.2013; 28(1): 66–74.doi: http://dx.doi.org/10.1002/gps.3791
18.Taylor WD, Aizenstein HJ, Alexopoulos GS.The vascular depression hypothesis: mechanisms linking vascular disease with depression.Mol Psychiatry.2013; 18(9): 963.doi:http://dx.doi.org/10.1038/mp.2013.20
19.Tartaglia MC, Rosen HJ, Miller BL.Neuroimaging in Dementia.Springer; 2011
20.Svob C, Wang Z, Weissman MM, Wickramaratne P, Posner J.Religious and spiritual importance moderate relation between default mode network connectivity and familial risk for depression.Neurosci Lett.2016; 634: 94-97.doi: http://dx.doi.org/10.1016/j.neulet.2016.10.009
21.Sun F, Gao X, Gao S, Li Q, Hodge DR.Depressive Symptoms Among Older Chinese Americans: Examining the Role of Acculturation and Family Dynamics.J Gerontol B Psychol Sci Soc Sci.2016; pii: gbw038.doi: http://dx.doi.org/10.1093/geronb/gbw038

