对精神分裂症患者血脂异常的瑞舒伐他汀辅助治疗的疗效与安全性的Meta分析
郑伟,杨威,张庆娥,杨欣湖,蔡东滨,胡晋卿,Gabor S.UNGVARI,Chee H.NG,Marc De HERT,宁玉萍*,项玉涛
1.背景
代谢综合征是心血管疾病(CVD)的一项独立风险因素[1,2],常导致精神分裂症患者昂贵的治疗费用、残疾风险[3]以及过早死亡[4]。最近的一项Meta分析表明精神疾病患者的代谢综合征患病率为32.6%。其中精神分裂症最高(33.4%),其次是双相障碍(31.7%)和重症抑郁(31.3%)[5]。在代谢综合征的特征中,血脂异常,特别是高密度脂蛋白胆固醇升高(LDL-C)是心血管疾病的重要病因[6-8]。因此降低LDL-C的治疗手段可能显著降低CVD的风险[9]。
对精神分裂症患者代谢综合征的药物和非药物治疗已经广泛开展。在药物治疗中,他汀类药物通过降低胆固醇合成从而能够最为有效的降低ASCVD(动脉粥样硬化性心血管疾病)的风险[7]。作为降血脂药物,他汀类药物主要通过LDL-C的亚组分起效[10]。一项队列研究发现他汀类药物能够改善精神分裂症患者的血脂异常[8]。其中瑞舒伐他汀在治疗血脂异常中的效应量较大[11]。虽然某些结果存在矛盾,但多项对照研究都发现瑞舒伐他汀对改善精神分裂症患者的血脂异常安全有效[6,12-14]。
据我们所知,目前对于采用瑞舒伐他汀辅助治疗精神分裂症患者的血脂异常尚无系统性综述或Meta分析的研究。因此我们将对照研究进行Meta分析,来阐明瑞舒伐他汀辅助治疗精神分裂症患者血脂异常的疗效和安全性。
2.方法
2.1 检索策略和筛选标准
根据系统综述和Meta分析优先报告项目(PRISMA)声明[15],由两名作者(WZ与 D-BC)从以下数据库独立地系统检索了2017 年9 月28 日以前相关的临床对照试验:英文数据库包括PubMed、PsycINFO、Cochrane 图书馆,中文数据库包括中国知网、万方数据库、中国生物医学文献数据库。检索关键词如下:(crestor OR rosuvasta tin) AND (schizophrenic disorder OR disorder, schizophrenic OR schizophrenic disorders OR schizophrenia OR dementi a praecox)。此外,与所包括的研究和综述相关的文献同时采用手工搜索,以避免遗漏。
依据PICOS缩 写(Population, intervention,comparator, outcomes and study design)标准,两名作者(WZ与D-BC)对研究的合格性进行独立评估。研究对象:确诊的成年精神分裂症患者。干预:瑞舒伐他汀联合抗精神病药。对照:抗精神病药联合安慰剂或单独使用抗精神病药。结果:主要测量结果为低密度脂蛋白胆固醇(LDL-C,mg/dL)。次要结果为总胆固醇(mg/dL)、高密度脂蛋白胆固醇(HDL-C, mg/dL)、甘油三酯(mg/dL)、空腹血糖(mg/dL)、体重(kg)、体重指数(BMI, kg/m2)、腰围(cm),采用阳性和阴性症状量表(PANSS)[16]或简明精神病评定量表(BRPS)[17]评估的精神症状改善情况,由于药物副作用(ADRs)或其他原因所致的停药。研究设计:采用具有Meta分析数据的研究分析辅助瑞舒伐他汀治疗高血脂或其他代谢综合征的疗效和安全性。此外,本Meta分析的标题与原计划稍有不同;即原标题为“瑞舒伐他汀对精神病患者血脂异常的治疗:一项Meta分析”,而现标题修订为“对精神分裂症患者血脂异常的瑞舒伐他汀辅助治疗的疗效与安全性的Meta 分析”。
2.2 数据提取
所纳入的研究数据由两名作者(X-HY与D-BC)独立审查和提取。当意向治疗(ITT)或修正ITT与观察的病例数据同时报道时,ITT或修正ITT数据采用以往meta分析的方法进行研究[18]。若需要相关研究的未发表数据,我们会联系通讯作者或第一作者索取。
2.3 统计方法
由于跨研究的潜在异质性,我们采用Review Manager软 件5.3版 本(http://tech.cochrane.org/revman/) 的随机效应模型进行Meta分析[19]。对于连续性结果,计算标准平均差(SMDs)与效应量估值(Hedges’ g)。对于二分式结果,计算风险比(RR)及其95% 的可信区间(CIs)。不同研究间的异质性通过I2与卡方检验统计,I-squared ≥ 50%或卡方值< 0.1则具有异质性[20]。此外,中国人和非中国人进行亚组分析。最后,潜在的发表偏倚采用漏斗图和Egger测试进行分析[21]。所有统计都是双尾,显著性设定未0.05。
2.4 报告偏倚评估
纳入研究的方法学质量通过Cochrane 风险评估,使用偏移评估工具中的Cochrane 风险评估[22]和JADAD量表[23]来评价所纳入研究的质量。并采用GRADE 系统推荐的等级方法(推荐、评估、发展、评价的等级)作为参照标准,证据水平采用“很低”、“低”、“中等”到“高”来评估Meta分析主要结果的总体质量[24,25]。
3.结果
3.1 检索结果
首次中英文数据库文献检索获取了13项记录(图1)。其中3项为重复。剩余10项中,6项通过标题和摘要的审查确定为不相关研究,0项通过全文审查剔除。最终4项确定为合格的研究[6,12-14],被纳入本Meta分析中。
3.2 所纳入研究的特征
在纳入的4项研究中(n=274,表1),3项为随机对照试验(RCTs)(n=174),另1项对比瑞舒伐他汀辅助治疗组(n=138)和对照组(n=136),但对照试验未随机化(n=100)。加权平均年龄为39.3岁(范围为34.1 - 43.5岁),男性加权平均百分比为65.7%(范围为56.5% - 78.0%),加权平均病程为12年(范围为5.8- 15.5年)。加权平均疗程为10.4周(范围为8-12周)(表1)。三项RCTs在中国开展(n=174),另一项在比利时进行(n=100)。瑞舒伐他汀剂量范围为5-10 mg/day。基线抗精神病药包括氯氮平(1项)、奥兰扎平或利培酮(1项)以及联合抗精神病药(2项)。比如De Hert等人的研究包括一代和二代抗精神病药(氯氮平,利培酮,氨磺必利,奥氮平,喹硫平)[6]。

图1.研究流程图
3.3 研究治疗和GRADE评估
一项研究未进行随机化[6];其余3项RCTs [12-14]中,2项为双盲试验,一项为开放性实验[12]。1项RCT[13]描述了随机化的具体方法(即随机数字表),然而所有RCTs中,选择性报道和其他资源偏倚评价都为包含不明风险(附图1)。在这3项RCTs中,加权平均JADAD分数为3.4(2-5,表1)。采用GRADE评估,主要和次要结果的证据质量为“很低”(35.3%)到“低”(64.7%)(附表1)。其中,主要结果(LDL-C)评估为“很低”。
3.4 疗效和安全性
3.4.1 主要结果
瑞舒伐他汀组对低密度脂蛋白胆固醇(LDL-C)的疗效优于对照组[ 4项试验,n=272,SMD:-1.31(95%CI:-1.93,-0.70),p<0.001;I2=81%,图 2]。去除一项没有随机试验的LDL-C 研究之后,显著差异仍然存在[6][ 3 项试验,n=172,SMD:-1.07(95%CI:-1.60,-0.53);p<0.001;I2=63% ]。 亚 组 分 析 发 现瑞舒伐他汀对非中国人群的阳性作用强于中国人群(p=0.01)。由于主要结果仅从4项实验中分析获得,因此可以采用漏斗图和Egger测试分析LDL-C的发表偏倚[26]。
3.4.2 次要结果
瑞舒伐他汀组对总胆固醇(2 项试验,n=164,SMD:-2.00(95%CI:-2.79,- 1.21);p<0.001;I2=76%)和甘油三酯(2项试验,n=164,SMD:-1.05(95%CI:-1.38,- 0.72);p<0.001;I2=0%)的疗效也优于对照组。但对高密度脂蛋白胆固醇(2 项试验,n=164,SMD:0.14(95%CI:-0.16,0.45);p=0.36;I2= 0%)的疗效没有显著差异(表2)。
体重(3 项试验,n=208,SMD:-0.40(95%CI:-1.29,0.49);p= 0.38;I2= 89%)、身体质量指数(2项试验,n=164,SMD:-0.34(95%CI:-1.23,0.56);p= 0.46;I2= 87%)、腰围(3 项试验,n=208,SMD:-0.43(95%CI:-1.31,0.46);p=0.34;I2= 89%)、 空腹血糖(4 项试验,n=272,SMD:-0.25(95%CI:-0.65,0.15);I2=62%)方面瑞舒伐他汀组与对照组间没有显著的差异(表2)。
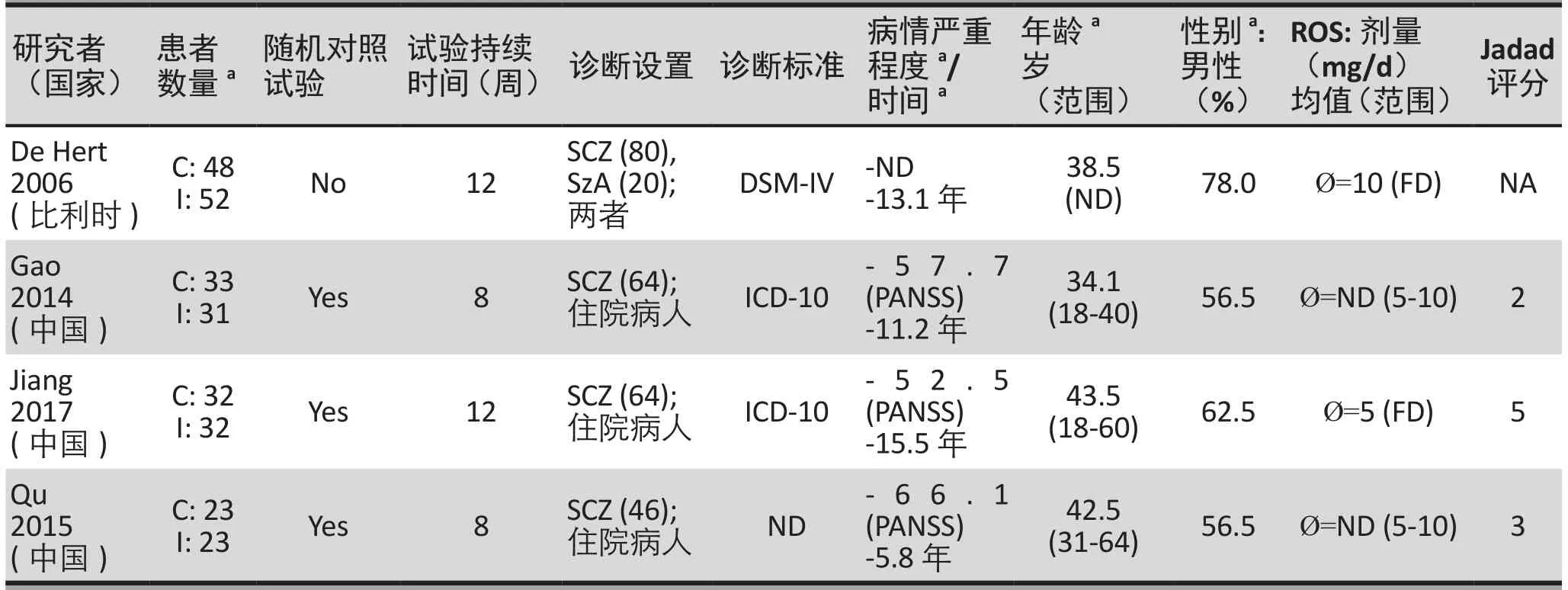
表1.纳入试验的研究和患者特征
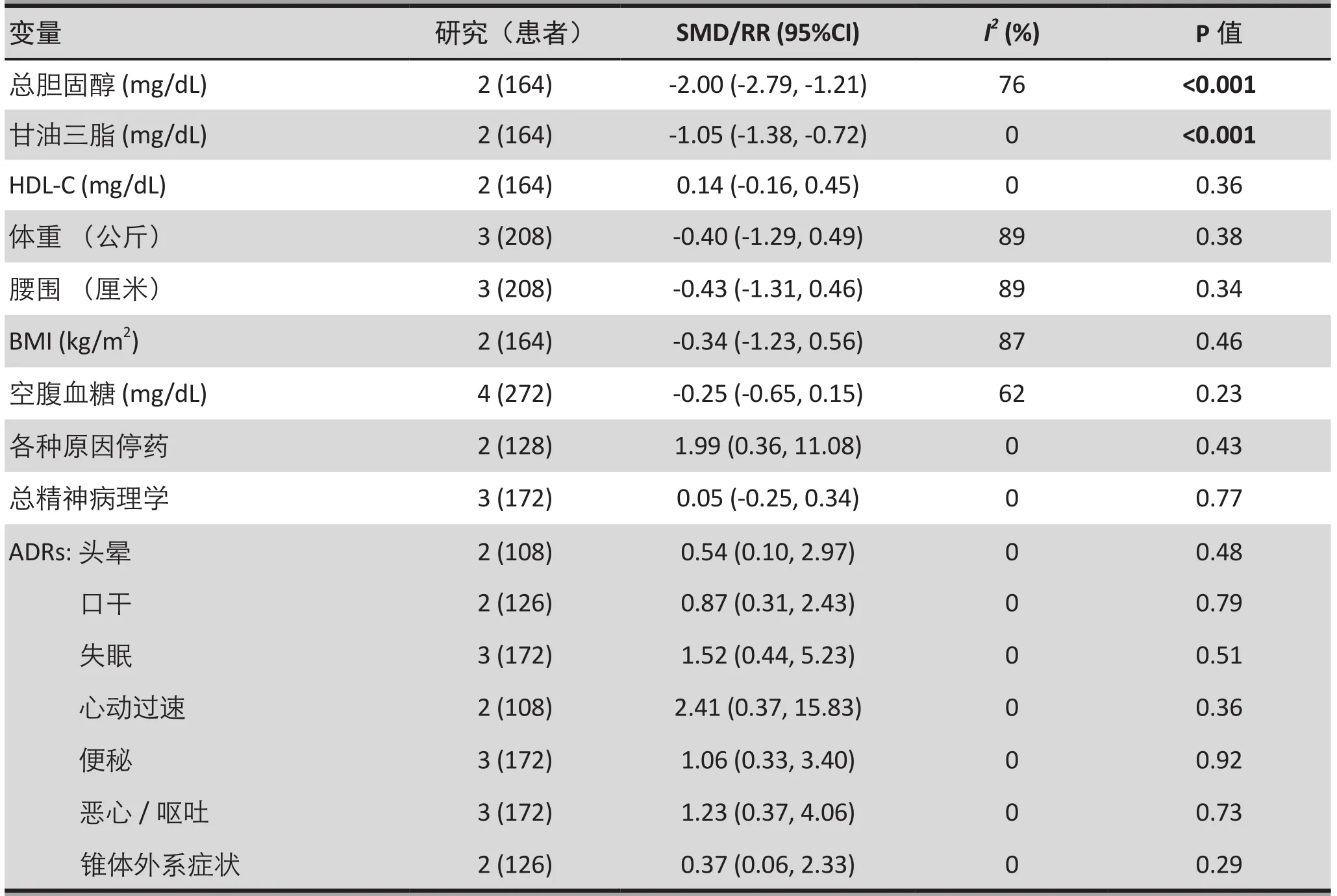
表2.次要结果
三项研究采用PANSS评估了精神症状改善情况,并未发现组间差异(3 项试验, n=172, SMD: 0.05 (95%CI:-0.25, 0.34), p=0.77; I2=0%, 表 2)。
ADRs的Meta分析包括头晕、口干、失眠、心动过速、便秘、恶心呕吐及锥体外系症状(表2),也未发现组间差异(p=0.29-0.92)。两组因为各种原因所致的停药率也相似(2项试验, n=128, RR: 1.99 (95%CI:0.36, 11.08), p=0.43; I2=0%)(表 2)。
4.讨论
4.1 主要发现
本文首次采用Meta分析来研究瑞舒伐他汀辅助治疗精神分裂症患者血脂异常的疗效和安全性。我们发现瑞舒伐他汀辅助治疗能够显著增加LDL-C,采用GRADE评估的证据质量为“很低”,采用抗精神病药治疗的精神分裂症患者的总胆固醇和甘油三酯水平也与以往研究一致[27,28]。
4.2 研究局限
本文存在以下局限。首先,主要结果存在一个异质性结果。第二,共包含4项试验(274名患者),从而限制了更多的综合分析(即Meta回归分析)。第三,瑞舒伐他汀对血脂异常的量效关系未进行评估,因此这些研究中瑞舒伐他汀的剂量差异很大(5-10 mg/day)。第四,明确的代谢综合征数据仅在一项试验中报道[6]。第五,本Meta分析并未完全聚焦在RCTs上,因此可能降低研究结果的有效性。第六,瑞舒伐他汀辅助治疗的长期效应(>2周)并未评估。因此本meta分析所纳入的研究质量相对较低(比如其中一项研究未进行随机试验),导致主要结果的证据质量评估仅为“低”。最后,其他他汀类药物对精神分裂症患者血脂异常的疗效和安全性有待进一步的研究。
4.3 研究意义
由于精神分裂症患者存在不健康的生活方式、不规律的饮食习惯和长期使用抗精神病药的现象,因此预防和治疗代谢综合征是临床上的重要挑战[1]。其他一些药物,如二甲双胍[29]和托吡酯[30,31],则能够增加体重和BMI影响健康,然而本研究发现瑞舒伐他汀却无这些效应。
Hanssens等人发现精神分裂症患者对他汀类药物治疗具有良好的耐受性,其中只有一例出现异常肝脏酶学改变和CK增高[8]。与此类似,本文Meta分析表明瑞舒伐他汀对精神分裂症患者同样相对安全且具有良好的耐受性。以往有研究发现瑞舒伐他汀可能增加肌肉毒性的风险,其程度从普通肌肉痛(不合并CK增加)到肾衰[32],以及肝脏毒性,程度可以从无症状的一过性增高到肝衰[33]。然而,在本文纳入的研究中对这些副作用并无报道,仅有一项研究中患者出现了肝酶学的异常[6]。
5.结论
对精神分裂症患者血脂异常的瑞舒伐他汀辅助性治疗的现有数据尚不足以对其有效性和安全性做出明确的解释。需进一步针对高质量的延长治疗时间的随机对照试验来验证该结论。
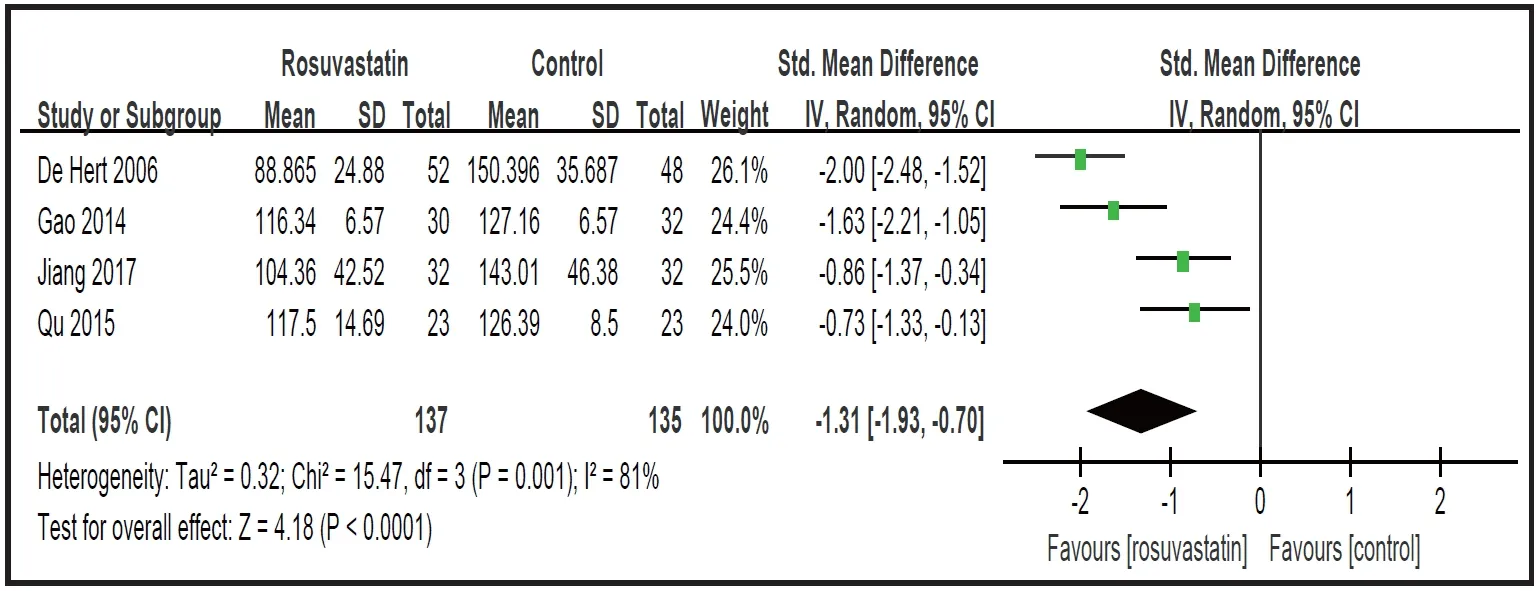
图2.精神分裂症患者血脂异常的瑞舒伐他汀辅助治疗:森林图为低密度脂蛋白胆固醇(mg/dl)
参考文献
1.De Hert M, Schreurs V, Vancampfort D, Van Winkel R.Metabolic syndrome in people with schizophrenia: a review.World Psychiatry.2009; 8: 15-22
2.Meyer JM, Stahl SM.The metabolic syndrome and schizophrenia.Acta Psychiatr Scand.2009; 119: 4-14.doi:http://dx.doi.org/10.1111/j.1600-0447.2008.01317.x
3.Baker AL, Richmond R, Kay-Lambkin FJ, Filia SL, Castle D,et al.Randomised controlled trial of a healthy lifestyle intervention among smokers with psychotic disorders:Outcomes to 36 months.Aust N Z J Psychiatry.2017; doi:http://dx.doi.org/10.1177/0004867417714336
4.Correll CU, Solmi M, Veronese N, Bortola to B, Rosson S, et al.Prevalence, incidence and mortality from cardiovascular disease in patients with pooled and specific severe mental illness: a large-scale meta-analysis of 3,211,768 patients and 113,383,368 controls.World Psychiatry.2017; 16: 163-180.doi: http://dx.doi.org/10.1002/wps.20420
5.Vancampfort D, Stub bs B, Mitchell AJ, De Hert M, Wampers M, et al.Risk of metabolic syndrome and its components in people with schizophrenia and related psycho tic disorders,bipolar disorder and major depressive disorder: a systematic review and meta-analysis.World Psychiatry.2015; 14: 339-347.doi: http://dx.doi.org/10.1002/wps.20252
6.De Hert M, Kalnicka D, van Winkel R, Wampers M, Hanssens L, et al.Treatment with rosuvasta tin for severe dyslipidemia in patients with schizophrenia and schizo affective disorder.J Clin Psychiatry.2006; 67: 1889-1896
7.Chang Y, Robidoux J.Dyslipidemia management update.Curr Opin Pharmacol.2017; 33: 47-55.doi: http://dx.doi.org/10.1016/j.coph.2017.04.005
8.Hanssens L, De Hert M, Kalnicka D, van Winkel R, Wampers M, et al.Pharmacological treatment of severe dyslipidaemia in patients with schizophrenia.Int Clin Psychopharmacol.2007; 22: 43-49.doi.http://dx.doi.org/10.1097/YIC.0b013e3280113d3b
9.Shinozaki T, Matsuyama Y, Iimuro S, Umegaki H, Sakurai T,et al.Effective prevention of cardiovascular disease and diabetes-related events with atorvastatin in Japanese elderly patients with type 2 diabetes mellitus: adjusting for treatment changes using a marginal structural proportional hazards model and a rank-preserving structural failure ti me model.Geriatr Gerontol Int.2012; 12 (Suppl 1): 88-102.doi:http://dx.doi.org/10.1111/j.1447-0594.2011.00816.x
10.Ference BA, Kastelein JJP, Ginsberg HN, Chapman MJ,Nicholls SJ, et al.Association of Genetic Variants Related to CETP Inhibitors and Statins With Lipoprotein Levels and Cardiovascular Risk.JAMA.2017; 318: 947-956.doi.http://dx.doi.org/10.1001/jama.2017.11467
11.Jones PH, Davidson MH, Stein EA, Bays HE, McKenney JM,et al.Comparison of the efficacy and safety of rosuvasta tin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial).Am J Cardiol.2003; 92: 152-160
12.Gao SH, Ma LH, Zhang YX, Ma JG, Ji SR, et al.[The effect of rosuvastatin on hyper-LDL cholesterolemia in patients with schizophrenia].Jing Shen Yi Xue.2014; 27(4): 245-247.Chinese.doi.http://dx.chinadoi.cn/10.3969/j.issn.1009-7201.2014.04.002
13.Jiang YW, Jiang HT, Ma LH, Zhang YX, Han JG, et al.[Effi cacy of behavioral intervention adjunctive to rosuvastatin for antipsychotic-induced metabolic syndrome].Zhong Hua Jing Shen Ke Za Zhi.2017; 50: 295-301.Chinese.doi.http://dx.chinadoi.cn/10.3760/cma.j.issn.1006-7884.2017.04.012
14.Qu S, Wang F, Tang YB, Chen L J, Zong HY.[The effect of adjunctive rosuvastatin on hyper-LDL cholesterolemia in schizophrenia].Yi Yao Dao Bao.2015; 10: 1296-1298.Chinese.doi: http://dx.chinadoi.cn/10.3870/j.issn.1004-0781.2015.10.008
15.Moher D, Liberati A, Tetzlaff J, Altman DG.Preferred reporting items for systematic reviews and meta-analyses:the PRISMA statement.Ann Intern Med.2009; 151: 264-269,w264
16.Kay SR, Fiszbein A, Opler LA.The positive and negative syndrome scale (PANSS) for schizophrenia.Schizophr Bull.1987; 13: 261-276
17.Overall JE, Gorham DR.The Brief Psychiatric Rating-Scale.Psychological Reports.1962; 10: 799-812
18.Galling B, Roldán A, Hagi K, Rietschel L, Walyzada F, Zheng W, et al.Antipsychotic augmentation vs.monotherapy in schizophrenia: systematic review, meta-analysis and metaregression analysis.World Psychiatry.2017; 16(1): 77-89.doi: http://dx.doi.org/10.1002/wps.20387
19.DerSimonian R, Laird N.Meta-analysis in clinical trials.Control Clin Trials.1986; 7(3): 177-188
20.Higgins JP, Thompson SG.Quantifying heterogeneity in a meta-analysis.Stat Med.2002; 21: 1539-1558
21.Egger M, Davey Smith G, Schneider M, Minder C.Bias in meta-analysis detected by a simple, graphical test.BMJ.1997; 315(7109): 629-634
22.Higgins J, Higgins J.Cochrane Handbook for Systematic Reviews of Interventions.John Wiley & Sons; 2008
23.Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ,Gavaghan DJ, et al.Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials.1996; 17: 1-12.doi: https://doi.org/10.1016/0197-2456(95)00134-4
24.Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, et al.GRADE guidelines: 3.Ra ting the quality of evidence.J Clin Epidemiol.2011; 64(4): 401-406.doi: http://dx.doi.org/10.1016/j.jclinepi.2010.07.015
25.Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, et al.Grading quality of evidence and strength of recommendations.BMJ.2004; 328(7454): 1490.doi: http://dx.doi.org/10.1136/bmj.328.7454.1490
26.Sterne JA, Sutton AJ, Ioannidis JP, Terrin N, Jones DR, Lau J, et al.Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomised controlled trials.BMJ.2011; 343: d4002.doi: http://dx.doi.org/10.1136/bmj.d4002
27.Stein EA, Dann EJ, Wiegman A, Skovby F, Gaudet D,Sokal E, et al.Efficacy of rosuvastatin in children with homozygous familial hy percholesterolemia and association with underlying genetic mutations.J Am Coll Cardiol.2017; 70(9): 1162-1170.doi: http://dx.doi.org/10.1016/j.jacc.2017.06.058
28.Osser DN, Najarian DM, Dufresne RL.Olanzapine increases weight and serum triglyceride levels.J Clin Psychiatry.1999;60: 767-770
29.Zheng W, Li XB, Tang YL, Xiang YQ, Wang CY, de Leon J.Metformin for weight gain and metabolic abnormalities associated with antipsychotic treatment: metaanalysis of randomized placebo-controlled trials.J Clin Psychopharmacol.2015; 35(5): 499-509.doi: http://dx.doi.org/10.1097/JCP.0000000000000392
30.Zheng W, Xiang YT, Xiang YQ, Li XB, Ungvari GS, Chiu HF,et al.Efficacy and safety of adjunctive topiramate for schizophrenia: a meta-analysis of randomized controlled trials.Acta Psychiatr Scand.2016; 134(5): 385-398.doi.http://dx.doi.org/10.1111/acps.12631
31.Correll CU, Maayan L, Kane J, Hert MD, Cohen D.Efficacy for psychopathology and body weight and safety of topiramateantipsychotic cotreatment in patients with schizophrenia spectrum disorders: results from a meta-analysis of randomizd controlled trials.J Clin Psychiatry.2016; 77: e746-756.doi: http://dx.doi.org/10.4088/JCP.15r10373
32.Liu JE, Liu XY, Chen S, Zhang Y, Cai LY, Yang M, et al.SLCO1B1 521T > C polymorphism associated with rosuvastatininduced myotoxicity in Chinese coronary artery disease patients: a nested case-control study.Eur J Clin Pharmacol.2017; 73(11): 1409-1416.doi: http://dx.doi.org/10.1007/s00228-017-2318-z
33.Hwang NK, Park JS, Cha KS, Kang JS.Hepatotoxicity associated with a short course of rosuvastatin.Chin Med J.2015; 128: 1693-1694.doi: http://dx.doi.org/10.4103/0366-6999.158382

