MCM-41分子筛的氨三乙酸功能化及对重金属离子吸附特性研究
陈西子 ,陈艳蕾 ,巫秋萍 ,陈霏云 ,庄赞勇 ,于 岩
(1.福州大学 材料科学与工程学院,福建 福州 350108; 2.生态环境材料先进技术福建省高校重点实验室,福建 福州 350108)
0 引 言
重金属离子具有持久性、生物难降解、有毒等特点[1-2],水体中重金属离子超标会对人体和社会造成重大潜在威胁,因此寻找高效材料处理含有有毒废水是众多学者关注的焦点。
目前已经发展了多种重金属离子处理技术,包括化学沉淀、离子交换、萃取、吸附、膜分离和电化学技术等[3-5]。吸附法在设计上灵活简便,易于操作, 并能有效的去除低浓度的重金属离子。因此吸附法在水污染控制方面具有更广泛的应用。固相萃取(SPE)或吸附由于最低限度产生废物,生态友好、快速、预富集高,且吸收剂稳定、可重复利用、不使用有机溶剂等,使得比其他方法更环保[6-7]。吸附材料如活性炭、沸石、黏土和有机聚合物,都具有捕获重金属离子的能力[8]。其中,介孔分子筛由于具有较大的比表面积、较大的孔径和孔容,较高的吸附容量,受到了广泛关注,其中最为突出的是MCM-41[9]。但由于分子筛表面缺乏活性基团,在实际应用中受到限制。为此,人们采取多种方法对其进行表面修饰,将功能基团嫁接至MCM-41表面,极大地扩大了MCM-41的应用范围。Feng[10-11]等人第一次报道了有机官能化介孔二氧化硅的制备,即用巯丙基对MCM-41进行改性,结果发现对Hg2+和其他重金属离子有高效的去除效果。R.Kumar[12]等人利用3-氨丙基三乙氧基硅烷(APTES)在MCM-41表面接枝乙二胺四乙酸(EDTA),吸附研究表明EDTA-MCM-41对水溶液中的Cu2+、Zn2+、Ni2+最大吸附量分别达到79.36 mg/g、74.07 mg/g,67.56 mg/g。Lam等[13]研究了由有机胺(包括RNH2,R2NH和R3N;R=丙基)修饰的MCM-41对Au的选择吸附性能。他们发现,经过有机胺官能团改性后的MCM-41在含有两种重金属 (Au和Cu或Ni)的溶液中易于选择吸附Au离子,吸附选择性高达100 %。
氨三乙酸含有三羧基基团,能为金属离子提供4个配位键且分子量小,对重金属具有非常强的络合能力。因而它能与各种金属离子形成稳定的螯合物。氨三乙酸上的羧基一般不与分子筛分子上的羟基直接反应,而是通过形成氨三乙酸酐,在活化剂的作用下,与分子筛分子上的羟基发生酯化反应[14]。氨三乙酸酐作为改性剂应用于重金属吸附的研究鲜有报道。本文用氨三乙酸金属螯合能力强的特性,以介孔分子筛MCM-41为基体,通过化学改性的手段制备功能化的MCM-41,并研究该功能材料作为吸附剂对水中重金属离子铅、铜的吸附性能,考查影响吸附效率的因素,为高效处理水中的重金属离子提供有益的借鉴和理论依据。
1 实验部分
1.1 吸附剂制备
1.1.1 MCM-41的合成
MCM-41的合成步骤[15]:首先,将2.5 g的溴化十六烷基三甲基溴化铵(AR)溶于50 g的去离子水中,再加入13.2 g的氢氧化铵溶液和60 g乙醇溶液,在室温下磁力搅拌约30 min。向溶液中逐滴加入4.7 g的正硅酸乙酯,大力搅拌约2 h,得澄清的乳白色溶液,整个溶液反应物的摩尔比为1TEOS :0.3CTAB : 11NH3: 144H2O : 58EtOH。将溶液移到聚四氟乙烯反应釜中,100 ℃下水热晶化24 h。抽滤、水洗至中性,烘干,得到MCM-41介孔分子筛;然后将MCM-41在550 ℃焙烧6 h,脱除模板剂,得到焙烧后的MCM-41介孔分子筛,记为MCM-41。
1.1.2 MCM-41表面功能化
称取8 g 氨三乙酸于150 mL锥形瓶中,加入12 mL吡啶和12 mL N,N-二甲基甲酰胺,混匀,滴入12 mL 醋酸酐,于65 ℃下隔绝空气搅拌24 h,得到含氨三乙酸酐(NTAA)的混合有机溶液。然后加入干燥后的2 g MCM-41和12 mL N,N-二甲基甲酰胺,于75 ℃ 下隔绝空气搅拌24 h。将所得材料过滤,依次用醋酸酐、N,N-二甲基甲酰胺、饱和碳酸氢钠溶液、超纯水、乙醇(95%)和丙酮清洗,在65 ℃下烘干12 h,即得到改性分子筛吸附剂NTAA-MCM-41,反应机理如图1所示。
1.2 吸附剂表征
样品XRD分析采用Philips PW1710型X射线衍射仪上进行测定,Cu靶,Kα辐射源,管电压40 KV,管电流30 mA,扫描步长0.02°,扫描速度1.2/min,扫描范围2θ=1.0-10°。实验样品的TEM采用H-8100透射电子显微镜进行表征,电子加速电压为200 kV。材料的红外光谱分析采用溴化钾压片法,扫描波长范围为4000-400 cm-1,在Spectrum One 型傅立叶红外光谱仪上测定样品骨架振动和负载有机官能团的红外光谱。
1.3 吸附实验
称取2份50 mg NTAA-MCM-41样品,分别放入盛有50 mL 100 mg/L的Pb+2和100 mg/L Cu+2水溶液中,磁力搅拌,在不同时时间取样,离心分离,然后用原子吸收光谱仪测定不同时间、不同pH下样品中的离子浓度,根据溶液起始浓度与最终浓度的差值,确定吸附剂的吸附能力。吸附剂的吸附效

式中,R为重金属离子的去除率,也即吸附剂的吸附率,%;C0和Ct分别是起始以及终了时溶液中离子浓度,mg/L。
2 结果与讨论
2.1 NATT-MCM-41的合成及吸附机理
NATT-MCM-41的合成路径及对金属离子的吸附机理如图1所示。氨三乙酸和醋酸酐在吡啶的催化作用下,反应生成氨三乙酸酐,然后加入N,N-二甲基甲酰胺,打开氨三乙酸酐的环状结构,氨三乙酸上的羧基即与MCM-41分子上的羟基发生酯化反应,形成稳定的化学键[16]。采用饱和碳酸氢钠溶液将羧基转化为羧酸盐,有利于其与金属离子的络合反应。元素分析得到NATT-MCM-41的氮元素含量为3.02 mmol/g,充分说明了氨三乙酸酐成功嫁接到MCM-41上。
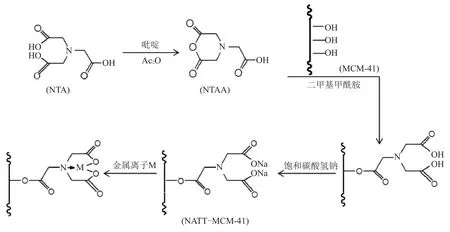
图1 NTAA-MCM-41的合成和反应机理Fig.1 Synthesis of NTAA-MCM-41 and the reaction mechanism
2.2 样品表征
图2是MCM-41和NATT-MCM-41的XRD图。从图中可以看出,合成的MCM-41在2 θ为1.80°有较强的衍射峰,并且在3.38°和3.96°也有较强的衍射峰,分别对应于(100),(110)和(200)晶面,这与文献报道[17]的具有六方对称(p6mm)特征的典型介孔材料MCM-41的特征衍射峰相符,表明合成的MCM-41具有长程有序的六方形介孔结构并且结晶度好。NATT-MCM-41的XRD图谱中(100)峰的强度明显减弱,而且衍射峰的位置有向高角度迁移的趋势。这意味着嫁接官能团后的MCM-41孔道结构没有塌陷,但长程有序度降低。羧基的引入,对MCM-41的孔道具有一定的破坏作用,引起晶格缺陷的增多,导致衍射峰强度减弱。

图2 MCM-41和NATT-MCM-41样品的XRD曲线Fig.2 XRD patterns of MCM-41 and NATT-MCM-41 samples
图3是典型的MCM-41材料的TEM图,它具有二维六方孔道结构,并且从图中可以看出该材料的孔道分布均匀,保持了很好的晶体结构特性。从图中可以MCM-41经过改性后,依然保持规则的六角结构。这说明了改性后材料依然保持介孔结构,具有一定的稳定性。

图3 MCM-41和NATT-MCM-41的透射图Fig.3 TEM images of MCM-41 (a) and NATT-MCM-41 (b)
由图4可以看出,MCM-41在1100 cm−1、1000 cm−1、860 cm−1附近的吸收峰属于Si-O和Si-O-Si的伸缩振动,这些是完全无定型SiO2的典型特征振动吸收带[18],说明样品在经过540 ℃焙烧后,样品的结构未被破坏,骨架缺陷很少。在3447 cm−1附近的强峰对应表面羟基和吸附水分子的不对称伸缩振动;1650 cm−1的吸收峰对应于吸附水分子的弯曲振动。样品NTAA-MCM-41在3447 cm−1附近的吸收峰强度有所下降,推测是由羟基的伸缩振动和N-H的伸缩振动共同引起的。1650 cm−1附近的吸收峰强度变弱,说明介孔分子筛表面吸水能力减弱。此外,在2930 cm-1附近的吸收峰对应C-H键的伸缩振动;1734 cm-1附近的吸收带归属于酯基和羧基的弯曲振动。以上FT-IR谱图解析说明,MCM-41成功的从氨三乙酸酐中引入了酯基和氨基[14]。
MCM-41和NTAA-MCM-41的结构性质如表1所示。从表1可以看出,氨三乙酸酐改性的MCM-41分子筛吸附剂的比表面积有所下降,从原来的916 m2/g下降至437 m2/g,孔容和孔径也下降明显。这些参数的变化可以归因于MCM-41的部分介孔入口被引入的基团所堵塞,导致表面积,孔容和孔径均下降。
2.3 NATT-MCM-41的吸附性能

图4 MCM-41和NTAA-MCM-41的红外图谱Fig.4 FTIR spectra of MCM-41 and NTAA-MCM-41
2.3.1 吸附时间的影响
溶液的初始浓度为100 mg/L,在50 mL的样品溶液中添加50 mg NATT-MCM-41,在溶液的自然pH下,室温条件下分别振荡不同的时间(5-120 min),分别测定吸附后溶液中的Pb2+和Cu2+浓度,结果如图5所示。从图中可以看出,在10 min以前吸附量在短时间内迅速增大,这主要是因为Pb2+或Cu2+能够快速与NATT-MCM-41表面的官能团发生螯合反应,形成稳定的化学键。随着反应时间的延长,溶液中的离子浓度降低,部分离子通过扩散作用进入NATT-MCM-41孔隙内部,阻力逐渐增加,吸附速率变慢;吸附40 min之后吸附已基本饱和,说明NATT-MCM-41的吸附位点有限。当溶液初始浓度为150 mg/L时,NATT-MCM-41对Pb2+和Cu2+的吸附量在吸附40 min之后分别为123.5 mg/g、103.4 mg/g。为确保其他条件为变量时吸附时间的影响可以忽略即充分吸附,实验选择吸附时间均为40 min。
2.3.2 溶液pH值的影响

图5 吸附时间对NATT-MCM-41吸附Pb2+和Cu2+的影响Fig.5 Effect of time on the adsorption of Pb2+ and Cu2+ by NATT-MCM-41

表1 MCM-41和NTAA-MCM-41的结构性质Tab.1 Structural properties of MCM-41 and NTAA-MCM-41
pH值会影响官能团的活性(氨基、羧基),进而影响吸附。起始溶液Pb2+和Cu2+浓度为100 mg/L,吸附剂投量为1 g/L,用稀盐酸或稀NaOH调节溶液的pH值分别为1、2、3、4、5、6、7,在常温下吸附40 min后,测定不同pH值下NATT-MCM-41的吸附效率,结果如图6所示。由图可见,pH值约为1时,NATT-MCM-41对Pb2+的吸附率大约是28%,pH值从1到3时,吸附剂的吸附率缓慢增大,pH值为4时,吸附率是85%左右,pH值到5以后,吸附剂的吸附效率可达95%。这是因为吸附剂的吸附率与Pb2+和H3O+与NATT-MCM-41上相结合的氨基功能团之间存在的竞争反应有关。在低的pH值下,溶液中存在较多的H3O+,易与NATT-MCM-41上的酯基结合,导致吸附剂对Pb2+的吸附率较低,不利于吸附;当pH值增大时,溶液中H3O+的浓度越来越低,与NATT-MCM-41上的酯基相结合的程度降低,导致官能团与Pb2+相结合的机会增大,也即吸附剂的吸附率增大吸附剂表面去质子化,Pb2+吸附量增大[16]。pH值从5.0 -1.0,Pb2+吸附量不断减少。pH值大于6时,Pb2+在溶液中以Pb(OH)2存在,属于沉淀而非吸附。对于Cu2+吸附亦是如此。在pH值为1时,NATT-MCM-41对Cu2+的吸附率大约是35 %,在pH为1-3范围,吸附率缓慢增加,在pH≥5后,吸附率可达90.4%。由图中可以看出,溶液的pH值保持在5左右即溶液的自然pH时,NATT-MCM-41对Pb2+和Cu2+的吸附效果最佳。

图6 pH值对NATT-MCM-41吸附Pb2+和Cu2+的影响Fig.6 Effect of pH on the adsorption of Pb2+ and Cu2+ by NATT-MCM-41
2.3.2 Pb2+和Cu2+的吸附量对比
表2列出的是NATT-MCM-41、MCM-41和文献中其他吸附剂对Pb2+和Cu2+的最大吸附量。从表中可以看出,实验中所制备的NATT-MCM-41对Pb2+和Cu2+的吸附量大于未改性的MCM-41以及其他吸附剂,揭示了实验合成的NATT-MCM-41吸附剂对Pb2+和Cu2+有良好的吸附能力。
2.4 解吸实验
吸附剂的良好解吸性能是必要的其潜在应用的重要因素。从pH值的影响研究中,我们发现,在pH=1时NATT-MCM-41对Pb2+和Cu2+的吸附效果较低。这一结果表明,吸附剂可以在pH值低的酸性溶液进行解吸。因此,在解吸过程中使用一定浓度的硝酸溶液。实验证明,98%已吸附的Pb2+和Cu2+均可以通过HNO3和NH3•H2O解吸剂进行解吸,见表3(cycle1)。可重复利用性是通过5个周期的吸附-解吸过程,并测定每个周期的吸附-解吸效率。在第5次循环中,NATT-MCM-41吸附Pb2+和Cu2+吸附容量分别表现出约10%和8%损失,在可接受范围。因此,再生实验研究表明NATT-MCM-41具有良好的再生性能,可重复使用。在实际的废水处理中NATT-MCM-41可以作为有效的吸附剂。
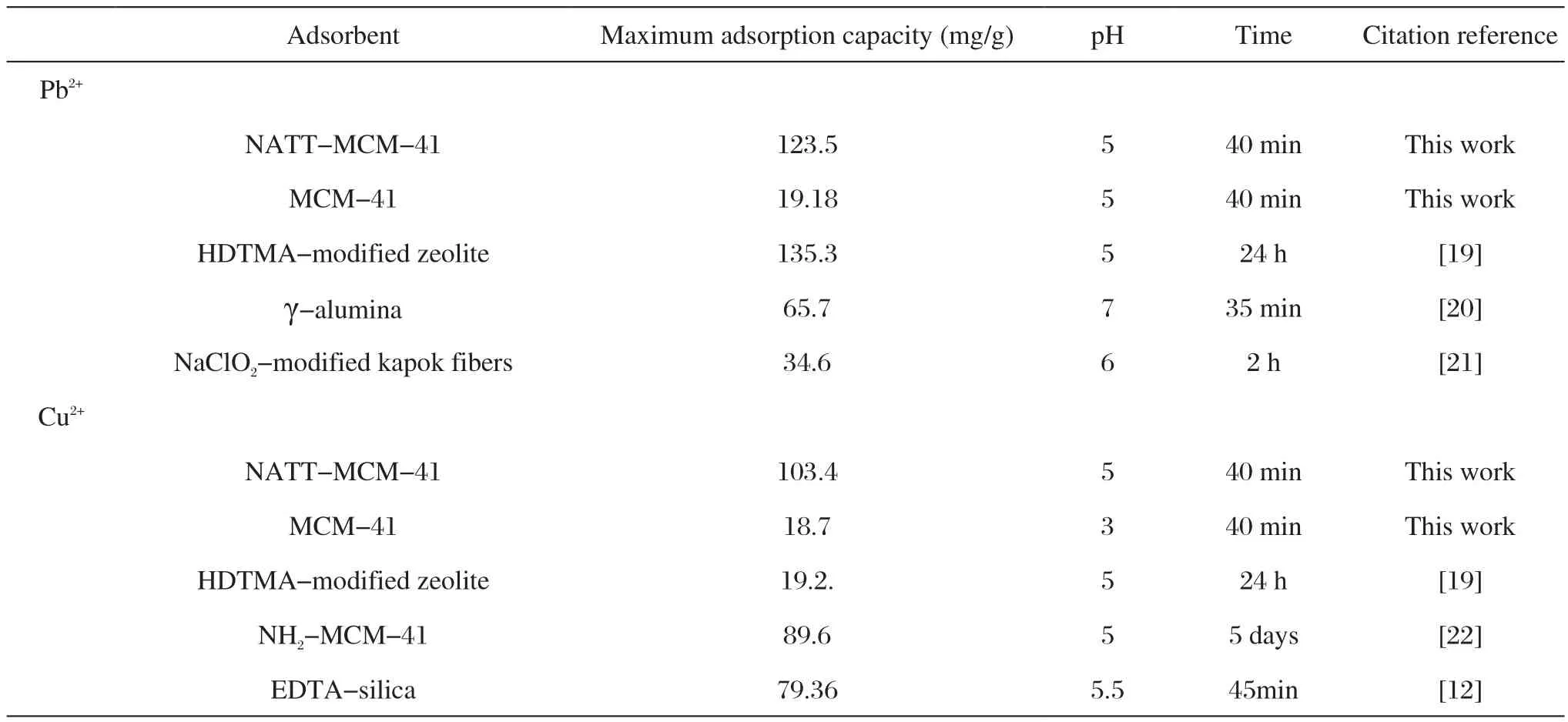
表2 NATT-MCM-41与文献中其他吸附剂对Pb2+和Cu2+的最大吸附量对比Tab.2 Comparison of the maximum adsorption capacities of NATT-MCM-41 (in this work) and other adsorbents documented in literature for Pb2+ and Cu2+
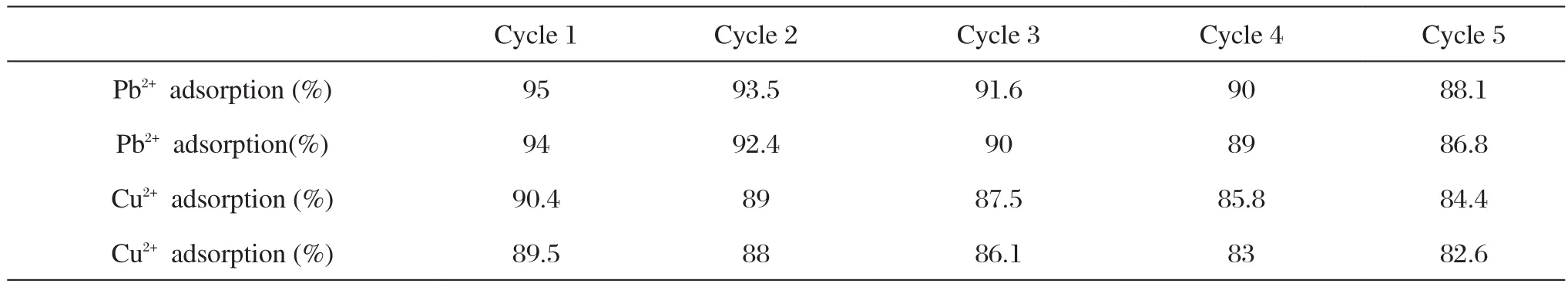
表3 NATT-MCM-41回收利用后的吸附和脱附效率Tab.3 Adsorption and desorption eきciencies of NATT-MCM-41 after recyclable utilization
3 结 论
本文制备并表征了氨三乙酸功能化MCM-41介孔分子筛即NATT-MCM-41,并对水中重金属Pb2+和Cu2+进行吸附研究,得到如下结论:
(1)NATT-MCM-41仍然保持介孔材料的特性,但材料的有序性有所降低;MCM-41分子上的羟基与氨三乙酸分子上的羧基发生酯化反应,形成稳定的化学键,保证了改性后吸附材料的性能稳定;
(2)NATT-MCM-41材料能够高效地吸附水中的重金属Pb2+和Cu2+,吸附量分别达到了123.5 mg/g、103.4 mg/g;
(3)溶液的pH值是影响吸附效率的重要因素,吸附率随pH值的增大而增大,pH值为5左右时,NATT-MCM-41对重金属Pb2+和Cu2+的吸附效果最好;
(4)NATT-MCM-41在循环使用5次后,吸附容量降低约10%,表明NATT-MCM-41稳定性好、可再生率高,适用于弱酸性废水中重金属离子的去除。
参考文献:
[1]GOMES E C C, SOUSA A F D, VASCONCELOS P H M, et al.Synthesis of bifunctional mesoporous silica spheres as potential adsorbent for ions in solution [J].Chemical Engineering Journal,2013, 214(4): 27-33.
[2]QIANG W, WEI G, YANG L, et al.Simultaneous adsorption of Cu (II) and SO42−ions by a novel silica gel functionalized with a ditopic zwitterionic Schiff base ligand [J].Chemical Engineering Journal, 2014, 250(6): 55-65.
[3]AWUAL M R, RAHMAN I M M, YAITA T, et al.PH dependent Cu (II) and Pd (II) ions detection and removal from aqueous media by an efficient mesoporous adsorbent [J].Chemical Engineering Journal, 2014, 236: 100-109.
[4]LOMBARDO M V, VIDELA M, CALVO A, et al.Aminopropyl-modified mesoporous silica SBA-15 as recovery agents of Cu (II)-sulfate solutions: Adsorption efficiency,functional stability and reusability aspects [J].Journal of Hazardous Materials, 2012, 223-224: 53-62.
[5]QU R, ZHANG Y, QU W, et al.Mercury adsorption by sulfurand amidoxime-containing bifunctional silica gel based hybrid materials [J].Chemical Engineering Journal, 2013, 219: 51-61.
[6]ABDEL-FATTAHA T M, HAGGAG S M S, MAHMOUD M E.Heavy metal ions extraction from aqueous media using nanoporous silica [J].Chemical Engineering Journal, 2011, 175:117-123.
[7]SAHA R, SAHANA A, DAS S, et al.Solid phase preconcentration of cobalt (II) using pyridine-thiocyanate reagents: X-ray crystal structure of the extracted ternary cobalt(II) complex [J].Chemical Engineering Journal, 2011, 174: 58-67.
[8]FAN H T, WU J B, FAN X L, et al.Removal of cadmium (II)and lead (II) from aqueous solution using sulfur-functionalized silica prepared by hydrothermal-assisted grafting method [J].Chemical Engineering Journal, 2012, 198–199: 355-363.
[9]WLOCH J, ROZWADOWSKI M, LEZANSKA M, et al.Analysis of the pore structure of the MCM-41 materials [J].Applied Surface Science, 2002, 191: 368-374.
[10]FENG X, FRYXELL G E, WANG L Q, et al.Functionalized monolayers on ordered mesoporous supports [J].Science, 1997,276(5314): 923-926.
[11]LIU J, FENG X, FRYXELL G E, et al.Hybrid mesoporous materials with functionalized monolayers [J].Advanced Materials, 1998, 10(2): 161-165.
[12]KUMAR R, BARAKAT M A, DAZA Y A, et al.EDTA functionalized silica for removal of Cu (II), Zn (II) and Ni (II)from aqueous solution [J].Journal of Colloid and Interface Science, 2013, 408: 200-205.
[13]LAM K F, FONG C M, YEUNG K L, et al.Selective adsorption of gold from complex mixtures using mesoporous adsorbents [J].Chemical Engineering Journal, 2008, 145(2):185-195.
[14]HUANG Y, YANG C, SUN Z, et al.Removal of cadmium and lead from aqueous solutions using nitrilotriacetic acid anhydride modified ligno-cellulosic material [J].RSC Advances, 2015, 5:11475-11484.
[15]GRUNA M, UNGER K K, MATSUMOTO A, et al.Novel pathways for the preparation of mesoporous MCM-41 materials: Control of porosity and morphology [J].Microporous& Mesoporous Materials, 1999, 27(2): 207-216.
[16]GURGEL L V A, GIL L F.Adsorption of Cu (II), Cd (II) and Pb (II) from aqueous single metal solutions by succinylated twice-mercerized sugarcane bagasse functionalized with triethylenetetramine [J].Water Research, 2009, 43: 4479-4488.
[17]BECK J S, VARTUALI J C, ROTH W J, et al.A new family of mesoporous molecular sieves prepared with liquid-crystal mechanism [J].Journal of the American Chemical Society,1992, 114(27): 10834-10843.
[18]LARGITTE L, GERVELAS S, TANT T, et al.Removal of lead from aqueous solutions by adsorption with surface precipitation[J].Adsorption, 2014, 20: 689-700.
[19]CHAO H P, CHEN S H.Adsorption characteristics of both cationic and oxyanionic metal ions on hexadecyltrimethylammonium bromide-modified NaY zeolite[J].Chemical Engineering Journal, 2012, 193: 283-289.
[20]BHAT A, MEGERI G B, THOMAS C, et al.Adsorption and optimization studies of lead from aqueous solution using γ-alumina [J].Journal of Environmental Chemical Engineering, 2015, 3: 30-39.
[21]WANG R, SHIN C H, PARK S, et al.Removal of lead (II) from aqueous stream by chemically enhanced kapok fiber adsorption[J].Environmental Earth Science, 2014, 72: 5221-5227.
[22]LAM K F, CHEN X, MCKAY G, et al.Anion effect on Cu2+adsorption on NH2-MCM-41 [J].Industrial & Engineering Chemistry Research, 2008, 47(23): 9376-9383.