西藏沙棘叶片黄酮含量与生态因子的相关性
李小伟 ,张宏涛,张泽婧
1.宁夏大学西北土地退化与生态恢复重建省部共建国家重点实验室培育基地,宁夏 银川 750021;2.宁夏大学农学院,宁夏 银川 750021;3.西北师范大学生命科学学院,甘肃 兰州 730070
西藏沙棘(Hippophae tibetanaSchlecht.)是胡颓子科沙棘属植物,是分布于青藏高原东南缘的一种高山灌木,能与弗兰克氏菌共生固氮,是人工造林的主要先锋树种(廉永善,2000)。其海拔分布范围为2800~5200 m,主要生长在沙质土壤的河岸或山坡,山谷和高山草甸。近年来,沙棘属植物引起了全世界的关注,主要是因为它具有较高的药用和营养价值(Vahid et al.,2004;Tom et al.,2009;Yang et al.,2009;Geetha et al.,2011)。在传统藏药和蒙药中,沙棘属植物被用于治疗病人;在 20世纪 50年代以来,在亚洲和欧洲逐渐出现了许多源于栽培和野生的沙棘医药产品,以中国和俄罗斯尤为常见(廉永善,2000)。
目前,大量植物化学研究表明,沙棘属植物叶片含有有益于人体健康的黄酮物质(廉永善,2000),具有重要的药用价值,在医药和保健品产业中被广泛使用(Vahid et al.,2004)。沙棘黄酮能够增强心脏收缩和舒张功能,具有抗心率失常、抗心肌缺氧缺血、增强免疫、降低血清胆固醇,同时还具有抗肿瘤、老化和消炎等广泛的药理功效(廉永善,2000;Gupta et al.,2006;Mishra et al.,2008;Geetha et al.,2009)。黄酮物质主要以苷元的形式存在于沙棘属植物的叶子和果实中(Chen et al.,2013)。以往对中国沙棘和西藏沙棘叶片黄酮的研究表明:两种沙棘叶在黄酮成分组成上差异较小,总黄酮由以杨梅素(Myrica)、槲皮素(Quercetin)、山奈酚(Kaempferol)和异鼠李素(Isorhamnetin)为主要苷元的数十种黄酮苷类化合物所组成(Vahid et al.,2004;秦振娴等,2016;洪道鑫等,2017)。槲皮素是人类营养谱中的一个主要的糖苷配基,被认为是一种有效的自由基清除剂,对几种类型的癌症和心血管疾病具有药理功效(Knekt et al.,2002)。山奈酚具有强抗氧化性,可降低冠状动脉心脏疾病的风险(Kim et al.,2008)。异鼠李素在人心血管疾病方面亦具有疗效(Ibarra et al.,2003)。
沙棘叶片中总黄酮的组成和含量会受到生长环境的影响,药材品质亦会受到间接影响(苏锦松等,2017)。然而,目前没有学者系统地研究过西藏沙棘黄酮组成和含量与环境因子的关系。鉴于上述原因,本研究以西藏沙棘叶片为研究材料,借助高效液相色谱(RP-HPLC)检测技术,测定4种主要黄酮含量,研究黄酮含量与生态因子的关系,以揭示影响西藏沙棘叶片黄酮含量的主要生态因子。
1 材料与方法
1.1 样地设置
根据西藏沙棘在青藏高原的自然分布情况,选取了 26个自然种群作为样地,整个样地位于青藏高原东南部,包括甘肃、青海省、四川3个省区,地理位置为纬度 31°~38°N,经度 99°~103°E,海拔2890~4046 m(图 1)。
1.2 样品的采集
于2011年8月进行植物样品的采集,在每个样地选取30个个体,每个个体采集5片叶片,叶片均向阳成熟且生长良好,没有病、虫斑。
1.3 样品的测定
1.3.1 仪器和试剂
美国Agilent 1100高效液相色谱仪,由自动脱气系统、全自动进样器、四元泵、紫外可变波长检测器、Chem stations色谱工作站组成。RE-52AA型旋转蒸发器(上海雅荣生化设备仪器有限公司),AR-2140型分析天平(梅特勒-托利多仪器上海有限公司),KQ-160TDE型超声清洗器(昆山市超声仪器有限公司),SHB-III型循环水式多用真空泵(郑州长城科工贸有限公司)。HPLC用Fisher公司生产的色谱纯甲醇试剂,水为双蒸水;其余所用试剂均为分析纯。
1.3.2 对照品
杨梅素(529-44-2,纯度98%)、槲皮素(批号117-39-5,纯度98%)、山奈素(批号520-18-3,纯度98%)和异鼠李素对照品(批号480-19-3,纯度98%)。
1.3.3 色谱条件
美国 Agilent 1100高效液相色谱仪,Welch Ultimate®AQ-C18柱(250.0 mm×4.6 mm,5 μm);检测波长370 nm;柱温25 ℃;流动相由甲醇(A)、乙腈(B)、0.1%磷酸溶液组成(C),采用梯度洗脱,运行时间 24 min;进样量 10 μL,流速为 1 mL·min-1。其梯度洗脱条件如下:0~10 min,12% A,20% B,68% C;10~18 min,52% A,48%C;18~24 min,72% A,28% C。在此色谱条件下,样品中各组分的色谱峰分离度良好。
1.3.4 供试样品溶液的制备
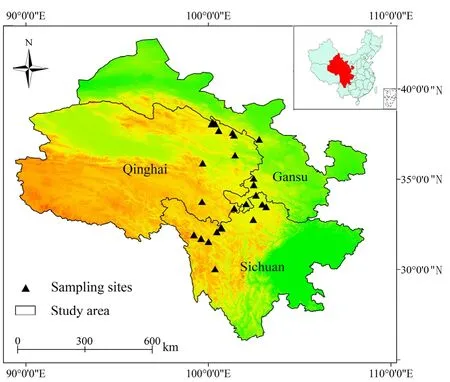
图1 本研究西藏沙棘采样点Fig.1 Sampling sites of Hippophae tibetana Schlecht. in this study
取适量冷藏的沙棘叶片样品,在研钵中磨细,并过100目筛。在50 ℃下真空干燥4 h。称取1 g沙棘细粉于50 mL三角瓶中,加入30 mL 70%甲醇,在功率为80 W、水温为30 ℃的条件下超声提取30 min,提取液冷却至室温后进行抽滤,重复 3次,合并滤液。在旋转蒸发仪上浓缩滤液精密量取滤液15 mL于 100 mL圆底烧瓶中,加入 22.5 mL 2 mol·L 盐酸,在95 ℃条件下加热回流45 min后冰浴,冷却后加入11.25 mL异戊醇(Isoamylalkohol,IAA)进行萃取,剧烈晃动,使上相和下相分离,用移液枪吸取上相液体(含有水解的黄酮类物质),甲醇定容于50 mL容量瓶中,经0.45 μm微孔滤膜过滤,取滤液作为供试溶液(Zhang et al.,2005;Zu et al.,2006)。
1.3.5 标准曲线的制作
分别称取10 mg槲皮素、2.5 mg山奈素和10 mg异鼠李素、1 mg杨梅素对照品于烧杯中,用甲醇溶解并转移至50 mL容量瓶中,定容,分别配得0.2、0.05、0.2、0.02 mg·mL-1对照品溶液,然后进行浓度梯度稀释。吸取 10 μL进样,以进样浓度(mg·mL-1)为横坐标,峰面积为纵坐标绘制标准曲线,对照品槲皮素、山奈酚、异鼠李素和杨梅素进样浓度-峰面积均呈良好的线性关系,结果见表1。
1.4 气象数据获取
根据每个采样点的地理坐标,从全球气象数据库(http://www.worldclim.org)获取(Hijmans et al.,2005)气象数据,主要包括年均温度、年均降雨量、年平均最低温、年平均最高温、风速、1月平均温度、7月平均气温、水蒸汽压。
1.5 数据分析
运用SPSS(IBM,Chicago,IL,USA;2008)对西藏沙棘叶片黄酮平均值、分布范围、变异特征和正态分布进行统计分析。运用Canoco 4.5软件中的冗余分析(Redundancy Analysis,RDA)方法分析西藏沙棘叶片黄酮含量与生态因子之间的相互关系。显著度水平设为0.05。
2 结果
2.1 西藏沙棘叶片黄酮含量特征
西藏沙棘叶片中杨梅素、槲皮素、山奈酚、异鼠李素平均含量分别为(0.13±0.07)、(2.00±0.50)、(1.08±0.29)、(3.51±0.54) mg·g-1。叶片杨梅素、槲皮素、山奈酚、异鼠李素平均含量排序为:异鼠李素>槲皮素>山奈酚>杨梅素(见表2、表3)。
2.2 西藏沙棘叶片黄酮含量与气候因子的关系
不同种群沙棘黄酮含量与生态因子 RDA排序(如图 2所示)结果显示,第一和第二主轴分别解释了西藏沙棘黄酮变量57.6%和2.3%的方差。图中箭头越长,表示对黄酮含量的解释量越大。箭头之间的角度代表了变量间的相关性。因此,西藏沙棘总黄酮、异鼠李素、槲皮素和杨梅素含量与海拔(F=9.723,P=0.006)、1 月气温(F=5.525,P=0.014)、年均降雨量(F=5.425,P=0.022)、水蒸汽压(F=3.682,P=0.048)呈现显著正相关关系,而与年平均最低温(F=3.621,P=0.06)、年均温度(F=3.279,P=0.074)、年平均最高温(F=2.800,P=0.096)和7月气温(F=0.753,P=0.424)呈不显著正相关关系;与纬度(F=8.632,P=0.004)、风速(F=2.830,P=0.090)呈负相关关系;而西藏沙棘叶片山奈酚对生态因子的响应不同于其他3种黄酮,与经度呈负相关关系(F=0.301,P=0.692)。
3 讨论
本研究采用化学成分分析和冗余分析统计方法探索了26个西藏沙棘种群4个黄酮成分对8个生态因子的响应,明确了影响西藏沙棘叶片总黄酮、异鼠李素、槲皮素和杨梅素含量的主要因素依次是海拔、1月气温、年均降雨量、水蒸汽、纬度;而山奈酚随生态因子无显著的变化规律。

表1 4种对照品的标准曲线Table1 Standard curve of four reference substances
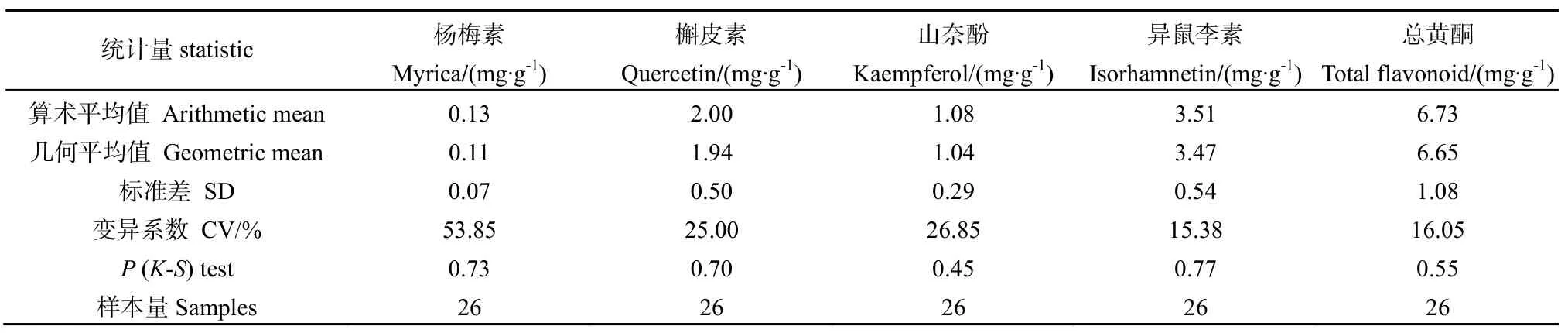
表2 西藏沙棘叶片杨梅素、槲皮素、山奈酚、异鼠李素和总黄酮含量Table2 Leaf myrica, quercetin, kaempferol, isorhamnetin, total flavonoid content in Tibetan sea-buckthorn

表3 不同种群西藏沙棘叶片黄酮质量分数Table3 Leaf flavonoid content in different Tibetan sea-buckthorn populations

图2 不同种群沙棘黄酮含量与生态因子RDA排序图Fig.2 RDA of flavonoid content and environment variables in different Tibetan sea-buckthorn populations
黄酮是一类植物重要的次生代谢产物,是植物在长期演化过程中形成的,并在防御病原体,抵御食草动物和环境胁迫方面起着重要的作用(Carlsen et al.,2008;Agati et al.,2011)。环境因素,如气候和光照能够决定植物的生长,并影响着植物体内黄酮的成分和含量(Ksouri et al.,2008;Murai et al.,2009)。因此,植物体内黄酮类化合物的组成和含量高度可塑,与其生长环境密切相关(Susanne et al.,2010)。
海拔对植物体内黄酮的累积起着重要作用,例如,不同海拔的中国沙棘叶片黄酮含量与海拔呈显著正相关关系(苏锦松等,2017)。海拔是一个影响植物生长发育和分布的间接因素,随着海拔的升高,气候逐渐变得恶劣,降水增多,年均温度下降,而辐射增强,其中以水分、温度和紫外辐射等生态因子对植物的生长发育影响最为显著(祝青林等,2005);本研究结果表明,高海拔地区西藏沙棘叶片富含较多的黄酮,说明恶劣的环境条件有利于西藏沙棘叶片黄酮的富集。诸多生态因子中,目前已有研究证实:黄酮类物质如槲皮素、杨梅素、山奈酚和异鼠李素以及花青素可以充当紫外吸收物质,具有防辐射功能,尤其是在叶表皮细胞中的积累,可以保护叶片内部组织,减少UV-B损伤(Nybakken et al.,2004;Treutter,2006),叶黄酮的累积可以提高自身的适合度;槲皮素、山柰酚、异鼠李素和杨梅素是西藏沙棘常见的黄酮苷元(秦振娴等,2016),它们的衍生物主要以糖苷的形式存在于西藏沙棘叶片细胞的液泡中。为了更好地适应当地恶劣的环境,必然分配大量的资源用于叶片黄酮的合成以充当UV-B的吸收物质,而不用于植物生长和繁殖。
1月气温高低影响着西藏沙棘的生长发育,进而影响叶黄酮累积,它是一个限制因素;而年均降水量最主要的决策因素,降水量的多少很大程度决定着土壤蒸发量和植物蒸腾作用的强弱,充足的水分供给是西藏沙棘维持正常生长发育和生理活动的重要保障,也是叶片次生代谢产物积累的前提条件。苏锦松等(2017)对同属植物中国沙棘叶片黄酮的研究表明:虽然影响中国沙棘叶片槲皮素、异鼠李素、山柰酚生态因子各有差异,但是总体都以海拔和降雨量占主导,这与本文部分研究结果一致。
4种黄酮苷元中,槲皮素、杨梅素和异鼠李素含量随空间和气候因子显示出一致的变化规律,但是山奈酚含量没有表现出任何规律。Ryan et al.(1998;2014)发现模式植物拟南芥(Arabidopsis thaliana)和牵牛花(Pharbitis nil)对UV-B辐射的响应和其他植物有差异,随着UV-B辐射逐渐升高,植物体内槲皮素/山奈酚的比率呈变大趋势,由此推断,槲皮素对UV-B辐射比山奈酚敏感,槲皮素对UV-B辐射更高效。西藏沙棘叶片山奈酚含量随空间和气候因子无显著规律,可能是由山奈酚对UV-B辐射响应的差异造成的,这有待进一步验证。
4 结论
西藏沙棘叶片杨梅素、槲皮素、山奈酚、异鼠李素平均含量分别为 0.13、2.00、1.08、3.51 mg·g-1。西藏沙棘叶片总黄酮含量与海拔、1月气温、年均降雨量和水蒸汽压呈显著正相关关系;与纬度呈显著负相关关系;说明高海拔地区有利于西藏沙棘叶片黄酮的富集。山奈酚与槲皮素、杨梅素和异鼠李素对生态因子的响应不一致。
参考文献:
AGATI G, BIRICOLTI S, GUIDI L, et al. 2011. The biosynthesis of flavonoids is enhanced similarly by UV radiation and root zone salinity inL.vulgareleaves [J]. Journal of Plant Physiology, 168(3): 204-212.
CARLSEN S C K, FOMSGAARD I S. 2008. Biologically active secondary metabolites in white clover (Trifolium repensL.) a review focusing on contents in the plant, plant-pest interactions and transformation [J].Chemoecology, 18(3): 129-170.
CHEN C, XU X M, CHEN Y, et al. 2013. Identification, quantification and antioxidant activity of acylated flavonol glycosides from sea buckthorn(Hippophae rhamnoidesssp.sinensis) [J]. Food Chemistry, 141(3):1573-1579.
GEETHA S, ASHEESH G. 2011. Medicinal and therapeutic potential of Sea buckthorn (HippophaerhamnoidesL.) [J]. Journal of Ethnopharmacology, 138(2): 268-278.
GEETHA S, SAIRAM M, SHARMA S K, et al. 2009. Cytoprotective and antioxidant activity of Sea buckthorn flavones (Hippophae rhamnoidesL.) against tert-butylhydroperoxide induced cytotoxicity in lymphocytes [J]. Journal of Medicinal Food, 12(1): 151-158.
GUPTA A, KUMAR R, PAL K, et al. 2006. Influence of Sea buckthorn(Hippophae rhamnoidesL.) flavone on dermal wound healing in rats[J]. Molecular and Cellular Biochemistry, 290: 193-198.
HIJMANS R J, CAMERON S E, PARRA J L, J et al. 2005. Very high resolution interpolated climate surfaces for global land areas [J].Inernational Journal of Climatology, 25: 1965-1978.
IBARRA M L, MORENO L, VERA R, et al. 2003. Effects of the flavonoid quercetin and its methylated metabolite isorhamnetin in isolated arteries from spontaneously hypertensive rats [J]. Planta Medica,69(11): 995-1000.
KIM B G, KIM J H, KIM J, et al. 2008. Accumulation of flavonols in response to ultraviolet-B irradiation in soybean is related to induction of flavanone 3-beta-hydroxylase and flavonol synthase [J]. Molecules and Cells, 25(2): 247-252.
KNEKT A, KUMPULAINEN J, JARVINEN R, et al. 2002. Flavonoid intake and risk of chronic diseases [J]. American Journal of Clinical Nutrition, 76(3): 560-568.
KSOURI R, MEGDICHE W, FALLEH H, et al. 2008. Influence of biological, environmental and technical factors on phenolic content and antioxidant activities of Tunisian halophytes [J]. Comptes Rendus Biologis, 331(11): 865-873.
MISHRA K P, CHANDA S, KARAN D, et al. 2008. Effect of Seabuckthorn(Hippophae rhamnoides) flavones on immune system: an in-vitro approach [J]. Phytotherapy Research, 22(11): 1490-1495.
MURAI Y, TAKEMURA S, TAKEDA K, et al. 2009. Altitudinal variation of UV-absorbing compounds inPlantago asiatica[J]. Biochemical Systematics and Ecology, 37: 378-384.
NYBAKKEN L, AUBERT S, BILGER W. 2004. Epidermal UV-screening of arctic and alpine plants along a latitudinal gradient in Europe [J].Polar Biology, 27(7): 391-398.
RYAN K G, SWINNY E E, WINEFIELD C, et al. 2014. Flavonoids and UV photoprotection inArabidopsismutants [J]. Zeitschrift Für Naturforschung C, 56(9-10): 745-754.
RYAN, K G, MARKHAM K R, et al. 1998. UV-B radiation induced increase in quercetin: kaempferol ratio in wild-type and transgenic lines of Petunia [J]. Photochemistry and Photobiology, 68(3): 323-330.SUSANNE S, MICHAELA Z, MONIKA S, et al. 2010. Genotypic and climatic influences on the concentration and composition of flavonoids in kale (Brassica oleraceavar.sabellica) [J]. Food Chemistry, 119(4):1293-1299.
TOM B, THOMAS S C, ALLEN S. 2009. Sea buckthorn products:manufacture and composition [J]. Journal of Agricultural and Food Chemistry, 47(9): 3480-3488.
TREUTTER D. 2006. Significance of flavonoids in plant resistance: a review [J]. Environmental Chemistry Letters, 4: 147-157.
VAHID B G, MUSTAFA G, ALI Y. 2004.Hippophae rhamnoidesL.:chromatographic methods to determine chemical composition, use in traditional medicine and pharmacological effects [J]. Journal of Chromatography B, 812(1-2): 291-307.
YANG B R, HALTTUNEN T, RAIMO O, et al. 2009. Flavonol glycosides in wild and cultivated berries of three major subspecies ofHippophaë rhamnoidesand changes during harvesting period [J]. Food Chemistry,115(2): 657-664.
ZHANG Q, CUI H. 2005. Simultaneous determination of quercetin,kaempferol, and isorhamnetin in phytopharmaceuticals ofHippophae rhamnoidesL. by high-performance liquid chromatography with chemiluminescence detection [J]. Journal of Separation Science,28(11): 1171-1178.
ZU Y, LI C, FU Y, ZHAO C. 2006. Simultaneous determination of catechin,rutin, quercetin kaempferol and isorhamnetin in the extract of sea buckthorn (Hippophae rhamnoides L.) leaves by RP-HPLC with DAD[J]. Journal of Pharmaceutical and Biomedical Analysis, 41(3): 714-719.
洪道鑫, 张雨欣, 李轩豪, 等. 2017. 西藏沙棘叶黄酮类化学成分的研究[J]. 中药材, 40(4): 862-865.
廉永善. 2000. 沙棘属植物生物学和化学[M]. 兰州: 甘肃科学技术出版社.
秦振娴, 张瑜, 齐梦蝶, 等. 2016. 中国沙棘和西藏沙棘叶中化学成分的UPLC/Q-TOF-MS快速分析[J]. 中国中药杂志, 41(8): 1461-1468.
苏锦松, 赵彩云, 文检, 等. 2017. 中国沙棘叶黄酮类成分与生态因子相关性及其生态适宜性研究[J]. 中国中药杂志, 42(10): 1865-1870.
祝青林, 于贵瑞, 蔡福, 等. 2005. 中国紫外辐射的空间分布特征[J]. 资源科学, 27(1): 108-113.

